扩展功能
文章信息
- 周芝文, 杨期东, 任翔, 郑丽君, 周文胜, 李爱平
- ZHOU Zhi-Wen, YANG Qi-Dong, REN Xiang, ZHENG Li-Jun, ZHOU Wen-Sheng, LI Ai-Ping
- Notch信号通路在大鼠局灶性脑缺血再灌注损伤恢复期的表达变化
- Change in the expression of the Notch signaling pathway in rats with focal cerebral ischemia/reperfusion injury during recovery
- 国际神经病学神经外科学杂志, 2018, 45(5): 466-470
- Journal of International Neurology and Neurosurgery, 2018, 45(5): 466-470
-
文章历史
收稿日期: 2018-06-08
修回日期: 2018-09-25
2. 中南大学湘雅医院神经内科, 湖南省长沙市 410008;
3. 湖南省人民医院(湖南师范大学第一附属医院)康复科, 湖南省长沙市 410016
脑血管疾病是当今人类三大死亡原因之一,其中缺血性脑血管病占据绝大部分。了解脑缺血后病理生理变化,寻找脑缺血的防治方法,为目前国内外学者研究的热点。Notch信号通路是一条重要的信号转导通路,在一系列生理、病理过程中发挥重要作用。研究表明,Notch信号通路对神经细胞的增殖、凋亡和分化发挥重要的作用[1, 2],同时参与神经可塑性调节[3]。Ren等[4]构建大鼠大脑缺血模型研究发现,恢复大脑供血24 h(再灌注)后,Notch1和NICD在大脑受损区周边的表达水平升高。陈丽等[5]发现,Notch激活片段(NICD)在脑缺血再灌注(24 h)损伤后的表达水平升高。但是,目前并未有研究对大脑缺血再灌注损伤恢复期Notch信号分子的表达水平进行研究。本实验将探讨大鼠局灶性脑缺血再灌注损伤后恢复期Notch信号通路的表达变化。
1 材料与方法 1.1 动物饲养及分组60只雄性SD(Sprague-Dawley)大鼠(8~10周龄,平均体重220~250 g),购于中南大学湘雅医学院动物饲养中心。动物实验操作严格遵照美国国立卫生研究院的准则。SD大鼠培养于塑料培养箱中(长宽高分别为40 cm、30 cm和18 cm),能够自由进食和饮水。每个饲养箱中放四只。饲养箱周围环境温度控制在(23±2)℃,光照时间为12 h,模拟白天和黑夜的生活环境。将大鼠随机分为:对照组(12只)、急性期组(24只)和恢复期组(24只)。急性期组分为3 d和7 d两个亚组,恢复期组分为15 d和30 d两个亚组
1.2 构建大鼠MCAO模型SD大鼠大脑中动脉模型(middle cerebral artery occlusion, MCAO)的构建采用经典的Longa线栓法。具体方法:腹腔注射2%水合氯醛(剂量:5 ml/kg)麻醉大鼠,颈部皮肤消毒,沿颈正中线切长约3 cm的切口,分离颈部皮下组织,依次分离右侧颈总动脉(common carotid artery, CCA)、颈外动脉(external carotid artery, ECA)及颈内动脉(internal carotid artery, ICA),近心端结扎CCA和ECA,CCA远心端处挂线,系松结。微动脉夹暂时夹闭ICA起始端,眼科剪在CCA距分叉口1 cm处剪一小口,沿ICA的切口缓慢插入直径为0.19 mm,长度为30 mm,头端经硅橡胶钝化处理的鱼线,插入深度约为(18±0.5) mm,然后固定栓线,消毒缝合皮肤。静置SD大鼠2 h。拔出栓线,诱导缺血后再灌注损伤的产生。对照组插线深度为8~10 mm,其余操作同模型组。
1.3 Real-time PCR检测液氮中取出脑组织,研碎,将组织样品转移到离心管中。按照说明书步骤操作,抽提总RNA,反转录制备cDNA。采用Primer 6.0软件进行引物设计。设计原则为:有引物指导合成的目的片段长度为80~150 bp,引物退火温度要求在60℃左右,引物需在NCBI/BLAST进行比对,检测引物特异性。引物序列如表 1所示。
| 基因名 | 引物序列(5’-3’) |
| Notch 1正义链 | CGT GCT ATG TTG TGG ACC ATG GC |
| Notch 1反义链 | CAC ACT CGT GGG TGG TGT CCC CCG |
| Notch 2正义链 | CTGA GGA CTC TTC TGC CAA C |
| Notch 2反义链 | CAG TTG ATC AGC TCT GCC AC |
| Notch 3正义链 | ATG GCA GGC TTC ACA GGA AC |
| Notch 3反义链 | TGC AGC TGA AGC CAT TGA CT |
| Notch 4正义链 | AGT GTC TCC CAG GCT TTG AA |
| Notch 4反义链 | GAA GAT CAA GGC AGC TGG CT |
| Delta-like 1正义链 | AGG ACT GTC AGC ACA AGG CT |
| Delta-like 1反义链 | TGG ACA GGT AGC TCG TGC AC |
| Delta-like 3正义链 | GCT GGA AGT GGA TTG TGG |
| Delta-like 3反义链 | CTT GTC GCT GTG AGG ATA C |
| Delta-like 4正义链 | GCT GGA AGT GGA TTG TGG |
| Delta-like 4反义链 | CTT GTC GCT GTG AGG ATA C |
| Jagged 1正义链 | ATG CGG TCC CCA CGG ACG CGC |
| Jagged 1反义链 | GCC TTT TCA ATT ATG CTA TCA GG |
| Jagged 2正义链 | GCG CCA ACT GCC ACA TCA A |
| Jagged 2反义链 | GGC TGC TGG CAC ACT TGT AG |
| Hes 1正义链 | GGG CAA GAA TAA ATG AAA G |
| Hes 1反义链 | GCG CGG TAC TTC CCC AAC AC |
| Hey 1正义链 | CAT TCT GGA AAT GAC TGT GAA |
| Hey 1反义链 | TGC TGA GCG CGG CGG CA |
| β-actin正义链 | AGA TCC TGA CCG AGC GTG GC |
| β-actin反义链 | CCA GGG AGG AAG AGG ATG CG |
常规PCR反应,以β-actin为内参,设定反应程序:在42℃的条件下反应60 min,然后在70℃的条件下反应10 min。将离心管置于冰上冷却。完成逆转录后所得cDNA模板稀释5倍后放在-80℃冰箱备用。
定量PCR设定反应程序。95℃预变性5 min,94℃变性30 s,58~64℃退火30 s,72℃延伸15 s,35个循环,最后72℃延伸5 min。
1.4 Western blot检测液氮中取出脑组织,研碎,将组织样品转移到离心管中。细胞裂解液加入离心管中裂解细胞,提取总蛋白。采用BCA蛋白检测试剂盒测定细胞裂解液中蛋白质浓度。按照蛋白浓度,加入一定量的样品上样缓冲液,将蛋白样品稀释5倍,进行SDS-PAGE蛋白电泳。通过电转印法将蛋白从聚丙烯酰胺凝胶上转移到PVDF膜上。转印后的PVDF膜放置到用PBS配制的5%脱脂牛奶中,4℃封闭过夜或在室温下摇床上封闭2 h。用Western洗涤液(P0023C)或者是PBST漂洗一次,1~2 min,取出PVDF膜,按预染Marker条带显示位置将各目的条带及内参剪开。然后将这些条带放入稀释好的一抗(Notch1和Notch2抗体)中。4℃孵育过夜或在室温下摇床上孵育1~2 h。用PBST洗膜3次,每次5 min。用同样的方法添加二抗,4℃孵育过夜或在室温下摇床孵育1 h。孵育后弃去二抗,用PBST洗膜3次,每次5~10 min。使用辣根过氧化物酶HRP-ECL发光法对PVDF膜上的蛋白进行显影。最后将PVDF膜放置在Western blot成像仪上进行扫描,拍照保存。
1.5 统计学处理采用SPSS19.0统计软件进行统计学分析。实验数据以均数±标准差(x±s)表示,组间比较用ANOVA单因素方差分析,P < 0.05表示差异有统计学意义。
2 结果 2.1 Notch信号分子mRNA表达水平Notch信号分子包括Notch配体(Delta-like 1、Delta-like 3、Delta-like 4、Jagged 1和Jagged 2)和Notch受体(Notch 1、Notch 2、Notch 3和Notch 4)。
与对照组相比,脑缺血再灌注后第3天Delta-like 1、Delta-like 3、Delta-like 4和Jagged 1表达水平明显升高(P < 0.05);第7天Jagged 1表达仍显著高于对照组(P < 0.05);第15天Delta-like 3表达水平显著低于对照组(P < 0.05);第30天Delta-like 1、Delta-like 3、Delta-like 4、Jagged 1和Jagged 2的表达水平均显著低于对照组(P < 0.05)。见表 2。
| 基因名 | 对照组(n=6) | 急性期组(n=24) | 恢复期组(n=24) | |||
| 3 d | 7 d | 15 d | 30 d | |||
| Delta-like 1 | 1±0.23 | 2.34±0.51* | 1.22±0.24 | 0.75±0.08 | 0.39±0.03* | |
| Delta-like 3 | 1±0.16 | 1.75±0.44* | 0.95±0.34 | 0.43±0.06* | 0.38±0.04* | |
| Delta-like 4 | 1±0.24 | 1.46±0.29* | 1.37±0.29 | 0.89±0.13 | 0.47±0.06* | |
| Jagged 1 | 1±0.11 | 2.14±0.49* | 1.69±0.18* | 1.18±0.14 | 0.59±0.07* | |
| Jagged 2 | 1±0.19 | 1.39±0.37 | 1.52±0.23 | 1.09±0.12 | 0.69±0.06* | |
| 注:*为与对照组比较, P < 0.05 | ||||||
与对照组相比,Notch 1和Notch 2的mRNA表达水平在脑缺血再灌注后第3天显著升高(P < 0.05);第7天Notch 2的mRNA表达水平仍然高于对照组(P < 0.05);第15天Notch 4的mRNA表达水平下降;第30天Notch 1、Notch 2、Notch 3(P < 0.05)和Notch 4(P < 0.01)的mRNA表达水平均显著低于对照组,其中Notch 4的表达水平最低。见表 3。
| 基因名 | 对照组(n=6) | 急性期组(n=24) | 恢复期组(n=24) | |||
| 3 d | 7 d | 15 d | 30 d | |||
| Notch 1 | 1±0.13 | 1.42±0.27* | 1.32±0.34 | 1.03±0.36 | 0.73±0.09* | |
| Notch 2 | 1±0.06 | 1.36±0.19* | 1.38±0.15* | 0.92±0.15 | 0.57±0.16* | |
| Notch 3 | 1±0.09 | 1.21±0.24 | 1.25±0.27 | 0.85±0.21 | 0.67±0.14* | |
| Notch 4 | 1±0.18 | 1.19±0.13 | 1.29±0.24 | 0.67±0.06* | 0.35±0.03* | |
| 注:*为与对照组比较, P < 0.05或P < 0.01 | ||||||
Hes-1和Hey-1为Notch信号的靶基因,其表达水平常作为评估Notch信号通路激活的重要标志。
与对照组相比,脑缺血再灌注后第3天Hes-1(P < 0.01)和Hey-1(P < 0.05)的表达水平均显著升高;第7天Hes-1和Hey-1的表达水平仍然高于对照组(P < 0.05);第15和30天Hes-1和Hey-1的表达水平低于对照组(P < 0.05)。见表 4。
| 基因名 | 对照组(n=6) | 急性期组(n=24) | 恢复期组(n=24) | |||
| 3 d | 7 d | 15 d | 30 d | |||
| Hes-1 | 1±0.16 | 3.67±0.51* | 1.64±0.25* | 0.72±0.11* | 0.43±0.05* | |
| Hey-1 | 1±0.19 | 2.29±0.37* | 1.42±0.20* | 0.59±0.06* | 0.48±0.08* | |
| 注:*为与对照组比较, P < 0.01或P < 0.05 | ||||||
NICD1和NICD2是Notch 1和Notch 2的激活片段,测定NICD1和NICD2的表达水平有助于了解Notch 1和Notch 2被激活的情况。
与对照组相比,NICD1和NICD2在大脑局灶性缺血后第3天表达水平显著上升(P < 0.05);第30天的表达水平显著下降(P < 0.05)。见图 1。
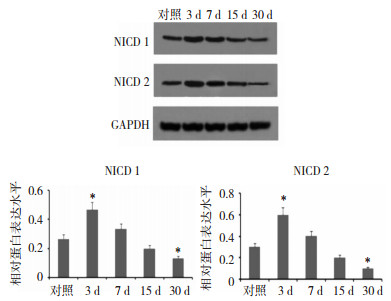
|
| 图 1 NICD1和NICD2在大脑局灶性缺血后顶叶半暗带区的表达水平 |
Notch信号通路参与了多种不同器官的缺血/再灌注损伤,尤其是心脏[6]和大脑[7]。研究证实Notch1可保护心肌细胞免受缺血再灌注损伤的影响[6, 8-10]。Arumugam等[11]报道,应用γ-分泌酶抑制剂阻断Notch信号通路,可减轻局灶性脑缺血再灌注导致的神经元损伤,Notch信号分子通过增加凋亡、激活小胶质细胞和促进炎性白细胞浸润而导致神经元损伤。Notch 1通过激活JNK/c-Jun信号通路促进缺血性神经元死亡[12]。另外,有研究表明,Notch信号分子通过抑制核因子-κB、裂解的caspase-3、4(NF-κB)和Bim的表达,对缺血的神经元起保护作用[13]。Zhao等[14]采用电针预处理治疗缺血性损伤也得到了类似的结果。Sun等[15]研究提示,Notch 1和Jagged 1信号转导调控正常和缺血条件下老年脑室下区神经发生。这些研究均表明Notch信号通路参与了缺血性脑损伤的病理过程。
本研究发现大鼠脑缺血再灌注后急性期Notch信号被显著激活。脑缺血再灌注后第3天,NICD1和NICD2的表达水平显著升高。Hes-1和Hey-1为Notch信号的靶基因,其表达水平常作为评估Notch信号激活的重要指标。与上述结果一致,Hes-1和Hey-1的mRNA表达水平在脑缺血再灌注后第3天显著升高。与Ren等[4]和陈丽等[5]研究结果一致。但是之前并未有研究报道脑缺血再灌注损伤恢复期Notch信号分子的表达变化。本实验发现Notch信号分子在脑缺血再灌注损伤恢复期的表达水平下降。第30天Notch配体包括Delta-like 1、Delta-like 3、Delta-like 4、Jagged 1和Jagged 2的表达水平均显著低于对照组。此外,第30天,Notch 1、Notch 2、Notch 3、Notch 4、Hes-1和Hey-1的mRNA表达水平亦显著低于对照组。NICD1和NICD2的蛋白水平也显著降低。这些证据表明Notch信号通路在脑缺血再灌注损伤恢复期被显著抑制。
Zhang等[16]研究发现,Notch3和Notch4在大鼠缺血再灌注一星期后在大脑梗死区的表达水平显著升高。程连臣等[17]研究了Notch1对脑局灶性缺血再灌注损伤后神经细胞凋亡的影响,发现NICD1在缺血后再灌注的第1天、第3天和第7天均明显升高,其中第3天的表达水平最高。这与我们的研究结果一致。程连臣等[18]还发现,对大鼠注射Notch1的抑制剂DAPT后,神经细胞的凋亡率增加,他们认为Notch1信号抑制了脑局灶性缺血再灌注损伤后神经细胞的凋亡。但是Shi等[18]发现,MicroRNA-137通过降低Notch1的表达水平抑制缺血再灌注致神经细胞损伤,抑制Notch1信号增强了MicroRNA-137对缺血再灌注后神经细胞的保护作用,促进Notch1信号抑制了MicroRNA-137对缺血再灌注后神经细胞的保护作用,这提示缺血再灌注后Notch1表达水平升高导致了神经元损伤。Meng等[19]研究发现,采用DAPT抑制Notch信号或siRNA基因敲除Notch2,增加了小鼠大脑缺血再灌注后神经细胞的活力,同时增强了神经干细胞的分化能力。Notch信号对脑局灶性缺血再灌注损伤后神经细胞的作用还有待进一步的研究。大多数的学者认为Notch信号可能具有两面性,既有其有利的一面,也有有害的一面。抑制Notch信号的过度激活,或者防止Notch信号被过度抑制,可能有助于Notch信号发挥正常的生理功能,从而起到神经保护作用。
| [1] |
Geng X, Sun T, Li JH, et al. Electroacupuncture in the repair of spinal cord injury:inhibiting the Notch signaling pathway and promoting neural stem cell proliferation[J]. Neural Regen Res, 2015, 10(3): 394-403. DOI:10.4103/1673-5374.153687 |
| [2] |
Ha YP, Wang ZL, Lei H, et al. Effects of over-expression of Notch1 intracellular domain on the differentiation of c-Kit+ bone marrow mesenchymal stem cells[J]. Zhongguo Zuzhi Gongcheng Yanjiu, 2016, 20: 785-792. |
| [3] |
王珏, 邓宇斌, 万勇. Notch信号通路对神经干细胞增殖分化的作用[J]. 中国细胞生物学学报, 2014, 36(5): 708-712. |
| [4] |
Ren C, Li S, Wang B, et al. Limb remote ischemic conditioning increases Notch signaling activity and promotes arteriogenesis in the ischemic rat brain[J]. Behav Brain Res, 2016, 3(16): 901-909. |
| [5] |
陈丽, 叶军明, 王力峰, 等. Notch细胞内片段(NICD)在脑缺血再灌注损伤后的表达[J]. 赣南医学院学报, 2011, 31(6): 686-687. DOI:10.3969/j.issn.1001-5779.2011.06.007 |
| [6] |
Yu L, Li F, Zhao G, et al. Protective effect of berberine against myocardial 11 ischemia reperfusion injury:role of Notch1/Hes1-PTEN/Akt signaling[J]. Apoptosis, 2015, 20(6): 796-810. DOI:10.1007/s10495-015-1122-4 |
| [7] |
Baik SH, Fane M, Park JH, et al. Pin1 promotes neuronal 14 death in stroke by stabilizing Notch intracellular domain[J]. Ann Neurol, 2015, 77(3): 504-516. DOI:10.1002/ana.v77.3 |
| [8] |
Pei H, Song X, Peng C, et al. TNF-alpha inhibitor protects against myocardial 19 ischemia/reperfusion injury via Notch1-mediated suppression of oxidative/nitrative stress[J]. Free Radic Biol Med, 2015, 82: 114-121. DOI:10.1016/j.freeradbiomed.2015.02.002 |
| [9] |
Xu H, Jin L, Chen Y, et al. Downregulation of microRNA-429 protects cardiomyocytes against 22 hypoxia-induced apoptosis by increasing Notch1 expression[J]. Int J Mol Med, 2016, 37(6): 1677-1685. DOI:10.3892/ijmm.2016.2558 |
| [10] |
Boccalini G, Sassoli C, Formigli L, et al. Relaxin protects cardiac muscle cells from 2 hypoxia/reoxygenation injury:involvement of the Notch-1 pathway[J]. FASEB J, 2015, 29(1): 239-249. DOI:10.1096/fj.14-254854 |
| [11] |
Arumugam TV, Chan SL, Jo DG, et al. Gamma secretase-mediated 4 Notch signaling worsens brain damage and functional outcome in ischemic stroke[J]. Nat Med, 2006, 12(6): 621-623. DOI:10.1038/nm1403 |
| [12] |
Cheng YL, Choi Y, Seow WL, et al. Evidence that neuronal 14 Notch-1 promotes JNK/c-Jun activation and cell death following ischemic stress[J]. Brain Res, 2014, 1586: 193-202. DOI:10.1016/j.brainres.2014.08.054 |
| [13] |
Arumugam TV, Cheng YL, Choi Y, et al. Evidence that 7 gamma-secretase-mediated Notch signaling induces neuronal cell death via the nuclear 8 factor-kappaB-Bcl-2-interacting mediator of cell death pathway in ischemic stroke[J]. Mol Pharmacol, 2011, 80(9): 23-31. |
| [14] |
Zhao Y, Deng B, Li Y, et al. Electroacupuncture pretreatment attenuates cerebral ischemic injury via notch pathway-mediated up-regulation of hypoxia inducible factor-1alpha in rats[J]. Cell Mol Neurobiol, 2015, 35(8): 1093-1103. DOI:10.1007/s10571-015-0203-9 |
| [15] |
Sun F, Mao X, Xie L, et al. Notch1 signaling modulates neuronal progenitor activity in the subventricular zone in response to aging and focal ischemia[J]. Aging Cell, 2013, 12(6): 978-987. DOI:10.1111/acel.2013.12.issue-6 |
| [16] |
Zhang HL, Hu J, Wang J, et al. Expressions of Notch3, Notch4, Frizzled2 and Tead1 in rats with focal cerebral ischemia-reperfusion[J]. Zhonghua Yi Xue Za Zhi, 2015, 95(46): 3766-3769. |
| [17] |
程连臣, 王昊, 徐川, 等. Notch1对局灶性脑缺血再灌注损伤后神经细胞凋亡的影响[J]. 中国生化药物杂志, 2015, 35(2): 59-62. |
| [18] |
Shi F, Dong Z, Li H, et al. MicroRNA-137 protects neurons against ischemia/reperfusion injury through regulation of the Notch signaling pathway[J]. Exp Cell Res, 2017, 52(1): 1-8. |
| [19] |
Meng S, Su Z, Liu Z, et al. Rac1 contributes to cerebral ischemia reperfusion-induced injury in mice by regulation of Notch2[J]. Neuroscience, 2015, 306: 100-114. DOI:10.1016/j.neuroscience.2015.08.014 |
 2018, Vol. 45
2018, Vol. 45




