扩展功能
文章信息
- 张超, 田沃土, 詹飞霞, 朱泽宇, 曹茜, 曹立
- ZHANG Chao, TIAN Wo-Tu, ZHAN Fei-Xia, ZHU Ze-Yu, CAO Xi, CAO Li
- 亨廷顿舞蹈病的临床特征及基因分析
- Clinical and genetic features of Huntington's disease
- 国际神经病学神经外科学杂志, 2018, 45(5): 461-465
- Journal of International Neurology and Neurosurgery, 2018, 45(5): 461-465
-
文章历史
收稿日期: 2018-06-13
修回日期: 2018-09-14
2. 上海交通大学医学院附属瑞金医院神经内科, 上海市 200025;
3. 上海浦东风信子亨廷顿舞蹈病关爱中心, 上海市 200001
亨廷顿舞蹈病(Huntington's disease, HD)是一种罕见的常染色体显性遗传性神经退行性疾病,症状复杂多变,以慢性进行性舞蹈样动作、认知功能障碍和精神行为异常为主要临床特征,一般中年期发病,平均发病年龄为35~44岁,病情进行性恶化,常在发病15~18年后死亡[1]。中年期发病者主要以全身舞蹈样动作为主,逐渐出现痴呆和精神障碍;儿童和青少年期发病者多以肌张力障碍为主,常伴癫痫和共济失调[1, 2]。神经影像学特征为大脑皮质和双侧尾状核萎缩,伴有脑室扩大[3]。亨廷顿舞蹈病由亨廷顿蛋白基因(huntingtin, HTT,又称IT15)突变所致,HTT基因定位于4p16.3,编码HTT蛋白(huntingtin protein),其1号外显子内存在高度多态的胞嘧啶-腺嘌呤-鸟嘌呤(CAG)重复序列,CAG异常扩增是导致亨廷顿舞蹈病发生的原因[1, 4]。正常人群的HTT基因(CAG)n拷贝数为11~35次,平均为19次;CAG重复扩增数小于26为正常等位基因;重复扩增数在27~35范围内的个体没有发展亨廷顿舞蹈病症状的风险,也被描述为“可变正常等位基因”,但由于CAG区不稳定,会增加子代患病的风险[5, 6]。重复扩增数36~39内的个体存在发病的风险,可能不会出现症状[1]。重复扩增数在大于39次为全突变,肯定发病。
1 对象与方法 1.1 研究对象研究对象来自上海交通大学医学院附属瑞金医院神经内科以及上海浦东风信子亨廷顿舞蹈病关爱中心的亨廷顿舞蹈病患者及其家系成员,包括45个家系的72名家族成员。本研究已取得患者及家系成员知情同意,并签署知情同意书。
1.2 研究方法根据亨廷顿舞蹈病临床诊断标准:典型HD的家族史;非其他因素导致的进行性运动异常伴舞蹈和僵直;非其他因素导致的精神障碍伴随进行性痴呆[7],共收集45个家系的先证者及家系成员共72人临床资料,并采用简易精神状态评价量表(mini-mental state examination, MMSE)对HD患者及其家系成员的精神状态进行评分。采集外周静脉血6 ml,并采用标准的酚-氯仿方法提取外周血DNA。聚合酶链式反应(Polymerase Chain Reaction, PCR)扩增HTT基因1号外显子,再进行毛细管电泳片段分析。
1.3 PCR扩增及毛细管电泳片段分析根据HTT基因的1号外显子序列,在primer 3.0网站设计两端引物。经荧光标记正反向的引物由铂尚生物技术(上海)有限公司合成。正向引物序列(HTT-F):5’-GGCGGCTGAGGAAGCTGAGGA-3’;反向引物序列(HTT-R):5’-ATGGCGACCCTGGAAAAGCTGATGAA-3’。
PCR反应体系:总体积20 μl,依次加入ddH2O 3.12 μl,2*GC Buffer 10 μl,dNTP 2.4 μl,样本DNA 2 μl(DNA样本稀释定量至100 ng/μl),HotStar Taq (Takara) 0.2 μl,正反向引物(1 μm)各1 μl,MgCl2(25 mm) 0.4 μl。反应条件为95℃预变性2 min,95℃ 20 s、72℃ 40 s和68℃ 2 min,循环11次;94℃ 20 s、66℃ 30 s、68℃ 2 min,循环28次;60℃ 60 min,温度降至4℃停止。将加荧光后的多重PCR产物稀释5倍后取1 μl加入8.9 μl高度去离子甲酰胺,以0.1 μl LIZ500片段作为标准内标,混匀后95℃ 5 min变性后上ABI 3700核酸测序仪进行荧光毛细管电泳。
1.4 统计学方法使用SAS 8.1软件进行数据处理和分析,对符合正态分布的计量资料以均数±标准差(x±s)表示。组间比较采用Fisher确切概率计算法(n < 50)分析;对发病年龄和病理重复拷贝数进行线性回归分析,以P < 0.05为差异具有统计学意义。
2 结果 2.1 临床资料特征共入组45个亨廷顿舞蹈病家系,先证者及家系成员共72人,分布于全国20个省市。HTT基因检测阳性〔(CAG)n拷贝数大于39次〕共56人,男性32人,女性24人,遗传规律符合常染色体显性遗传。其中35人已发病,21人目前暂未发病,无临床症状,为症状前患者。35例患者发病年龄14~67岁,平均发病年龄为(39.34±10.93)岁;病程范围3个月~19年,平均病程(4.89±4.08)年。其中青少年期发病患者1人,14岁发病。其余34名患者均在青少年期以后发病。见表 1。
| [n(%); x±s] | ||
| 项目 | 已发病(n=35) | 尚未发病(n=21) |
| 性别(男/女) | 19/16 | 13/8 |
| 就诊年龄(岁) | 44.23±12.24 | 23.32±9.48 |
| 发病年龄(岁) | 39.34±10.93 | - |
| 病程(年) | 4.89±4.09 | - |
| 临床表现 | ||
| 舞蹈样动作 | 35 (100) | - |
| 精神行为异常 | 17 (48.57) | - |
| 认知功能障碍 | 11 (31.42) | - |
| 构音障碍 | 9 (25.71) | - |
| 吞咽困难 | 4 (11.43) | - |
| 肌张力障碍 | 1 (2.86) | - |
| 视力下降 | 1 (2.86) | - |
| 排尿障碍 | 1 (2.86) | - |
| MMSE评分(分) | 23.32 ±4.94 | - |
| CAG重复次数(次) | 45.06±5.37 | 43.95±3.9 |
已发病的35名患者中,临床表现各异,存在一定的临床异质性。首发症状均为舞蹈样动作,部分患者伴有精神行为异常、认知功能障碍的组合形式同时出现。35名患者临床表现为舞蹈样动作(35人,100%)、精神行为异常(17人,48.57%)、认知功能障碍(11人,31.42%)、构音障碍(9人,25.71%)、吞咽困难(4人,11.43%)、肌张力障碍(1人,2.86%)、视力下降(1人,2.86%)和排尿障碍(1人,2.86%)。21名患者舞蹈样由头面部(包括头部摇晃、眨眼、口周及唇抽动)最先被家属察觉,之后逐渐发展至四肢及躯干,其余14名患者舞蹈样动作由四肢及躯干开始。认知功能障碍表现为记忆力下降和智能减退。精神行为异常主要表现为性格改变、易激惹、妄想和定向力障碍。见表 1。
2.3 认知功能评估经MMSE量表评估患者共22人。评分标准:凡评分低于以下范围者视为认知功能损害,即文盲≤17分、小学≤20分、初中及以上≤24[8],受试者文化程度均为初中及以上。MMSE得分最低8分,最高29分,平均(23.32±4.94)分。11人存在一定程度认知功能障碍(MMSE评分 < 24分)。将受评估患者根据平均病程(5.59年)分成2组。2组患者均在成年期起病,年龄30~60岁,男女比为1.2 : 1,就诊前均未确诊,无其他基础疾病,未行相关治疗,一般情况正常。病程 < 5年患者10人,MMSE评分 < 24分患者2人;病程>5年患者12人,评分 < 24分患者9人。组间比较采用Fisher确切概率计算法(n < 50),MMSE评分 < 24分人数频率在不同病程组比较差异有统计学意义(P < 0.05),提示病程>5年的患者较病程 < 5年的患者更易出现认知功能障碍。
2.4 遗传学特征对72个样本进行毛细管电泳的片段分析。结果发现共有16种CAG病理拷贝等位基因,最小为39次,最大为64次,平均(44.64±4.87)次;病理拷贝数41次最为常见,有15例,占病理重复等位基因的20.83%。将所有HD患者的发病年龄与HTT基因CAG病理拷贝数进行线性回归分析,发现两者之间呈负相关(r=-0.769, P=0.000)。见图 1。
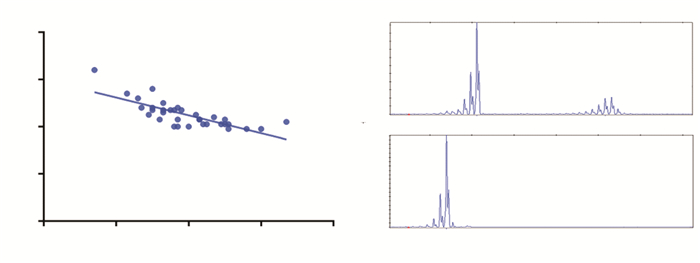
|
| 图 1 HD患者的遗传学特征 注:A:HD患者发病年龄和CAG重复拷贝数散点图;B:HD患者毛细管电泳图;C:正常人毛细管电泳图 |
HD是一种罕见的常染色体显性遗传性神经变性疾病,HTT基因CAG三核苷酸重复扩增引起特异性基底节及大脑皮质神经元退行性病变[9],核心症状为慢性进行性舞蹈样动作、认知功能障碍和精神行为异常,部分患者还存在吞咽困难、肌张力障碍、构音障碍和共济失调等[1, 10]。全世界范围内HD总体患病率为2.1/10万,亚洲患病率较低,为0.4/10万;欧美地区明显高于亚洲,为5.70/10万[11]。不同民族疾病患病率的差异与HTT基因的遗传差异有关。高患病率地区正常人群平均CAG重复次数较长,欧洲正常人群平均值为18.4~18.7次,而亚洲正常人群的平均值为16.9~17.4次[9]。
既往研究对出现运动症状的首发部位尚无明确总结。本研究60%患者舞蹈样动作由头面部(包括头部摇晃、眨眼、口周及唇抽动)最先被家属察觉,之后逐渐发展至四肢及躯干;40%患者舞蹈样动作由四肢及躯干开始。以头面部不自主动作为首发症状的HD不易察觉,常被忽视。值得注意的是以口周不自主动作伴有咬唇、流涎为首发症状的舞蹈病需与神经棘红细胞增多症等鉴别[12]。舞蹈样动作作为HD核心症状,对诊断具有重要的意义。对存在舞蹈样动作且HTT基因检测阴性的患者,应考虑其他类亨廷顿舞蹈病的鉴别诊断,包括类亨廷顿舞蹈病1型(Huntington disease-like 1, HDL1)、类亨廷顿舞蹈病2型(Huntington disease-like 2, HDL2)、类亨廷顿舞蹈病3型(Huntington disease-like 3, HDL3)、类亨廷顿舞蹈病4型(Huntington disease-like 4, HDL4)、肝豆状核变性、神经棘红细胞增多症、齿状核苍白球萎缩、泛酸激酶相关性神经变性病、神经铁蛋白病、脊髓小脑性共济失调(1型、2型和3型)、弗里德赖希型共济失调、线粒体疾病和血浆铜蓝蛋白缺乏症等遗传性疾病[13]。除遗传因素引起的舞蹈样动作,一些非遗传因素导致舞蹈样动作的疾病也需与其鉴别,非遗传因素包括感染、免疫、创伤、药物、电解质失衡、肝肾器官衰竭、心脏术后和乳糜泻等[13]。非遗传因素可通过家族史是否符合常染色显性遗传规律鉴别。
认知功能障碍作为除舞蹈样动作外第二大核心症状,对HD诊断亦具有重要意义,认知功能障碍常早于运动症状之前发生,其主要特点为注意力不集中、认知减慢、解决问题的能力下降和视空间障碍[13, 14]。已发病患者中有11人存在认知功能障碍,以注意力不集中和记忆力下降为主要表现。通过认知功能评估,发现认知障碍和病程密切相关,具有长病程的患者,认知功能障碍比例越高。
精神行为异常为HD常见症状之一,一定程度上易被忽视。以往一项对HD患者行为学随访调查显示行为学异常主要表现为抑郁(>55%)、淡漠(30%)和易激惹(10%),症状随着HD病程进展而加重[15]。本组研究出现精神行为学异常的人数占发病人数的48.5%,仅次于舞蹈样动作。精神行为改变主要表现为易燥、易怒和易激惹(50%)、抑郁(20%),淡漠不常见。2名男性患者存在精神分裂症,表现为被害妄想和幻听。其中一名患者精神症状和运动症状几乎同时出现,该患者病程1年;另一名患者病程8年,精神症状晚于运动症状出现。综合国内外的研究发现,精神行为异常在不同的患者中具有一定的异质性。
患者中1人为青少年HD,14岁起病,CAG重复拷贝数为64次,64次为本研究最高病理拷贝次数。临床仅表现为舞蹈样动作,未出现其他临床表现,可能与病程较短(2年)有关,需长期随访观察。
HD目前缺乏有效的治疗方法,具有明显的致残性,严重影响患者的生活质量,在疾病后期运动和认知能力逐渐丧失,需依赖长期护理。对于运动症状,常用的药物包括盐酸硫必利和丁苯那嗪等,可一定程度改善运动症状;对于精神症状,常用药物包括5-羟色胺再摄取阻滞剂(包括氟西汀、帕罗西汀、舍曲林和西酞普兰)和神经阻滞剂(金刚烷胺,溴隐亭和安非他酮)[16]。2017年Ionis Pharmaceuticals公司报道首个能够降低致病蛋白的新型药物IONIS-HTT Rx(RG6042),其安全性和耐受性得到验证,但治疗效果仍需进一步在临床应用中得以认证[17]。深部脑部刺激(DBS)作为一种新型外科治疗方式,对HD核心运动症状具有一定的改善作用[18, 19]。
HD作为一种罕见的遗传性神经变性疾病,国内尚缺大样本的临床性研究。对56例基因检测阳性患者的临床特点和基因型研究发现,发病年龄越早,HTT基因CAG病理拷贝数越高,反之越低;患者认知功能与病程密切相关,病程越长,认知功能障碍越易产生。精神行为学改变具有一定的异质性,易激惹为最常见表现。目前对于HD患者长期护理具有重要意义。HD是DBS的手术指征之一,但是DBS只与改善运动障碍有关。降低致病蛋白的新型药物IONIS-HTT Rx(RG6042)仍需进一步在临床应用中得以认证。
| [1] |
Warby SC, Graham RK, Hayden MR. Huntington Disease[M]. In: Pagon RA, Adam MP, Ardinger HH, et al, editors. GeneReviews(R). Seattle (WA), 1993.
|
| [2] |
Tarolli CG, Chesire AM, Biglan KM. Palliative Care in Huntington Disease:Personal Reflections and a Review of the Literature[J]. Tremor Other Hyperkinet Mov (N Y), 2017, 7: 454. |
| [3] |
Roos RA. Huntington's disease:a clinical review[J]. Orphanet J Rare Dis, 2010, 5: 40. DOI:10.1186/1750-1172-5-40 |
| [4] |
Apolinario TA, Paiva CL, Agostinho LA. REVIEW-ARTICLE Intermediate alleles of Huntington's disease HTT gene in different populations worldwide:a systematic review[J]. Genet Mol Res, 2017, 16(2). |
| [5] |
Potter NT, Spector EB, Prior TW. Technical standards and guidelines for Huntington disease testing[J]. Genet Med, 2004, 6(1): 61-65. DOI:10.1097/01.GIM.0000106165.74751.15 |
| [6] |
Semaka A, Hayden MR. Evidence-based genetic counselling implications for Huntington disease intermediate allele predictive test results[J]. Clin Genet, 2014, 85(4): 303-311. DOI:10.1111/cge.2014.85.issue-4 |
| [7] |
中华医学会神经病学分会帕金森病及运动障碍学组. 亨廷顿病的诊断与治疗指南[J]. 中华神经科杂志, 2011, 44(9): 638-641. DOI:10.3760/cma.J.issn.1006-7876.2011.09.017 |
| [8] |
汤海艳, 王军, 魏其林, 等. MoCA和MMSE评估老年帕金森病患者认知障碍的分析[J]. 中风与神经疾病杂志, 2013, 30(8): 719-723. |
| [9] |
McColgan P, Tabrizi SJ. Huntington's disease:a clinical review[J]. Eur J Neurol, 2018, 25(1): 24-34. |
| [10] |
Smith MA, Brandt J, Shadmehr R. Motor disorder in Huntington's disease begins as a dysfunction in error feedback control[J]. Nature, 2000, 403(6769): 544-549. DOI:10.1038/35000576 |
| [11] |
Pringsheim T, Wiltshire K, Day L, et al. The incidence and prevalence of Huntington's disease:a systematic review and meta-analysis[J]. Mov Disord, 2012, 27(9): 1083-1091. DOI:10.1002/mds.25075 |
| [12] |
Walker RH. Management of Neuroacanthocytosis Syndromes[J]. Tremor Other Hyperkinet Mov (N Y), 2015, 5: 346. |
| [13] |
Malek N, Newman EJ. Hereditary chorea-what else to consider when the Huntington's disease genetics test is negative?[J]. Acta Neurol Scand, 2017, 135(1): 25-33. DOI:10.1111/ane.12609 |
| [14] |
Papoutsi M, Labuschagne I, Tabrizi SJ, et al. The cognitive burden in Huntington's disease:pathology, phenotype, and mechanisms of compensation[J]. Mov Disord, 2014, 29(5): 673-683. DOI:10.1002/mds.v29.5 |
| [15] |
Tabrizi SJ, Scahill RI, Owen G, et al. Predictors of phenotypic progression and disease onset in premanifest and early-stage Huntington's disease in the TRACK-HD study:analysis of 36-month observational data[J]. Lancet Neurol, 2013, 12(7): 637-649. DOI:10.1016/S1474-4422(13)70088-7 |
| [16] |
Eddy CM, Parkinson EG, Rickards HE. Changes in mental state and behaviour in Huntington's disease[J]. Lancet Psychiatry, 2016, 3(11): 1079-1086. DOI:10.1016/S2215-0366(16)30144-4 |
| [17] |
van Roon-Mom WMC, Roos RAC, de Bot ST. Dose-Dependent Lowering of Mutant Huntingtin Using Antisense Oligonucleotides in Huntington Disease Patients[J]. Nucleic Acid Ther, 2018, 28(2): 59-62. DOI:10.1089/nat.2018.0720 |
| [18] |
Wojtecki L, Groiss SJ, Hartmann CJ, et al. Deep Brain Stimulation in Huntington's Disease-Preliminary Evidence on Pathophysiology, Efficacy and Safety[J]. Brain Sci, 2016, 6(3): 38. DOI:10.3390/brainsci6030038 |
| [19] |
黄星星, 韩彦青, 马久红, 等. 脑深部电刺激治疗对帕金森病患者认知功能、抑郁和焦虑的影响[J]. 国际神经病学神经外科学杂志, 2018, 45(3): 261-265. |
 2018, Vol. 45
2018, Vol. 45




