扩展功能
文章信息
- 徐峰, 牛万祥, 谢时帅, 胡珊珊, 牛朝诗
- XU Feng, NIU Wan-xiang, XIE Shi-shuai, HU Shan-Shan, NIU Chao-shi
- 胶质瘤干细胞来源的外泌体对血管内皮细胞增殖和迁移的影响
- Effects of glioma stem cell-derived exosomes on proliferation and migration of vascular endothelial cells
- 国际神经病学神经外科学杂志, 2018, 45(5): 443-447
- Journal of International Neurology and Neurosurgery, 2018, 45(5): 443-447
-
文章历史
收稿日期: 2018-08-06
修回日期: 2018-09-26
神经胶质瘤是一种最为常见的脑肿瘤,其中胶质瘤母细胞瘤恶性程度最高,疾病进展最快,预后最差,一旦确诊后,患者中位生存期少于15个月[1],5年的存活率不足5%[2]。目前恶性胶质瘤的常规治疗以手术切除为主,术后予以放化学治疗,但总体治疗效果不佳。近年来,随着胶质瘤研究的不断深入,Treps等[3]发现胶质瘤干细胞能分泌一些促生长因子(如VEGF-A)促进血管内皮细胞增生,从而可以在胶质瘤肿瘤血管生成中起到重要作用。Saleem等研究表明肿瘤细胞可以通过外泌体囊泡(exosome)的摄取和释放在肿瘤微环境中发挥相关作用[4]。本研究采用不同浓度的GSCs-exo作用于人脑血管内皮细胞(HBMECs),观察其对内皮细胞增殖、迁移的影响,初步探讨GSCs-exo在胶质瘤血管生成中的作用。
1 材料与方法 1.1 材料人来源U87胶质瘤细胞株(中科院上海细胞库),人脑微血管内皮细胞(HBMECs)(ScienCell公司)。DMEM、1640、DMEM/F-12等培养基、B27添加剂、EGF生长因子和bFGF生长因子(Gibco公司),FITC标记的二抗(羊抗小鼠)和FITC标记的驴抗兔(二抗)(美国Jackson公司),GFAP单克隆抗体(一抗)(美国Novus Biologicals公司),Neun抗体(一抗)(美国Millipore公司),CDl33单克隆抗体(一抗)及CD63小鼠单克隆抗体(英国Abcam公司),辣根酶标记山羊抗小鼠IgG(二抗)(北京中杉金桥生物技术有限公司),RIPA裂解液和5×蛋白上样缓冲液(上海碧云天生物技术有限公司),Vwf(一抗)(武汉博士德公司),化学发光显影液(MILLIPORE公司),BCA试剂(雅酶生物科技有限公司),CCK-8(BIOMIKY公司),Exosome-depleted FBS(美国SBI公司),荧光显微镜(德国Leica公司)(DMl6000B),激光扫描共聚焦显微镜(德国Zeiss公司)(LSM880),超高速离心机(美国Beckman公司)。
1.2 方法 1.2.1 胶质瘤干细胞的分离、培养、鉴定在DMEM完全培养液(10%胎牛血清+1%的双抗)中常规培养人U87胶质瘤细胞株,取生长对数期的U87细胞进行消化离心,将细胞充分重悬后转移至(DMEM/F-12培养基+2%B27添加剂+20 μg/L EGF生长因子+20 μg/L bFGF生长因子)配置成的干细胞培养液中,置于培养箱中常规培养,收集3代肿瘤球细胞转移到防脱载玻片上,4 h后肿瘤球完全贴壁后,多聚甲醛固定细胞15 min,清洗后分别加入Nestin IgG抗体(一抗)、CD133 IgG抗体(1 : 200)(一抗),4℃孵育过夜,清洗后加入FITC标记二抗(1 : 400),室温孵育1 h,DAPI染细胞核1 h,避光处理,孵育30 min,荧光显微镜下观察拍照,同时将肿瘤球细胞(3代)在有多聚左旋赖氨酸涂层的盖玻片上进行细胞诱导分化实验,定期观察肿瘤球细胞生长分化状态。常规培养5 d后,同上述操作方法进行GFAP荧光染色,2周左右后作Neun染色处理,激光共聚焦显微镜下观察并拍取照片。
1.2.2 GSCs-Exo的提取与鉴定参照QIAGEN试剂盒使用说明书,将收集的胶质瘤干细胞上清细胞培养液(200 ml)去除细胞碎片和杂质后,与等量XBP缓冲液充分混合后加入离心柱进行离心,离心完成后加入10 ml的XWP进行离心洗涤,完成后换取新的离心柱加入400 μl的XE缓冲液(一种含无机盐的缓冲液)进行离心洗脱, 离心后的液体即为GSCs-Exo混合液。取20 μl~40 μl左右的GSCs-exo固定在Formvar-carbon载样铜网上,室温条件下静置30 min,再用滤纸从铜网边缘吸去液体。再使用10 μl的3%磷钨酸溶液滴于铜网上于室温环境下负染5 min,晾干后在80 kv下观察GSCs-exo的形态并拍摄照片,再将提取的GSCs-exo蛋白用含有蛋白酶抑制剂的RIPA裂解液处理后,加入5×蛋白上样缓冲液,水浴锅(100℃)中煮沸5~10分钟,采用SDS-PAGE电泳分离后转移到PVDF膜上后,室温封闭2 h,加入CD63小鼠单克隆抗体,4℃孵育过夜,TBST清洗后二抗(辣根酶标记山羊抗小鼠IgG)孵育2 h,ECL曝光拍照。
1.2.3 GSCs-exo处理细胞取50 μl提取的GSCs-Exo混合液,充分吹悬后加入RIPA裂解液处理,采用BCA试剂盒测量混合液中GSCs-Exo蛋白浓度,做好记录后,放置-80℃冰箱,待使用时将GSCs-Exo混合液用10% Exosome-depleted FBS培养液稀释成实验浓度,即取生长状况良好的人脑血管内皮细胞,分别添加最终浓度为20 μg/ml、40 μg/ml、60 μg/ml的GSCs-exo在培养箱中进行常规培养。
1.2.4 人脑血管内皮细胞摄取GSCs-exo取生长对数期的U87细胞消化离心,按每孔1×105个接种于干细胞培养液中常规培养,待肿瘤球传到4代时,每孔采用染色剂CM-Dil(2 μl/ml)处理3 d,待肿瘤球染色成功后。将肿瘤球接种到常规干细胞培养液中继续培养3 d,收集200 ml上清细胞培养液提取外泌体,将对数生长期的血管内皮细胞接种于有盖玻片的六孔板中,6 h细胞贴壁之后,参照实验分组,分别添加20 μg/ml、40 μg/ml、60 μg/ml的CM-Dil处理过的GSCs-exo常规培养3 d,同时采用4%的多聚甲醛固定,加入兔抗人vWF单克隆抗体(1 : 400)(一抗),同上述实验步骤,加入对应FITC标记的二抗(1 : 400),激光共聚焦显微镜下观察拍照。
1.2.5 CCK-8法检测细胞增殖根据实验分组,取对数生长期血管内皮细胞消化、离心,接种于96孔培养板内(每孔3 000个细胞),贴壁后分别添加20 μg/ml、40 μg/ml、60 μg/ml的GSCs-exo,置于培养箱常规培养。24 h、48 h、72 h后每孔加入100 μl含10%CCK-8混合液,常规孵育2 h后,酶标仪上测定每组细胞吸光度。
1.2.6 Transwell小室检测细胞迁移将不同浓度(20 μg/ml、40 μg/ml、60 μg/ml)GSCs-exo处理过的血管内皮细胞饥饿24 h后,消化离心加入Transwells小室中,上室加入200 μl无血清培养的血管内皮细胞,密度调整为1×105个,下室加入10%的Exosome-depleted FBS培养液700 μl过夜培养,将各组细胞用多聚甲醛固定,结晶紫染色后显微镜下观察拍照。
1.3 统计学分析采用SPSS 20.0统计软件对实验结果进行分析,计量资料x±s表示,单因素方差分析用于多组间数据比较,P < 0.05为差异有统计学意义。
2 结果 2.1 U87细胞来源的胶质瘤干细胞球(GSCs)的培养取对数生长期生长状态良好的人胶质瘤U87细胞株,消化离心、重悬后加入干细胞培养液置于培养箱中常规培养,24 H后显微镜下可见部分细胞贴壁,少数细胞呈悬浮状态,72~96 h倒置显微镜下(图 1)可以观察到较多数目的由几十到甚至数百个细胞组合而成的肿瘤球细胞,即胶质瘤干细胞(GSCs)。
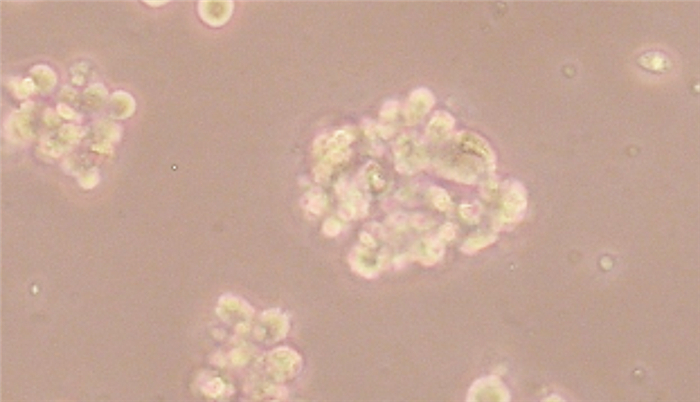
|
| 图 1 人胶质瘤U87细胞系培养的细胞球(倒置显微镜,×40) |
如图 2,肿瘤球细胞免疫荧光染色(CD133和Nestin),荧光显微镜下可见肿瘤球的细胞质被成功染色。因此,证明培养的GSCs中特异性表达干细胞标志物CD133和Nestin。另一方面,肿瘤球细胞的诱导分化实验中,5 d后在显微镜下观察到肿瘤球细胞分化成胶质细胞样时进行GFAP荧光染色,2周后细胞分化成神经元细胞样时进行Neun荧光染色,激光共聚焦荧光显微镜下拍照可见GFAP和Neun表达阳性。
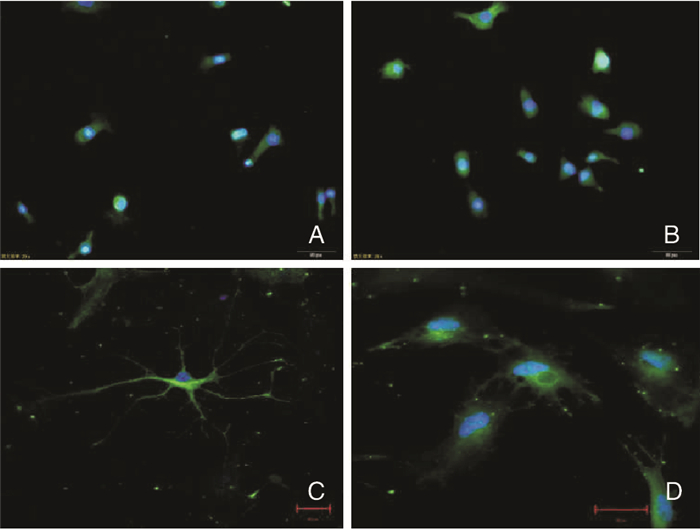
|
| 图 2 肿瘤球细胞特异性表达CD133和Nestin(免疫细胞化学染色,×40)和其分化的细胞染色显示GFAP和Neun表达阳性(bar=20 μm)。A: CD133; B: Nestin; C: GFAP; D: Neun |
透射电镜的结果如(图 3A)所示,胶质干细胞分泌的外泌体的形态呈圆形或椭圆形的囊泡结构,直径大小在30 nm~100 nm的区间内。如(图 3B)所示,通过Westen-bloting检测验证,证实提取的GSCs-exo内表达CD63。(图 4)可见共聚焦显微镜下不同浓度组GSCs-exo(20 μg/ml、40 μg/ml、60 μg/ml)处理的人脑血管内皮细胞摄取的红色颗粒样结构(即摄取的GSCs-exo)的数量有所区别,且与GSCs-exo的浓度呈正相关。
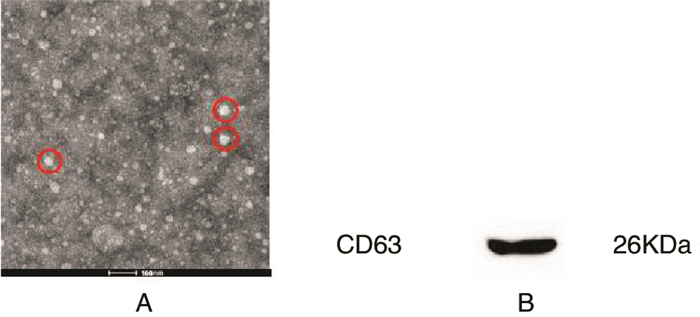
|
| 图 3 A:透射电镜照片显示胶质干细胞分泌的外泌体的形态呈圆形或椭圆形的囊泡结构(bar=100 nm);B:Westen-bloting检测证实提取的GSCs-exo内表达CD63 |
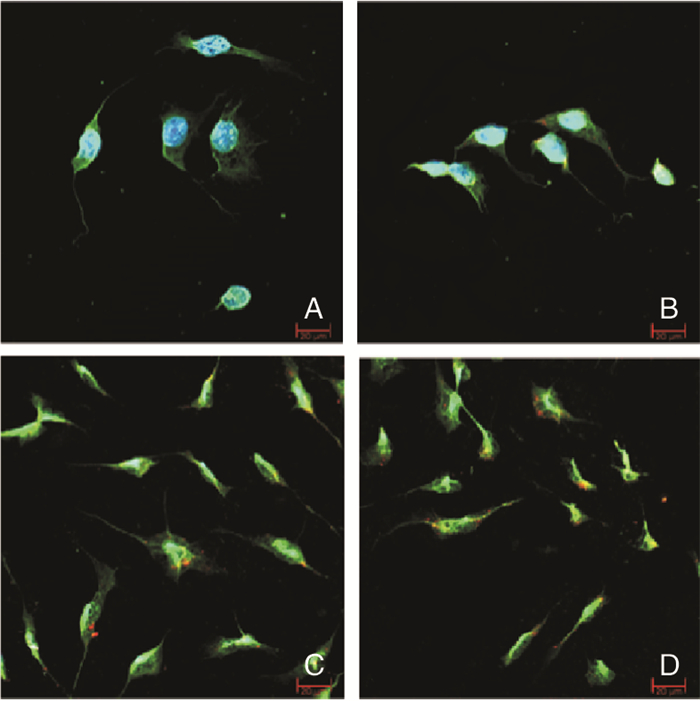
|
| 图 4 人脑血管内皮细胞(HHBMECs)摄取GSCs-exo(bar=20 μm)。A:常规培养的HBMECs;B:HBMECs中添加20 μg/ml的CM-Dil处理过的GSCs-exo;C:HBMECs中添加40 μg/ml的CM-Dil处理过的GSCs-exo;D:HBMECs中添加60 μg/ml的CM-Dil处理过的GSCs-exo |
如图 5,随着GSCs-exo浓度的增加,与正常组相比,不同浓度GSCs-exo处理的HBMECs在24 h的各组之间的增殖率差异无统计学意义(P>0.05),在48 h、72 h后的增殖率差异有统计学意义(P < 0.05)。
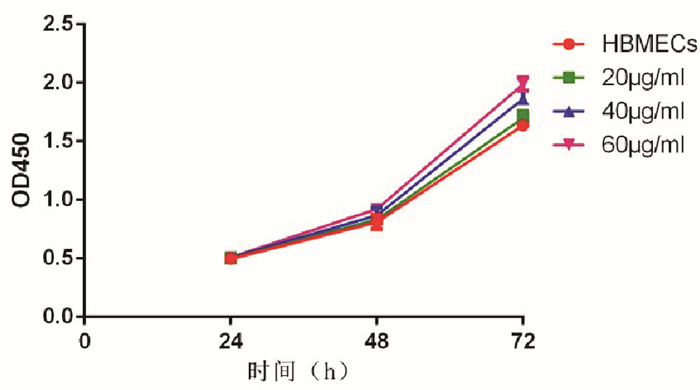
|
| 图 5 GSCs-exo促进人脑血管内皮细胞(HBMECs)的增殖 |
如图 6所示,正常组的HBMECs的迁移细胞数为85.67±3.28个/每个视野,20 μg/ml的的GSCs-exo组迁移细胞数为99.33±2.60个/每个视野,40 μg/ml的GSCs-exo组迁移细胞数117.67±5.20/每个视野,60 μg/ml的GSCs-exo组迁移细胞数137.67±4.80/每个视野,数据结果显示随着GSCs-exo浓度的升高,HBMECs的迁移能力增强,差异比较有统计学意义(F=30.100,P < 0.05)。
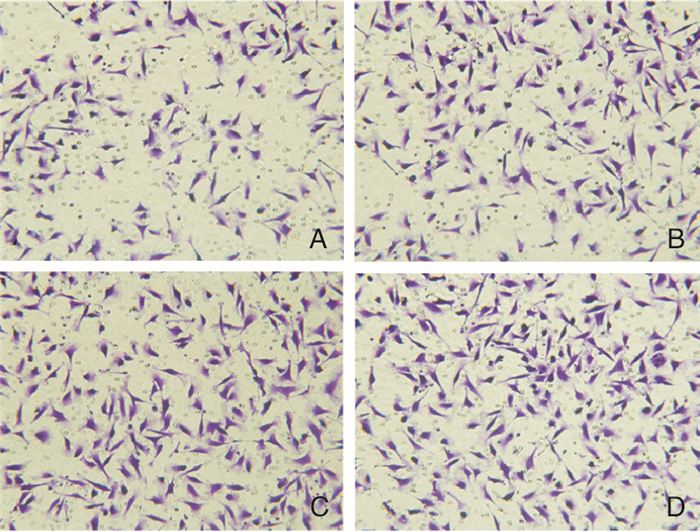
|
| 图 6 GSCs-exo促进人脑血管内皮细胞(HBMECs)的迁移(200×)。A:正常组的HBMECs的迁移细胞数;B:20 μg/ml的GSCs-exo组迁移细胞数;C:40 μg/ml的GSCs-exo组迁移细胞数;D:60 μg/ml的GSCs-exo组迁移细胞数 |
近几年研究发现,胶质瘤干细胞是神经胶质瘤中一类为数不多的细胞群,它与胶质瘤的病理级别密切相关,随着病理级别的增高,胶质瘤干细胞的数目逐渐增多[5]。本课题组前期研究[6]证明胶质瘤干细胞与血管内皮细胞之间有着密切联系,胶质瘤干细胞聚集于微血管周围生长,可以促进血管内皮细胞增生。
外泌体(exosomes)是上世纪八十年代末在绵羊的网织红细胞中发现的一种膜性囊泡结构,直径大小为30~120 nm,具有脂质双分子结构,其内含有多种蛋白(CD9、CD63、HSP70等)、microRNAs、mRNAs等,在细胞之间具有物质交换及信息传递等功能,在体内很多生理与病理过程有着不可忽视的作用[7]。研究发现,外泌体与人体内多种肿瘤血管生成密切相关,包括肺癌、卵巢癌、乳腺癌等[8-10]。因此,本实验选择不同浓度的GSCs-exo作用于人脑血管内皮细胞(HBMECs),观察其对血管内皮细胞增殖、迁移的影响,探讨GSCs-exo在胶质瘤血管生成中的作用。
本实验成功从人胶质瘤细胞系U87中培养出胶质瘤干细胞(GSCs),从干细胞标志物(Nestin和CD133)及和诱导分化实验(GFAP和Neun)两方面对其作出鉴定,提取GSCs来源的外泌体(GSCs-exo)并鉴定。在体外实验中分别采用不同浓度GSCs-exo(20 μg/ml、40 μg/ml、60 μg/ml)作用于人脑血管内皮细胞(HBMECs),通过激光共聚焦显微镜可以观察到血管内皮细胞成功摄取了GSCs-exo,并且研究发现随着GSCs-exo浓度的提高,人脑血管内皮细胞的增殖能力逐渐增强,迁移能力也大大提高了,证实了胶质瘤干细胞分泌的外泌体可以促进血管内皮细胞的增殖和迁移。同时证明了在胶质瘤微环境中胶质瘤干细胞分泌的外泌体可以调控胶质瘤血管形成,在胶质瘤微环境中起着重要的作用。近年来研究发现GW4869的存在,它是一种鞘磷酶抑制剂,可以抑制细胞来源外泌体的分泌[11, 12]。有着抑制肿瘤的恶性增殖、迁移、血管生成等作用[13]。结合本实验所做的研究,这为下一步靶向胶质瘤微环境中的血管形成带来新的思路。
综上所述,胶质瘤干细胞来源的外泌体可以提高血管内皮细胞的增殖能力,促进内皮细胞迁移,表明在胶质瘤微环境中胶质干细胞可以通过分泌外泌体在血管内皮细胞之间传递生物学信息,其中具体机制还需要进一步研究,以外泌体为靶向,可以为胶质瘤的精准治疗提供新的思路。
| [1] |
Reardon DA, Desjardins A, Peters KB, et al. Phase 2 study of carboplatin, irinotecan, and bevacizumab for recurrent glioblastoma after progression on bevacizumab therapy[J]. Cancer, 2011, 117(23): 5351-5358. DOI:10.1002/cncr.v117.23 |
| [2] |
Weller M, van den Bent M, Hopkins K, et al. EANO guideline for the diagnosis and treatment of anaplastic gliomas and glioblastoma[J]. Lancet Oncol, 2014, 15(9): e395-403. DOI:10.1016/S1470-2045(14)70011-7 |
| [3] |
Treps L, Perret R, Edmond S, et al. Glioblastoma stem-like cells secrete the pro-angiogenic VEGF-A factor in extracellular vesicles[J]. J Extracell Vesicles, 2017, 6(1): 1359479. DOI:10.1080/20013078.2017.1359479 |
| [4] |
Saleem SN, Abdel-Mageed AB. Tumor-derived exosomes in oncogenic reprogramming and cancer progression[J]. Cell Mol Life Sci, 2015, 72(1): 1-10. DOI:10.1007/s00018-014-1710-4 |
| [5] |
李明武, 牛朝诗, 董永飞, 等. 脑肿瘤干细胞的增殖活性与病理级别的相关性研究[J]. 中华神经外科疾病研究杂志, 2009(6): 542-547. DOI:10.3969/j.issn.1671-2897.2009.06.016 |
| [6] |
李明武, 牛朝诗, 高歌, 等. 脑肿瘤干细胞的增殖活性与微血管密度的相关性研究[J]. 中国微侵袭神经外科杂志, 2011(5): 223-226. |
| [7] |
Aryani A, Denecke B. Exosomes as a Nanodelivery System:a Key to the Future of Neuromedicine?[J]. Mol Neurobiol, 2016, 53(2): 818-834. DOI:10.1007/s12035-014-9054-5 |
| [8] |
Zhou L, Lv T, Zhang Q, et al. The biology, function and clinical implications of exosomes in lung cancer[J]. Cancer Lett, 2017, 407: 84-92. DOI:10.1016/j.canlet.2017.08.003 |
| [9] |
Li Y, Yang Y, Xiong A, et al. Comparative Gene Expression Analysis of Lymphocytes Treated with Exosomes Derived from Ovarian Cancer and Ovarian Cysts[J]. Front Immunol, 2017, 8: 607. DOI:10.3389/fimmu.2017.00607 |
| [10] |
Jia Y, Chen Y, Wang Q, et al. Exosome:emerging biomarker in breast cancer[J]. Oncotarget, 2017, 8(25): 41717-41733. |
| [11] |
Cheng Q, Li X, Wang Y, et al. The ceramide pathway is involved in the survival, apoptosis and exosome functions of human multiple myeloma cells in vitro[J]. Acta Pharmacol Sin, 2018, 39(4): 561-568. DOI:10.1038/aps.2017.118 |
| [12] |
Gong M, Yu B, Wang JC, et al. Mesenchymal stem cells release exosomes that transfer miRNAs to endothelial cells and promote angiogenesis[J]. Oncotarget, 2017, 8(28): 45200-45212. |
| [13] |
Lee HY, Chen CK, Ho CM, et al. EIF3C-enhanced exosome secretion promotes angiogenesis and tumorigenesis of human hepatocellular carcinoma[J]. Oncotarget, 2018, 9(17): 13193-13205. |
 2018, Vol. 45
2018, Vol. 45




