扩展功能
文章信息
- 张钊涌, 郑浩杰, 沈雅雯, 姚梓凌, 黄好润, 蒋海山
- 线粒体相关内质网膜上的连接蛋白与神经退行性疾病的研究进展
- 国际神经病学神经外科学杂志, 2018, 45(4): 410-414
-
文章历史
收稿日期: 2018-04-25
修回日期: 2018-07-07
2. 南方医科大学南方医院神经内科, 广东省广州市 510515
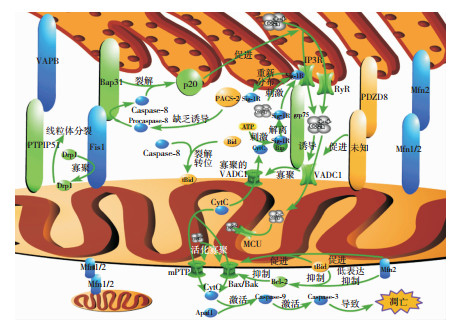
线粒体相关内质网膜(mitochondrial associated ER membrane, MAM)是典型的细胞器间物理连接所形成的复合结构。MAM中内质网与线粒体的距离一般为10~30 nm[1],但膜没有融合,保证了它们各自功能的独立性和完整性。经证实,MAM上的多种连接蛋白通过参与细胞凋亡和细胞自噬等过程,参与了相关神经退行性疾病的发生和发展。而目前,神经退行性疾病的具体发病机制未明,治疗方式有限。因此,了解MAM上连接蛋白的作用机制具有重要意义。本文根据该领域最新研究进展,绘制成图 1,以帮助大家更好地理解本文内容。
|
| 图 1 MAM上连接蛋白的作用通路 注:VAPB:囊泡相关膜蛋白相关蛋白B;PTPIP51:蛋白酪氨酸激酶相互作用蛋白51;Bap31:B细胞受体相关蛋白31;Fis1:分裂蛋白1;Drp1:动力蛋白相关GTP酶1;Mfn2:线粒体融合蛋白2;Mfn1/2:线粒体融合蛋白1或2;MCU:线粒体钙单向转运体;CytC:细胞色素C;mPTP:线粒体通透性转换孔;IP3R:IP3受体;VDAC1:电压依赖性阴离子通道1;Sig-1R:Sigma-1受体;Caspase-8:含半胱氨酸的天冬氨酸蛋白水解酶8;Procaspase-8:含半胱氨酸的天冬氨酸蛋白水解酶8的前体;Caspase-9:含半胱氨酸的天冬氨酸蛋白水解酶9;Caspase-3:含半胱氨酸的天冬氨酸蛋白水解酶3;Bax/Bak:Bax/Bak蛋白;PDZD8:PDZD8蛋白;RyR:Ryanodine受体;Bip:免疫球蛋白重链结合蛋白;PACS-2:PACS-2蛋白;Bid:Bid蛋白;tBid:截短型Bid;ATP:三磷酸腺苷 |
IP3受体(IP3 receptor, IP3R)是内质网释放钙离子的通道之一,一般与IP3结合,允许钙离子由内质网进入胞浆。当其通过grp75与电压依赖性阴离子通道1(voltage-dependent anion channel 1, VDAC1)相互连接时,内质网钙离子可直接经IP3R释放,而不需要IP3与IP3R结合的过程[2]。
IP3R的功能亦受Sigma-1受体(Sigma-1 receptor, Sig-1R)的调控。Sig-1R主要聚集于细胞内质网,与免疫球蛋白重链结合蛋白(immunoglobulin heavy chain binding protein, Bip)结合,形成复合物。当受到三磷酸腺苷等刺激时,Sig-1R从复合物上解离,与IP3R结合,稳定IP3R结构,降低其降解速度,增加内质网钙离子经IP3R释放的量,而当内质网应激,钙离子释放过多时,Sig-1R会与IP3R解离,重新分布在内质网上[3]。
钙离子释放至胞浆后,经过线粒体内外膜上的孔道进入线粒体。位于线粒体外膜的钙离子通道主要为VDAC1,线粒体内膜上的主要为线粒体钙单向转运体(mitochondrial calcium uniporter, MCU)。当通过顺铂等方式诱导细胞凋亡时,胞浆钙离子浓度升高,引起VDAC1表达增加并寡聚化[4]形成更大的孔道,释放位于膜间隙的凋亡蛋白如细胞色素C(cytochrome C, CytC)进入胞浆;同时,VDAC1表达增加还可增加线粒体膜间隙的钙离子量。当膜间隙的钙浓度增加时,位于线粒体内膜的MCU开放,促使线粒体高效摄取钙离子[5],易造成钙超载,促使Bax/Bak寡聚形成孔道或开启线粒体通透性转换孔(mitochondrial permeablity transition pore, mPTP)[6, 7],引起CytC等促凋亡分子的释放。CytC进入胞浆后,与Apaf1结合,激活Caspase-9,接着激活Caspase-3,从而启动细胞的凋亡级联反应,引起凋亡的发生。
据此可知,IP3R和VDAC1可分别控制内质网和线粒体对钙离子的通透性,从而调节细胞内的钙离子分布。两者的异常可引起细胞内钙离子稳态失调并进一步引起细胞凋亡水平上升。同时钙离子的变化亦可促使VDAC1表达增加和寡聚,导致细胞凋亡的发生。
1.2 PACS-2、Bap31和Fis1内质网膜上的PACS-2、B细胞受体相关蛋白31(B cell receptor associated protein 31, Bap31)以及线粒体外膜上的分裂蛋白1(mitochondrial fission 1 protein, Fis1)均为MAM的重要组成部分。正常情况下,PACS-2与钙黏着蛋白相互作用抑制Caspase-8对Bap31的剪切。病理情况下,Fis1和Bap31形成连接,活化Caspase-8调控细胞凋亡[8]。
PACS-2对神经元的存活十分重要,敲除该基因会导致神经元退化[9]。病理条件下,PACS-2含量下降且Fis1和Bap31形成连接,钙黏着蛋白分布紊乱,Caspase-8被募集活化并裂解Bap31,其裂解产物p20导致内质网应激,钙离子释放[8, 9],随着线粒体摄入钙离子的增多,最终将导致线粒体钙超载并引起细胞凋亡;同时,活化的Caspase-8还能切割Bid成截短型Bid(truncated bid, tBid)[10],这种片段一方面能结合Bcl-2样蛋白,进而抑制Bcl-2样蛋白的抗凋亡作用;另一方面能促使Bax/Bak寡聚化形成线粒体膜孔道,进而诱导CytC释放,引起细胞凋亡。
另外,Fis1亦可募集动力蛋白相关GTP酶1(dynamin-related protein, Drp1)至线粒体外膜,介导线粒体外膜的断裂,促进线粒体分裂[11, 12]。当线粒体动力学失衡时,可引起细胞的凋亡。
1.3 Mfn2线粒体融合蛋白2(mitofusion2, Mfn2)是定位于线粒体和其他细胞器外膜上的跨膜GTP酶。相邻线粒体外膜上的Mfn1/2相结合,可促进线粒体融合[13, 14]。当Mfn2表达异常时,线粒体动力学失衡,可引起线粒体自噬及细胞凋亡。
MAM中,内质网膜的Mfn2与线粒体外膜的Mfn1/2凭借蛋白自身的构象可塑性相互缠绕,密切接触。敲除SH-SY5Y或Hela细胞的MFN2可以观察到线粒体和内质网之间的距离小于正常细胞,两细胞器之间的钙离子流增加,造成线粒体钙超载,细胞凋亡水平提高[15]。另有研究发现,当Mfn2低表达时,细胞内Bcl-2表达水平降低而Bax/Bak表达活跃,促进细胞凋亡的发生[16]。这些结果说明,Mfn2可以使内质网和线粒体保持合适的距离,其低表达会引起线粒体钙超载并导致细胞凋亡。
1.4 PDZD8PDZD8(PDZ domain-containing protein 8)定位于内质网上,是MAM组成的必要成分[17]。神经突触后膜的NMDA受体和mGluR1的激活诱发IP3和钙离子分别作用于内质网上的IP3R和Ryanodine受体(ryanodine receptor, RyR),从而导致皮质锥体神经元树突中内质网释放存储的钙离子进入胞浆。钙离子浓度较高时,可打开MAM上的MCU,促进线粒体摄取钙离子[17]。研究发现,敲除PDZD8会让钙离子扩散到胞浆后不进入线粒体[17],这个结果更加证明了PDZD8对线粒体摄取钙离子的重要性。
1.5 VAPB和PTPIP51囊泡相关膜蛋白相关蛋白B (vesicle-associated membrane protein-associated protein B, VAPB)定位于内质网膜,蛋白酪氨酸激酶相互作用蛋白51(protein tyrosine phosphatase interacting protein 51, PTPIP51)定位于线粒体外膜,它们参与调控胞内的自噬水平。
Gomez-Suaga等[18]通过siRNA抑制VAPB或PTPIP51的表达,发现细胞内自噬水平上升,而增加VAPB或PTPIP51表达会抑制自噬,这一过程伴随着内质网内钙离子流向线粒体增多。但通过转染Mito-RFP-ER的方式来人工诱导内质网和线粒体连接,可减少通过siRNA抑制VAPB或PTPIP51表达所导致的自噬。且通过抑制IP3R进而抑制内质网向线粒体的钙离子流,这个过程可以去除因VAPB和PTPIP51过表达所导致的自噬抑制作用。可以认为,内质网与线粒体之间的距离对两者之间的相互作用有一定的意义。内质网与线粒体之间的距离增大可促进自噬,而距离缩小可增加内质网向线粒体的钙离子流,从而抑制自噬。
2 MAM与神经退行性疾病神经退行性疾病是一组原因不明的慢性进行性损害神经等组织的疾病。研究表明,神经退行性疾病中可发现包括钙离子分布紊乱、细胞凋亡水平提高、细胞自噬水平下降、轴突运输障碍、炎症反应等现象,而这些现象均有MAM的参与。
2.1 阿尔茨海默病MAM上的Presenilin 1和Presenilin 2是γ-分泌酶的主要成分,用于水解淀粉样蛋白前体产生阿尔茨海默病的特征性蛋白——β-淀粉样蛋白[19, 20]。在阿尔兹海默症患者的脑部解剖以及淀粉样蛋白前体转基因鼠中均发现β-淀粉样蛋白可引起MAM上PACS-2、Sig-1R等连接蛋白的表达增加并增强内质网与线粒体之间的交流,导致线粒体钙超载[9]。
值得注意的是,β-淀粉样蛋白不仅能与mPTP的组成成分亲环素D相互作用,促进mPTP开放,导致发生凋亡,还能连同磷酸化的Tau蛋白与VDAC1相互作用,这提示了β-淀粉样蛋白可能参与钙离子的转运[21]。这些现象都说明了,MAM与阿尔茨海默病的发病机制密切相关。
2.2 帕金森病帕金森病相关蛋白——α-突触核蛋白被证实定位于MAM上[22],它可以与VAPB相互作用并减少VAPB-PTPIP51连接,从而引起细胞内钙离子稳态异常和ATP生成障碍[23],这或许是α-突触核蛋白致病的原因之一。
DJ-1的突变或敲除与常染色体隐性家族性帕金森病的发生有关[24]。正常情况下,DJ-1可以由胞浆中转移到MAM上,维持线粒体形态和功能的稳定。DJ-1可以增强内质网与线粒体的相互作用,从而抑制p53引起的线粒体损伤[25],并且内质网E3泛素化连接酶可以促进帕金森相关内皮素受体的泛素化和降解,进而抑制其对内质网应激的诱导并抑制神经元细胞的死亡[26]。
PINK1亦与帕金森病密切相关。有研究表明,饥饿诱导的自噬会使PINK1以及与之相互作用的BECN1/Beclin1定位于MAM,且MAM也被证实为细胞自噬体形成的位点[27]。
2.3 其他TDP-43和FUS变异与肌萎缩侧索硬化和额颞叶痴呆的发病有关[28]。TDP-43和FUS可通过激活糖原合成酶激酶-3β减少VAPB-PTPIP51连接,影响内质网与线粒体之间的交流,导致疾病的发生[29, 30]。另外,Sig-1R突变与青少年肌萎缩侧索硬化的发生有关,NSC34细胞突变的Sig-1R在MAM上表达会减弱细胞对抗内质网应激引起凋亡的能力[31]。同时,对亨廷顿病的研究发现,N端突变的亨廷顿蛋白会引起神经元死亡,在该过程中Bip的mRNA含量增加,而通过选择性eIF2α去磷酸化抑制剂提高Bip的含量,可阻止亨廷顿蛋白N端突变细胞死亡[31, 32]。这一实验中,Bip可与Sig-1R形成复合物,前者Bip生成增加时,Sig-1R从复合物解离的可能性减小,游离的Sig-1R减少;而后者Bip含量增加可能是由复合物解离引起,这意味着游离的Sig-1R增加。Sig-1R减少会导致细胞死亡,而增加有保护细胞作用,这些结果都说明Sig-1R对神经元有保护作用[3, 31, 32]。如前文所诉,内质网释放的钙离子增加会让Sig-1R从IP3R上解离,从而抑制内质网钙离子的释放,这可能就是Sig-1R保护细胞的途径,但Sig-1R具体如何重新分布仍需进一步研究。
3 总结与展望MAM上的IP3R、VDAC1、PACS-2、Fis1、Bap31、Mfn2、PDZD8、VAPB和PTPIP51通过调控内质网与线粒体之间的钙离子流,影响细胞凋亡和细胞自噬。线粒体内钙离子含量对线粒体功能非常重要。钙离子含量正常可以维持线粒体的氧化代谢,而长时间的钙离子超载会引起线粒体膜电位改变,导致线粒体功能崩溃,从而导致细胞凋亡。
同时,钙离子异常分布还能影响线粒体动力学。线粒体在细胞骨架上的运输对线粒体分裂和融合的平衡十分重要,而线粒体与细胞骨架连接所需的动力蛋白和驱动蛋白均受钙离子的调控,胞浆内钙离子浓度提高会引起线粒体运输停止,导致线粒体不能到细胞内特定部位进行分裂,从而导致线粒体分裂和融合失衡,而且MAM上的Fis1、Drp1和Mfn2等也与细胞分裂和融合有关。
综上,MAM上的连接蛋白可通过调控钙离子分布、细胞凋亡和细胞自噬水平、线粒体动力学等方式参与相关神经退行性疾病的发生和发展。但如本文所述,其具体机制尚未完全阐明。相信随着分子生物学和显微观察技术的发展,MAM与细胞自噬和细胞凋亡、神经退行性疾病之间的关系将渐渐浮出水面。最终,MAM可能成为神经退行性疾病检测以及治疗的共同靶点。
感谢余玮怡师姐为本综述的构思和框架给予深入的指导,使得综述得以顺利完成。
| [1] |
Rowland AA, Voeltz GK. Endoplasmic reticulum-mitochondria contacts:function of the junction[J]. Nat Rev Mol Cell Biol, 2012, 13(10): 607-625. DOI:10.1038/nrm3440 |
| [2] |
Szabadkai G, Bianchi K, Varnai P, et al. Chaperone-mediated coupling of endoplasmic reticulum and mitochondrial Ca2+ channels[J]. J Cell Biol, 2006, 175(6): 901-911. DOI:10.1083/jcb.200608073 |
| [3] |
Hayashi T, Su TP. Sigma-1 receptor chaperones at the ER-mitochondrion interface regulate Ca(2+) signaling and cell survival[J]. Cell, 2007, 131(3): 596-610. DOI:10.1016/j.cell.2007.08.036 |
| [4] |
Weisthal S, Keinan N, Ben-Hail D, et al. Ca(2+)-mediated regulation of VDAC1 expression levels is associated with cell death induction[J]. Biochim Biophys Acta, 2014, 1843(10): 2270-2281. DOI:10.1016/j.bbamcr.2014.03.021 |
| [5] |
Patron M, Checchetto V, Raffaello A, et al. MICU1 and MICU2 finely tune the mitochondrial Ca2+ uniporter by exerting opposite effects on MCU activity[J]. Mol Cell, 2014, 53(5): 726-737. DOI:10.1016/j.molcel.2014.01.013 |
| [6] |
Ludtmann MHR, Abramov AY. Mitochondrial calcium imbalance in Parkinson's disease[J]. Neurosci Lett, 2018, 663: 86-90. DOI:10.1016/j.neulet.2017.08.044 |
| [7] |
Molpeceres V, Mauriz JL, Garcia-Mediavilla MV, et al. Melatonin is able to reduce the apoptotic liver changes induced by aging via inhibition of the intrinsic pathway of apoptosis[J]. J Gerontol A Biol Sci Med Sci, 2007, 62(7): 687-695. DOI:10.1093/gerona/62.7.687 |
| [8] |
Iwasawa R, Mahul-Mellier AL, Datler C, et al. Fis1 and Bap31 bridge the mitochondria-ER interface to establish a platform for apoptosis induction[J]. EMBO J, 2011, 30(3): 556-568. DOI:10.1038/emboj.2010.346 |
| [9] |
Hedskog L, Pinho CM, Filadi R, et al. Modulation of the endoplasmic reticulum-mitochondria interface in Alzheimer's disease and related models[J]. Proc Natl Acad Sci U S A, 2013, 110(19): 7916-7921. DOI:10.1073/pnas.1300677110 |
| [10] |
Simmen T, Aslan JE, Blagoveshchenskaya AD, et al. PACS-2 controls endoplasmic reticulum-mitochondria communication and Bid-mediated apoptosis[J]. EMBO J, 2005, 24(4): 717-729. DOI:10.1038/sj.emboj.7600559 |
| [11] |
Loson OC, Song Z, Chen H, et al. Fis1, Mff, MiD49, and MiD51 mediate Drp1 recruitment in mitochondrial fission[J]. Mol Biol Cell, 2013, 24(5): 659-667. DOI:10.1091/mbc.e12-10-0721 |
| [12] |
Kandimalla R, Reddy PH. Multiple faces of dynamin-related protein 1 and its role in Alzheimer's disease pathogenesis[J]. Biochim Biophys Acta, 2016, 1862(4): 814-828. DOI:10.1016/j.bbadis.2015.12.018 |
| [13] |
Formosa LE, Ryan MT. Mitochondrial fusion:Reaching the end of mitofusin's tether[J]. J Cell Biol, 2016, 215(5): 597-598. DOI:10.1083/jcb.201611048 |
| [14] |
Qi Y, Yan L, Yu C, et al. Structures of human mitofusin 1 provide insight into mitochondrial tethering[J]. J Cell Biol, 2016, 215(5): 621-629. DOI:10.1083/jcb.201609019 |
| [15] |
Filadi R, Greotti E, Turacchio G, et al. Mitofusin 2 ablation increases endoplasmic reticulum-mitochondria coupling[J]. Proc Natl Acad Sci U S A, 2015, 112(17): E2174-E2181. DOI:10.1073/pnas.1504880112 |
| [16] |
Martorell-Riera A, Segarra-Mondejar M, Munoz JP, et al. Mfn2 downregulation in excitotoxicity causes mitochondrial dysfunction and delayed neuronal death[J]. EMBO J, 2014, 33(20): 2388-2407. DOI:10.15252/embj.201488327 |
| [17] |
Hirabayashi Y, Kwon SK, Paek H, et al. ER-mitochondria tethering by PDZD8 regulates Ca(2+) dynamics in mammalian neurons[J]. Science, 2017, 358(6363): 623-630. DOI:10.1126/science.aan6009 |
| [18] |
Gomez-Suaga P, Paillusson S, Stoica R, et al. The ER-Mitochondria Tethering Complex VAPB-PTPIP51 Regulates Autophagy[J]. Curr Biol, 2017, 27(3): 371-385. DOI:10.1016/j.cub.2016.12.038 |
| [19] |
Area-Gomez E, de Groof AJ, Boldogh I, et al. Presenilins are enriched in endoplasmic reticulum membranes associated with mitochondria[J]. Am J Pathol, 2009, 175(5): 1810-1816. DOI:10.2353/ajpath.2009.090219 |
| [20] |
Schreiner B, Hedskog L, Wiehager B, et al. Amyloid-beta peptides are generated in mitochondria-associated endoplasmic reticulum membranes[J]. J Alzheimers Dis, 2015, 43(2): 369-374. |
| [21] |
Volgyi K, Juhasz G, Kovacs Z, et al. Dysfunction of Endoplasmic Reticulum (ER) and Mitochondria (MT) in Alzheimer's Disease:The Role of the ER-MT Cross-Talk[J]. Curr Alzheimer Res, 2015, 12(7): 655-672. DOI:10.2174/1567205012666150710095035 |
| [22] |
Guardia-Laguarta C, Area-Gomez E, Rub C, et al. Alpha-Synuclein is localized to mitochondria-associated ER membranes[J]. J Neurosci, 2014, 34(1): 249-259. DOI:10.1523/JNEUROSCI.2507-13.2014 |
| [23] |
Paillusson S, Gomez-Suaga P, Stoica R, et al. Alpha-Synuclein binds to the ER-mitochondria tethering protein VAPB to disrupt Ca2+ homeostasis and mitochondrial ATP production[J]. Acta Neuropathol, 2017, 134(1): 129-149. DOI:10.1007/s00401-017-1704-z |
| [24] |
Bonifati V. Autosomal recessive parkinsonism[J]. Parkinsonism Relat Disord, 2012, 18: S4-S6. |
| [25] |
Ottolini D, Cali T, Negro A, et al. The Parkinson disease-related protein DJ-1 counteracts mitochondrial impairment induced by the tumour suppressor protein p53 by enhancing endoplasmic reticulum-mitochondria tethering[J]. Hum Mol Genet, 2013, 22(11): 2152-2168. DOI:10.1093/hmg/ddt068 |
| [26] |
Omura T, Kaneko M, Okuma Y, et al. Endoplasmic reticulum stress and Parkinson's disease:the role of HRD1 in averting apoptosis in neurodegenerative disease[J]. Oxid Med Cell Longev, 2013, 2013: 239854. |
| [27] |
Gelmetti V, De Rosa P, Torosantucci L, et al. PINK1 and BECN1 relocalize at mitochondria-associated membranes during mitophagy and promote ER-mitochondria tethering and autophagosome formation[J]. Autophagy, 2017, 13(4): 654-669. DOI:10.1080/15548627.2016.1277309 |
| [28] |
Ling SC, Polymenidou M, Cleveland DW. Converging mechanisms in ALS and FTD:disrupted RNA and protein homeostasis[J]. Neuron, 2013, 79(3): 416-438. DOI:10.1016/j.neuron.2013.07.033 |
| [29] |
Stoica R, De Vos KJ, Paillusson S, et al. ER-mitochondria associations are regulated by the VAPB-PTPIP51 interaction and are disrupted by ALS/FTD-associated TDP-43[J]. Nat Commun, 2014, 5: 3996. DOI:10.1038/ncomms4996 |
| [30] |
Stoica R, Paillusson S, Gomez-Suaga P, et al. ALS/FTD-associated FUS activates GSK-3beta to disrupt the VAPB-PTPIP51 interaction and ER-mitochondria associations[J]. EMBO Rep, 2016, 17(9): 1326-1342. DOI:10.15252/embr.201541726 |
| [31] |
Al-Saif A, Al-Mohanna F, Bohlega S. A mutation in sigma-1 receptor causes juvenile amyotrophic lateral sclerosis[J]. Ann Neurol, 2011, 70(6): 913-919. DOI:10.1002/ana.22534 |
| [32] |
Reijonen S, Putkonen N, Norremolle A, et al. Inhibition of endoplasmic reticulum stress counteracts neuronal cell death and protein aggregation caused by N-terminal mutant huntingtin proteins[J]. Exp Cell Res, 2008, 314(5): 950-960. DOI:10.1016/j.yexcr.2007.12.025 |
 2018, Vol. 45
2018, Vol. 45




