扩展功能
文章信息
- 廖新斌, 姜维喜, 刘景平
- LIAO Xin-Bin, JIANG Wei-Xi, LIU Jing-Ping
- 27例儿童胶质母细胞瘤临床治疗和预后相关因素分析
- Clinical treatment and prognostic factors for pediatric glioblastomas: an analysis of 27 cases
- 国际神经病学神经外科学杂志, 2018, 45(4): 375-378
- Journal of International Neurology and Neurosurgery, 2018, 45(4): 375-378
-
文章历史
收稿日期: 2018-06-05
修回日期: 2018-07-17
中枢神经系统是儿童人群常见的肿瘤发生部位,仅次于白血病[1]。儿童中枢神经系统肿瘤常见类型有胶质瘤、颅咽管瘤、髓母细胞瘤和生殖细胞瘤等。胶质母细胞瘤好发于中老年人,预后极差,多数文献报道5年生存率低于5%[1]。但是儿童胶质母细胞瘤却少见,仅占儿童中枢神经系统肿瘤的3%左右[1]。为了研究儿童人群胶质母细胞瘤的预后,笔者回顾总结2010年1月至2017年12月中南大学湘雅医院神经外科收治的27例儿童胶质母细胞瘤,并结合文献对其预后进行分析。
1 临床资料 1.1 病例入组和剔除标准病例入组标准:①0~18岁儿童患者;②经病理结果确诊为胶质母细胞瘤。
病例剔除标准:①围手术期死亡;②临床追踪过程中失访;③死于与肿瘤无关的其它意外事件;④脑干胶质母细胞瘤。
1.2 一般资料回顾性分析2010年1月至2017年12月在中南大学湘雅医院神经外科接受手术治疗的27个0~18岁儿童胶质母细胞瘤病例,并进行追踪随访。采集的临床数据包括年龄、性别、肿瘤部位、手术切除程度、放化疗情况,以及随访时间。最后入组病人包括21例男性和6例女性患儿。年龄跨度6个月~17岁,平均年龄11岁。
1.3 手术治疗所有患儿接受开颅手术治疗,其中17例位于大脑半球,7例位于丘脑、松果体区、脑室系统等深部位置,3例位于小脑半球。根据病灶累及范围采取相应的手术入路,在保留患儿功能前提下尽量全切肿瘤。标本均送病理检查,常规术后3天内复查MRI平扫增强,进一步评定肿瘤切除情况。
1.4 放化疗患儿术后常规推荐去肿瘤科接受标准的放化疗,依据美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)历年指南推荐方案。0~3岁婴幼儿无法口服替莫唑胺的患儿,予以尼莫司汀化疗。
1.5 随访术后常规每3个月随访1次,随访方式主要为门诊随访和电话随访。
1.6 统计分析本研究利用Kaplan-Meier法对患者年龄、性别、肿瘤切除程度、放化疗4个因素进行生存分析。采用Graphpad prism 7.0软件绘制生存曲线。
2 结果 2.1 围手术期治疗结果围手术期无患者昏迷或死亡,其中22例显微镜下全切(Gross total resection, GTR),另外5例显微镜下次全切(Subtotal resection, STR)。依据2007版或2016版世界卫生组织中枢神经系统肿瘤分类标准,均病理确诊为胶质母细胞瘤。25例为初治的胶质母细胞瘤,2例为继发性胶质母细胞瘤。其中1例患者于8年前曾行开颅做额叶肿瘤切除,病理报告“星形胶质细胞瘤2级”,另外1例则在6年前被诊断为“四脑室室管膜瘤2级”,并接受了放化疗。
2.2 放化疗结果共有8例患儿接受了标准的放疗及化疗,7例接受了单纯的替莫唑胺化疗,2例接受了尼莫司汀化疗。另外10例患儿术后未行任何放化疗。本组共有5个患儿在肿瘤复发时接受了再次手术。
2.3 随访结果本组27个病例,中位总生存时间16个月,6个月总生存率81.5%,1年总生存率59.3%,2年总生存率33.3%,5年总生存率14.8%。
2.4 预后相关因素生存分析根据上述Kaplan-Meier生存分析显示儿童胶质母细胞瘤的预后与性别、年龄无关,而放化疗则可以显著改善患者的预后,延长总的生存时间。全切肿瘤不能明显延长患儿生存时间,但是患儿获得长期生存的重要前提。
3 讨论临床中经常发现组织学表现相同的CNS肿瘤病人的预后差别很大。随着测序技术的进步,尤其是二代测序的广泛应用,发现组织学表现相同的CNS肿瘤存在明显的分子遗传学差异[2]。因此在2016版WHO的CNS分类指南,强调对中枢神经系统肿瘤进行组织学和分子分型的综合诊断。本组病例由于多数为2016年以前手术及诊断,因此进行分子诊断的病例较少,故本文未分析不同分子亚型的胶质母细胞瘤的预后情况。
影响胶质母细胞瘤预后的因素较多,通常认为低龄、放化疗和全切是预后良好因素,而肿瘤的大小、位置、种族这些因素的研究结论不一致[3, 8]。本研究共纳入27个病例,由于病例数相对较少,且分布于颅脑各个部位,病人亦分散于各个年龄段(见表 1),因此,肿瘤的大小和位置很难通过统计学加以分析。但实际上肿瘤的大小和位置常常影响肿瘤的全切除率。美国贝勒医学院Lam等人[3]通过分析美国流行病监督及最终结果资料库(Surveillance, Epidemiology, and End Results,SEER)2000年至2010年302个儿童胶质母细胞瘤的长期随访数据,认为低龄、肿瘤位于幕上和全切除三个因素是预后良好因素,而性别、种族、肿瘤大小和位置则与预后无关。本研究也同样证实了儿童胶质母细胞瘤预后与性别无关(见图 1),并且肿瘤得到全切的患儿更有机会获得更长的生存时间(见图 4)。放化疗是胶质母细胞瘤患儿术后的常规治疗,但是本组病例由于经济因素、以及家属观念的影响,未进行放化疗的患者达10个病例,占所有病例的37%,我们对其进行统计分析发现这些病人的预后明显差于接受放化疗患儿,有显著的统计学意义(见图 3)。而Liu等人[4]通过对美国1998年至2011年13年间收治的1173例0~19岁儿童胶质母细胞瘤的病例资料进行分析,也认为低龄、全切和化疗是预后良好因素,但是提出了黑种人和不好的肿瘤位置是预后不良因素,并且认为10岁以下的患儿进行放疗并不能改善患儿的最终预后。但是本研究0~10岁组患者中位生存时间11个月,11~18岁组患者中位生存时间14个月,无明显统计学差异,说明年龄与生存时间无明显关联(见图 2)。
| 病例数 | 百分比 | |
| 性别 | ||
| 男性 | 21 | 77.8% |
| 女性 | 6 | 22.2% |
| 年龄 | ||
| 0~10岁 | 8 | 29.6% |
| 11~18岁 | 19 | 70.4% |
| 肿瘤切除程度 | ||
| 全切除 | 22 | 81.5% |
| 次全切除 | 5 | 18.5% |
| 临床治疗 | ||
| 单纯手术组 | 10 | 37.1% |
| 手术+放化疗 | 17 | 62.9% |
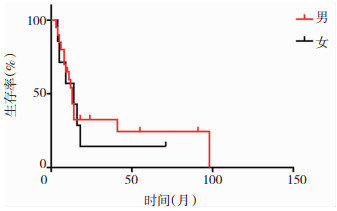
|
| 图 1 儿童胶质母细胞瘤的生存曲线图,男性中位生存时间13个月,女性中位生存时间14个月,两组病例无统计学显著差异(P=0.87)。 |
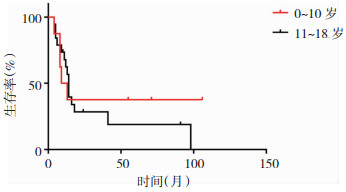
|
| 图 2 儿童胶质母细胞瘤的生存曲线图,0~10岁组患者中位生存时间11个月,11~18岁组患者中位生存时间14个月,两组生存时间无明显的统计学差异(P=0.63)。 |
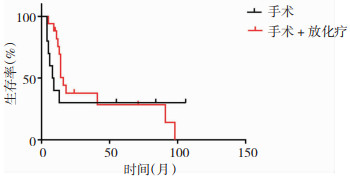
|
| 图 3 儿童胶质母细胞瘤的生存曲线图,单纯手术组中位生存时间8.5个月,而手术+放化疗组中位生存时间为16个月,两组在预后上有显著差异(P=0.0067)。 |
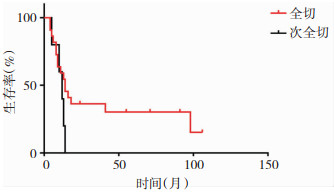
|
| 图 4 儿童胶质母细胞瘤的生存曲线图,肿瘤全切组中位生存时间为14个月,而肿瘤次全切组中位时间为12个月,P=0.14,无明显的统计学差异。尽管次全切组放化疗比例为80%(4/5),全切组放化疗比例为59.1%(13/22),但是,全切组病人更有望获得长期的生存时间。 |
儿童胶质母细胞瘤的预后虽然较差,但是优于成人胶质母细胞瘤。Brodbelt等人[5]通过对整个英格兰地区国家肿瘤登记中心的10743个胶质母细胞瘤病例进行回顾性分析,该地区胶质母细胞瘤总发病率为每年十万分之4.64,中位生存时间6个月,1年总生存率28.4%,2年总生存率11.5%,5年总生存率3.4%。其中,儿童胶质母细胞瘤占总共被确诊病例的1.25%(135/10743),发病率每年千万分之5.8,中位生存时间12个月,1年总生存率50.5%,2年总生存率25.8%,5年总生存率15.4%。因此,可以认为儿童胶质母细胞瘤预后优于成年人。而在同属东亚地区的儿童胶质母细胞瘤临床研究也证实了这一点,Jung等人[6]报道的儿童胶质母细胞瘤中位生存时间为16个月,而Song等人[7]报道的儿童胶质母细胞瘤中位生存时间则达到惊人的43个月,5年生存率达到了40%。这些临床随访研究结果提示儿童胶质母细胞瘤可能有不同于成人的分子生物学特性,甚至有研究认为3岁以下的婴幼儿患者更加特殊,应该区别对待[8]。而肿瘤分子生物学研究表明,MGMT、IDH、P53、PTEN等基因出现突变可能影响患者的预后[9]。这为我们进一步研究儿童胶质母细胞瘤提供了新的思路。
尽管如此,由于儿童患者在胶质母细胞瘤人群中实属少数,即使是在大型的小儿神经外科诊疗中心也不多见,因此在治疗上缺乏足够的关注。无论是欧洲神经肿瘤学协会(European Association for Neuro-Oncology, EANO)的高级别胶质瘤(high-grade glioma, HGG)指南还是美国NCCN历年发布的指南,都鲜有对儿童胶质母细胞瘤治疗的专题描述。目前临床上较为一致的共识是推荐3岁以上的患儿可以进行放疗和化疗,3岁以下患儿虽然没有放疗的绝对禁忌,但是放疗可能会对生长发育或者神经功能产生损害[10]。而复发的儿童胶质母细胞瘤,由于已经接受过手术以及放化疗,临床治疗的选择通常更为多样化。Kline等人[11]对过去20年的文献进行回顾发现,复发的儿童胶质母细胞瘤的总生存时间与治疗手段选择相关,传统化疗为4个月,靶向治疗9.3个月,免疫治疗6.9个月,再次放疗则是14个月。但是,如何为患儿选择最佳的治疗手段,依然有待进一步临床研究确定,任重而道远。
总之,儿童胶质母细胞瘤的总体预后较差,生存时间与性别和年龄无关,术后放化疗对延长生存期具有重要的意义。全切肿瘤虽不能明显延长患儿生存时间,但是患儿获得长期生存的重要前提。
| [1] |
Zhou D, Zhang Y, Liu H, et al. Epidemiology of nervous system tumors in children:a survey of 1, 485 cases in Beijing Tiantan Hospital from 2001 to 2005[J]. Pediatr Neurosurg, 2008, 44(2): 97-103. DOI:10.1159/000113110 |
| [2] |
Louis DN, Perry A, Reifenberger G, et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System:a summary[J]. Acta Neuropathol, 2016, 131(6): 803-820. DOI:10.1007/s00401-016-1545-1 |
| [3] |
Lam S, Lin Y, Zinn P, et al. Patient and treatment factors associated with survival among pediatric glioblastoma patients:A Surveillance, Epidemiology, and End Results study[J]. J Clin Neurosci, 2018, 47(1): 285-293. |
| [4] |
Liu M, Thakkar JP, Garcia CR, et al. National cancer database analysis of outcomes in pediatric glioblastoma[J]. Cancer Med, 2018, 7(4): 1151-1159. DOI:10.1002/cam4.2018.7.issue-4 |
| [5] |
Brodbelt A, Greenberg D, Winters T, et al. Glioblastoma in England:2007-2011[J]. Eur J Cancer, 2015, 51(4): 533-542. DOI:10.1016/j.ejca.2014.12.014 |
| [6] |
Jung TY, Lee JY, Kim DS, et al. Pediatric supratentorial high-grade glioma:multicenter retrospective observational study of the Korean Society for Pediatric Neuro-Oncology[J]. J Neurooncol, 2015, 21(2): 413-419. |
| [7] |
Song KS, Phi JH, Cho BK, et al. Long-term outcomes in children with glioblastoma[J]. J Neurosurg Pediatr, 2010, 6(2): 145-149. DOI:10.3171/2010.5.PEDS09558 |
| [8] |
EI-Ayadi M, Ansari M, Sturm D, et al. High-grade glioma in very young children:a rare and particular patient population[J]. Oncotarget, 2017, 8(38): 64564-64578. |
| [9] |
荆尧, 陈世文. 胶质母细胞瘤分子标志物的研究进展[J]. 国际神经病学神经外科学杂志, 2014, 41(2): 185-188. |
| [10] |
Cage TA, Mueller S, Haas-Kogan D, et al. High-grade gliomas in children[J]. Neurosurg Clin N Am, 2012, 23(3): 515-523. DOI:10.1016/j.nec.2012.04.007 |
| [11] |
Kline C, Felton E, Allen IE, et al. Survival outcomes in pediatric recurrent high-grade glioma:results of a 20-year systematic review and meta-analysis[J]. J Neurooncol, 2018, 137(1): 103-110. DOI:10.1007/s11060-017-2701-8 |
 2018, Vol. 45
2018, Vol. 45




