扩展功能
文章信息
- 张首龙, 黄石仁, 沈雷, 王诺, 张春阳, 陈蕾, 张敏敏, 邓本强
- ZHANG Shou-Long, HUANG Shi-Ren, SHEN Lei, WANG Nuo, ZHANG Chun-Yang, CHEN Lei, ZHANG Min-Min, DENG Ben-Qiang
- 合并原发性醛固酮增多症的急性缺血性卒中患者临床分析
- Clinical features of patients with acute ischemic stoke and primary aldosteronism
- 国际神经病学神经外科学杂志, 2018, 45(4): 366-369
- Journal of International Neurology and Neurosurgery, 2018, 45(4): 366-369
-
文章历史
收稿日期: 2018-02-09
修回日期: 2018-03-11
2. 白求恩国际和平医院, 河北省石家庄市 050082
高血压是缺血性卒中最重要的危险因素,54%缺血性卒中患者有高血压[1],积极治疗高血压能有效预防缺血性卒中的发生[2]。原发性醛固酮增多症(primary aldosteronism, PA)是继发性高血压最常见的原因。PA指肾上腺皮质分泌过量醛固酮,导致高血压、钠潴留、心脑血管损伤、肾素﹣血管紧张素系统活性受抑制和低钾血症。PA既往很长时间被认为是一种罕见的疾病,在高血压人群中少于1%,且低钾血症是诊断的必要条件[3]。随着血浆醛固酮肾素活性比值筛选的广泛应用及肾上腺静脉取血的开展,发现PA在高血压患者所占的比例大于5%,甚至可能大于10%[4]。PA患者与原发性高血压患者相比,存在独立于高血压的心脑血管并发症危险因素[5]。PA患者脑血管损伤不仅与血压水平有关,醛固酮作为独立的脑血管危险因素也起着重要的作用[6]。单侧肾上腺切除术或盐皮质受体拮抗剂可以有效治疗PA,使血压恢复到正常水平[7]。研究表明[8],有效治疗PA可以改善心脑血管疾病患者的预后。尽管对PA的早期诊断和治疗非常重要,但现行指南[7, 9]并未推荐对缺血性卒中患者进行PA的筛查,我们对合并PA的急性缺血性卒中患者进行临床分析,探讨其临床特点。
1 对象和方法 1.1 研究对象本研究为病例对照研究,所有研究对象均签署知情同意书,记录所有受试者详细的基本临床资料,包括性别、年龄、高血压史、糖尿病史、心脏病史(包括冠状动脉粥样硬化性心脏病和心律失常等)、吸烟史、饮酒史和肝肾疾病史等。
急性缺血性卒中诊断标准:①急性起病;②局灶神经功能缺损(一侧面部或肢体无力或麻木,语言障碍等),少数为全面神经功能缺损;③症状或体征持续时间不限(当影像学显示有责任缺血性病灶时),或持续24 h以上(当缺乏影像学责任病灶时);④排除非血管性病因;⑤脑CT/MRI排除脑出血[9, 10]。所有患者均行头颅CT/MRI、胸片、心电图、心脏超声和血生化等辅助检查。缺血性卒中患者予TOAST分型[11]。
合并PA的急性缺血性卒中组:选自2016年12月至2017年12月在上海长海医院就诊的19例确诊的合并PA的急性缺血性卒中患者,均符合PA的诊断标准:⑴对以下人群于缺血性卒中急性期后检测血浆醛固酮与肾素活性比值(aldosterone renin ratio, ARR)进行PA筛查:①持续性血压≥160/100 mmHg或难治性高血压;②高血压合并自发性或利尿剂所致的低钾血症;③高血压合并肾上腺意外瘤;④早发性高血压家族史或早发脑血管意外家族史的高血压患者;⑤原发性醛固酮增多症患者中存在高血压的一级亲属;⑥高血压合并阻塞性呼吸睡眠暂停。⑵对ARR增高患者病情平稳后行生理盐水输注试验或卡托普利试验确诊。⑶对PA患者行肾上腺CT检查辅助分型[7]。
未合并PA的急性缺血性卒中组:为同期就诊于本院的384例未合并PA的急性缺血性卒中患者,其性别、年龄与合并PA的急性缺血性卒中组比较差异均无统计学意义。
1.2 研究方法记录所有受试者详细的病史资料,包括高血压、糖尿病、高脂血症、吸烟和饮酒等危险因素。记录所有受试者的血压,检测其空腹血糖和血脂水平。各项危险因素的判定标准如下。
1.2.1 高血压既往史中有高血压,或用药记录中已接受降压药物治疗,或体格检查时收缩压≥140 mmHg(1 mmHg=0.133 kPa)或舒张压≥90 mmHg者定义为有高血压。
1.2.2 糖尿病既往史中有糖尿病,或用药记录中已接受降糖药物或胰岛素治疗,或空腹血糖≥7 mmol/L或糖化血红蛋白≥6.5%者定义为有糖尿病。
1.2.3 高脂血症既往史中有高脂血症,或用药记录中已接受降脂药物治疗,或血总胆固醇≥5.2 mmol/L,或低密度脂蛋白胆固醇≥3.36 mmol/L者定义为有高脂血症。
1.3 统计学方法对于描述性统计结果,正态分布的连续变量以均数±标准差(x±s)表示,分类变量采用频数(百分比)表示。两组间的资料比较首先采用单因素分析,符合正态分布的计量资料比较采用两个独立样本的t检验;计数资料比较采用Pearson卡方检验或Fisher's精确概率法。上述统计分析采用SPSS 23.0统计软件完成,以P < 0.05表示差异具有统计学意义。
2 结果 2.1 两组患者一般资料比较本研究共纳入403名急性缺血性卒中患者,患者入院前均未诊断患有PA。患者一般资料如表 1所示。患者平均年龄为(73.1±10.2)岁,59.8%患者为男性。69.7%的患者有高血压,入院时血压平均值为(163.2±30.2)/(90.2±21.1) mmHg。根据TOAST分型,大动脉粥样硬化性占59.8%、小动脉闭塞性占14.4%、心源性占17.6%以及其他病因或病因不明占8.2%。
| 指标 | 所有入组者(n=403) | 合并PA组(n=19) | 未合并PA组(n=384) | 检验值 | P值 |
| 年龄(岁) | 73.1±10.2 | 69.7±11.2 | 74.2±11.8 | -1.626 | 0.105 |
| 男性 | 241(59.8) | 10(62.6) | 231(60.2) | 0.426 | 0.514 |
| 高血压 | 281(69.7) | 16(84.2) | 265(69.0) | 1.982 | 0.159 |
| 糖尿病 | 72(17.9) | 1(5.3) | 71(18.5) | 0.219 | |
| 高脂血症 | 117(29.0) | 3(15.8) | 114(29.7) | 1.697 | 0.193 |
| 吸烟 | 119(29.5) | 3(15.8) | 116(30.2) | 1.809 | 0.179 |
| 饮酒 | 136(33.7) | 4(21.1) | 132(34.4) | 1.437 | 0.231 |
| 收缩压(mmHg) | 163.2±30.2 | 180.7±27.3 | 163.0±30.1 | 2.512 | 0.012 |
| 舒张压(mmHg) | 90.2±21.1 | 102.9±15.7 | 90.0±21.1 | 2.628 | 0.009 |
| 血钾(mmol/L) | 4.1±1.2 | 3.6±0.5 | 4.1±0.6 | -3.570 | 0.000 |
| TOAST分型 | |||||
| 大动脉粥样硬化性 | 241(59.8) | 8(42.1) | 233(60.7) | 2.598 | 0.107 |
| 小动脉闭塞性 | 58(14.4) | 2(10.5) | 56(14.6) | 1.000 | |
| 心源性 | 71(17.6) | 5(26.3) | 66(17.2) | 0.351 | |
| 其他病因或病因不明 | 33(8.2) | 4(21.1) | 29(7.6) | 0.060 |
合并PA的急性缺血性卒中患者相对于未合并PA的急性缺血性卒中患者入院时血压更高(收缩压P=0.012,舒张压P=0.009);合并PA的急性缺血性卒中患者相对于未合并PA的急性缺血性卒中患者血钾更低(P < 0.001),但仅有6例PA患者(31.6%)血钾低于正常值下线(3.5 mmol/L)。合并PA和未合并PA的急性缺血性卒中患者TOAST分型所占比例没有明显差异。见表 1。
3 讨论大量研究已证实醛固酮对脑血管的毒性作用,可作为影响脑血管疾病发生和发展的独立危险因素[12]。醛固酮对肾脏及脑部有直接的血管毒性作用,引起血管纤维化、血管壁增厚、氧化应激和炎症反应,损伤内皮功能,促进血管收缩、动脉粥样硬化及血管重塑[13, 14]。由此可见,缺血性卒中和PA之间存在密切关系,值得予以足够重视,PA也可能以急性缺血性卒中作为首发临床表现。急性缺血性卒中患者中合并PA的患者约为3%~10%[4, 15],本研究发现,急性缺血性卒中患者中合并PA的比例较高,而本研究并未对所有急性缺血性卒中患者进行PA筛查,因此,急性缺血性卒中患者中合并PA的比例可能高于现有研究。
高血压伴低血钾曾被认为是PA的典型表现,但一些研究表明,只有9%~37%的PA患者存在低钾血症[7],故其敏感性和特异性较低。本研究中仅有6位PA患者(31.6%)血钾低于正常值下线(3.5 mmol/L)。国外有学者建议对所有高血压患者进行筛查[16]。Milliez等[17]对65例原发性醛固酮增多症患者和465例原发性高血压患者进行研究,发现原发性醛固酮增多症患者脑卒中的发病率显著高于原发性高血压患者(分别为12.9%和3.4%)。据此可以认为原发性醛固酮增多症患者与原发性高血压患者相比,存在独立于高血压的心脑血管并发症危险因素,因此,筛查出合并PA的患者对缺血性卒中的二级预防至关重要。然而,对急性缺血性卒中患者进行PA的筛查存在如下限制:首先,PA严格的筛查程序要求停用对血浆醛固酮与肾素活性比值影响较大药物,而对于急性缺血性卒中患者控制血压比诊断PA更加重要。其次,急性缺血性卒中患者往往年龄较大且高质量生存期较短,即使诊断PA也并不适合行肾上腺切除术。最后,对所有缺血性卒中患者进行PA筛查,势必会增加医疗成本。基于上述原因,本研究中19位PA患者仅7位行肾上腺切除术(如病例1)。
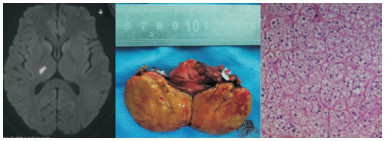
|
| 图 1 病例1的病例资料 注:病例1,67岁,女性,因“突发左侧肢体麻木、无力6 h”入院。MRI示右侧丘脑脑梗死。患者合并PA,行右侧肾上腺切除,病理结果示右侧肾上腺皮脂腺腺瘤。 |
考虑到以上因素,对合并PA可能性大的年轻缺血性卒中患者,行PA筛查更有价值。本研究表明,入院时有持续性高血压或难治性高血压以及合并低钾血症的缺血性卒中患者应行PA筛查。尽管缺血性卒中患者中高血压与小动脉闭塞关系密切[18],但本研究并未发现合并PA和未合并PA的急性缺血性卒中患者TOAST分型所占比例有明显差异。
综上所述,急性缺血性卒中患者中合并PA的患者比例较高,对PA早期诊断和及时有效的治疗可改善缺血性卒中预后,预防脑血管病再发。建议应对缺血性卒中患者应行PA筛查,尤其是有持续性高血压或难治性高血压以及合并低钾血症等PA危险因素的年轻患者。
| [1] |
Lawes CM, Vander Hoorn S, Rodgers A. Global burden of blood-pressure-related disease, 2001[J]. Lancet, 2008, 371(9623): 1513-1518. DOI:10.1016/S0140-6736(08)60655-8 |
| [2] |
Rashid P, Leonardi-Bee J, Bath P. Blood pressure reduction and secondary prevention of stroke and other vascular events:a systematic review[J]. Stroke, 2003, 34(11): 2741-2748. DOI:10.1161/01.STR.0000092488.40085.15 |
| [3] |
Berglund G, Andersson O, Wilhelmsen L. Prevalence of primary and secondary hypertension:studies in a random population sample[J]. Br Med J, 1976, 2(6035): 554-556. DOI:10.1136/bmj.2.6035.554 |
| [4] |
Hannemann A, Wallaschofski H. Prevalence of primary aldosteronism in patient's cohorts and in population-based studies——a review of the current literature[J]. Horm Metab Res, 2012, 44(3): 157-162. DOI:10.1055/s-0031-1295438 |
| [5] |
Mulatero P, Monticone S, Bertello C, et al. Long-term cardio-and cerebrovascular events in patients with primary aldosteronism[J]. J Clin Endocrinol Metab, 2013, 98(12): 4826-4833. DOI:10.1210/jc.2013-2805 |
| [6] |
Born-Frontsberg E, Reincke M, Rump LC, et al. Cardiovascular and cerebrovascular comorbidities of hypokalemic and normokalemic primary aldosteronism:results of the German Conn's Registry[J]. J Clin Endocrinol Metab, 2009, 94(4): 1125-1130. DOI:10.1210/jc.2008-2116 |
| [7] |
中华医学会内分泌学分会肾上腺学组. 原发性醛固酮增多症诊断治疗的专家共识[J]. 中华内分泌代谢杂志, 2016, 32(3): 188-195. DOI:10.3760/cma.j.issn.1000-6699.2016.03.003 |
| [8] |
Catena C, Colussi G, Nadalini E, et al. Cardiovascular outcomes in patients with primary aldosteronism after treatment[J]. Arch Intern Med, 2008, 168(1): 80-85. DOI:10.1001/archinternmed.2007.33 |
| [9] |
中华医学会神经病学分会中华医学会神经病学分会脑血管病学组. 中国急性缺血性脑卒中诊治指南2014[J]. 中华神经科杂志, 2015, 48(4): 246-257. DOI:10.3760/cma.j.issn.1006-7876.2015.04.002 |
| [10] |
Sacco RL, Kasner SE, Broderick JP, et al. An updated definition of stroke for the 21st century:a statement for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke, 2013, 44(7): 2064-2089. DOI:10.1161/STR.0b013e318296aeca |
| [11] |
Adams HP Jr, Bendixen BH, Kappelle LJ, et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment[J]. Stroke, 1993, 24(1): 35-41. DOI:10.1161/01.STR.24.1.35 |
| [12] |
Kunikata H, Aizawa N, Kudo M, et al. Relationship of ocular microcirculation, measured by laser speckle flowgraphy, and silent brain infarction in primary aldosteronism[J]. PLoS One, 2015, 10(2): e0117452. DOI:10.1371/journal.pone.0117452 |
| [13] |
Pruthi D, McCurley A, Aronovitz M, et al. Aldosterone promotes vascular remodeling by direct effects on smooth muscle cell mineralocorticoid receptors[J]. Arterioscler Thromb Vasc Biol, 2014, 34(2): 355-364. DOI:10.1161/ATVBAHA.113.302854 |
| [14] |
丁妹, 曹志勇, 李胜利, 等. 不同炎症反应在脑梗死与短暂性脑缺血发作患者中表达及意义研究[J]. 国际神经病学神经外科学杂志, 2017, 44(3): 280-284. |
| [15] |
Miyaji Y, Kawabata Y, Joki H, et al. Primary aldosteronism in patients with acute stroke:prevalence and diagnosis during initial hospitalization[J]. BMC Neurol, 2016, 16: 177. DOI:10.1186/s12883-016-0701-5 |
| [16] |
Nishikawa T, Omura M, Satoh F, et al. Guidelines for the diagnosis and treatment of primary aldosteronism--the Japan Endocrine Society 2009[J]. Endocr J, 2011, 58(9): 711-721. DOI:10.1507/endocrj.EJ11-0133 |
| [17] |
Milliez P, Girerd X, Plouin PF, et al. Evidence for an increased rate of cardiovascular events in patients with primary aldosteronism[J]. J Am Coll Cardiol, 2005, 45(8): 1243-1248. DOI:10.1016/j.jacc.2005.01.015 |
| [18] |
Kubo M, Kiyohara Y, Ninomiya T, et al. Decreasing incidence of lacunar vs other types of cerebral infarction in a Japanese population[J]. Neurology, 2006, 66(10): 1539-1544. DOI:10.1212/01.wnl.0000216132.95207.b4 |
 2018, Vol. 45
2018, Vol. 45




