扩展功能
文章信息
- 蒋艳艳, 袁由军, 李顺均, 聂志余, 李云霞
- JIANG Yan-Yan, YUAN You-Jun, LI Shun-Jun, NIE Zhi-Yu, LI Yun-Xia
- 认知障碍患者颅内动脉狭窄与脑白质胆碱能通路病变的关系
- Association between intracranial arterial stenosis and cholinergic pathway lesions in the white matter in patients with cognitive impairment
- 国际神经病学神经外科学杂志, 2018, 45(4): 355-359
- Journal of International Neurology and Neurosurgery, 2018, 45(4): 355-359
-
文章历史
收稿日期: 2018-02-09
修回日期: 2018-04-26
2. 同济大学附属同济医院神经内科, 上海市 200065
有研究显示,脑白质病变患者多存在一定的认知功能障碍[1]。1982年Bartus等[2]提出胆碱能假说,认为胆碱能系统是认知功能相关的主要神经递质系统,在记忆障碍和相关的认知功能损害中有着重要的作用。Swartz等[3]提出脑白质病变可引起胆碱能通路中断或破坏,导致视空间、执行功能等认知领域受损。韩国学者有研究显示,在大动脉粥样硬化性梗死患者中,多发性血管狭窄、颅内外混合性血管狭窄更易发生脑白质病变[4]。有研究表明,颅内血管病变与认知功能缺损存在相关性[5],但颅内动脉狭窄与脑白质胆碱能的关系不确定。本文采用蒙特利尔认知评估量表(Montreal cognitive assessment, MoCA)对认知功能进行快速筛查,采用胆碱能通路高信号量表(cholinergic pathways hyperintensities scale, CHIPS)评价脑白质病变的程度,采用WASID试验方法测定和评估颅内动脉狭窄,以探索认知功能障碍与颅内动脉狭窄、脑白质胆碱能通路病变的相关性。
1 对象与方法 1.1 研究对象连续收集2015年11月至2016年11月在我院神经内科门诊以记忆力下降为主诉的患者118例,年龄43~89岁。对入组的患者均登记一般资料、临床资料及相关量表评定,且行头颅3.0 T MRI常规扫描、头颅CT血管成像采集。将入组的患者分为研究组(85例),男34例,女51例,平均年龄(68.29±9.70)岁;对照组(33例),男19例,女14例,平均年龄(64.72±8.06)岁。两组患者在性别、年龄上差异无统计学意义(P > 0.05),具有可比性。
纳入标准:研究组入选标准:符合美国精神障碍与统计手册第四版(DSM-Ⅳ)痴呆诊断标准及欧洲轻度认知功能损害(Mild Cognitive Impairment, MCI)的工作组制定的MCI诊断标准[6],右利手;对照组入选标准:MoCA量表矫正后得分≥26分,年龄性别与研究组具有可比性,右利手,无痴呆家族史。
排除标准:患有严重心肺肝肾等疾病者;既往或新发脑梗死、脑出血及其他脑部疾病者;有焦虑症、抑郁症等其他类型精神疾病者;其他各种病因对认知功能造成影响的系统性疾病、药源性、酒精依赖性等;对入组各种检查不能耐受者。入组的患者均签署知情同意书。本研究经过上海市同济大学附属同济医院伦理委员会批准。
1.2 研究方法本研究采用的横断面对照研究。
1.2.1 神经心理学测定所有入组者均由同一位医师(已取得国家心理测量师资质,且不参与磁共振影像学方面的评定),严格按照MoCA量表(北京修订版)手册要求的操作步骤对其进行评估。MoCA总分30分,经过受教育年限≤9年者加1分的受教育程度偏倚矫正处理后,所得分≥26分认知功能正常,< 26分为认知功能损伤,该量表对MCI患者的特异性和敏感性均较高[7]。
1.2.2 头颅磁共振(MRI)检查及脑白质病变程度的测定所有入组者均接受头颅MRI(3.0T)扫描(T1、T2、FLAIR、DWI序列)。根据既往文献[8-9]所得CHIPS评分方法:在MRI轴位第三脑室和侧脑室的4个层面上(从下往上依次为低外囊层面、高外囊层面、放射冠层面、半卵圆中心层面),每个区的脑白质疏松(WMH)的程度评分为3级:0分为正常;1分为轻度,区域中 < 50%的部分受累;2分为中到重度,区域中有大约50%的部分受累。每个层面根据胆碱能纤维的分布密度进行加权处理(低外囊层面分前部、后部,权重均为4;高外囊层面分扣带回、前部、后部,权重分别4、3、3;放射冠层面分前部、后部、扣带回,权重分别2、2、1;半卵圆中心层面分前部、后部,权重均为1)。评分均为FLAIR序列上进行,左右半球分别记分,各部位所得分别各自乘以相应的权重后求和,即为CHIPS总分,左右半球单侧最高共计50分,4个层面最高共计100分。由受专业培训的临床医师进行评分及统计,以备案统计。以本研究一患者为例,见图 1。
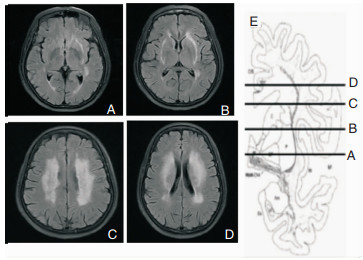
|
| 图 1 头颅MRI上FLAIR加权上CHIPS评分的参考层面及解剖面[10] 注:A:低外囊层面;B:高外囊层面;C:半卵圆中心层面;D:放射冠层面;E:与图A、B、C、D相对应的CHIPS通路解剖图。该患者CHIPS总分68分,A外囊下部平面:前部(右侧=0,左侧=2,权重=*4,计分=8),后部(右侧=1,左侧=2,权重=*4,计分=12);B外囊上部平面:扣带回(右侧=0,左侧=0,权重=*4,计分=0),前部(右侧=2,左侧=2,权重=*3,计分=12),后部(右侧=2,左侧=2,权重=*3,计分=12);C半卵圆中心平面:前部(右侧=2,左侧=2,权重=*1,计分=4),后部(右侧=2,左侧=2,权重=*1,计分=4);D放射冠平面:前部(右侧=2,左侧=2,权重=*2,计分=8),后部(右侧=2,左侧=2,权重=*2,计分=8),扣带回(右侧=0,左侧=0,权重=*1,计分=0)。 |
所有入组者(签署知情同意书,且碘过敏试验阴性)均接受荷兰Phillip公司生产的Brilliance 32排螺旋CT扫描,使用非离子型造影剂碘海醇100 ml。采集颅内血管信息后由两位影像科副主任医师采用盲法处理图像及评估。对头颈部血管采用分段式评估:颈内动脉系统,若狭窄程度超过眼动脉则记为颅内狭窄,颈内动脉颅内段包括至大脑前动脉A2段、大脑中动脉M2段;椎动脉系统根据枕骨大孔水平分颅内外段,包括至大脑后动脉P2段。血管狭窄程度由2位研究者独立评价后汇总。
1.3 统计学方法所有数据录入计算机后,采用SPSS 17.0软件进行分析。计数资料、计量资料的组间比较,分别采用t检验、卡方检验和Fisher确切概率法等;相关性分析采用Spearson等级相关系数法。
2 结果 2.1 血管危险因素的一般比较文化程度、高血压病、糖尿病、高脂血症在研究组与对照组间对比,差异均无统计学意义(P > 0.05);脑小血管病变在两组间的对比,差异具有统计学意义(P < 0.05)。见表 1。
| 组别 | 例数 | 教育≤9 | 吸烟 | 高血压病 | 糖尿病 | 高脂血症 | 脑小血管病 |
| 研究组 | 85 | 74 | 21 | 42 | 17 | 58 | 10 |
| 对照组 | 33 | 25 | 11 | 12 | 4 | 19 | 9 |
| χ2 | 2.247 | 0.895 | 1.631 | 1.009 | 1.191 | 4.232 | |
| P | 0.134 | 0.344 | 0.202 | 0.315 | 0.275 | 0.040 |
脑小血管病在伴有颅血管狭窄的研究组(Y组)和伴有颅血管狭窄的对照组(C组)间比较,差异无统计意义(P=0.698)。见表 2。
研究组颅内血管狭窄的发生率高于对照组,差异有统计学意义(χ2=4.125, P=0.042)。见表 3。
研究组MoCA总分及其分项均显著低于对照组,差异均有统计学意义;研究组CHIPS得分显著高于对照组,差异有统计学意义。见表 4。
| 组别 | 例数 | MoCA评分 | 视空间与执行 | 命名 | 注意力 | |
| 研究组 | 85 | 18.20±0.62 | 2.60±0.14 | 1.66±0.11 | 4.46±0.19 | |
| 对照组 | 33 | 27.67±0.23 | 4.52±0.17 | 2.58±0.10 | 5.79±0.08 | |
| t | -9.383 | -7.935 | -4.787 | -4.391 | ||
| P | 0.000 | 0.000 | 0.000 | 0.000 | ||
| 组别 | 例数 | 语言 | 抽象 | 延迟记忆 | 定向力 | CHIPS评分 |
| 研究组 | 85 | 1.65±0.11 | 0.49±0.08 | 1.49±0.16 | 4.49±0.22 | 14.54±1.66 |
| 对照组 | 33 | 2.64±0.10 | 1.48±0.12 | 3.73±0.19 | 5.88±0.07 | 9.00±1.15 |
| t | -5.444 | -6.745 | -7.804 | -3.850 | 2.007 | |
| P | 0.000 | 0.000 | 0.000 | 0.000 | 0.047 | |
研究组的脑白质病变严重程度(CHIPS得分)与MoCA总分及其分项呈负相关,其中与视空间与执行力、注意力、命名和定向力等多认知功能领域差异具有统计学意义(表 5)。MoCA评分及其分项(除抽象认知功能外)与颅内动脉狭窄的累及血管数呈负相关,差异具有统计学意义;CHIPS得分与颅内动脉狭窄的累及血管数呈正相关,差异具有统计学意义(表 6)。
| 项目 | MoCA总分 | 视空间与执行 | 命名 | 延迟记忆 | 注意力 | 语言 | 抽象 | 定向 |
| CHIPS(r值) | -0.469 | -0.404 | -0.239 | -0.121 | -0.456 | -0.209 | -0.205 | -0.311 |
| CHIPS(P值) | 0.000 | 0.000 | 0.028 | 0.268 | 0.000 | 0.054 | 0.060 | 0.004 |
| 项目 | MoCA总分 | 视空间与执行 | 命名 | 延迟记忆 | 注意力 |
| 颅内动脉狭窄(r值) | -0.407 | -0.356 | -0.246 | -0.222 | -0.240 |
| 颅内动脉狭窄(P值) | 0.000 | 0.001 | 0.023 | 0.041 | 0.027 |
| 项目 | 语言 | 抽象 | 定向 | CHIPS总分 | |
| 颅内动脉狭窄(r值) | -0.284 | -0.198 | -0.377 | 0.357 | |
| 颅内动脉狭窄(P值) | 0.008 | 0.069 | 0.000 | 0.001 | |
因整套神经心理学量表耗时长、可操作性差、不易随访,患者配合度不高。因此,采用MoCA量表对入组者进行认知功能评定,是一个敏感性、特异性较高的简易筛查工作,覆盖了重要的认知领域[11, 12]。中枢性胆碱能系统主要位于基底前脑,其中Meynert基底核发出的胆碱能纤维内侧通路沿深部脑白质及胼胝体周围到达扣带回,外侧通路经过侧脑室外侧、尾状核及外囊内侧到达皮质[10]。因纤维从基底核向上进入大脑半球呈扇形放射,其单位体积中的密度则逐渐降低,该通路被认为引起认知功能障碍的主要通路之一。CHIPS量表是对胆碱能通路脑白质疏松程度的一种视觉评定,突出脑白质疏松和Meynert基底核发出胆碱能通路投射空间的相关性[10],研究[13]提示脑白质胆碱能通路与认知功能具有一定的相关性,尤其以执行功能和视空间功能受损为主的认知功能减退[3]。本研究结论符合认知功能障碍与脑白质胆碱能通路损害具有相关性的观点,且证实了脑白质胆碱能通路的损害与视空间与执行力、注意力、命名和定向力等多领域认知功能缺损具有相关性。有研究[14]认为认知功能障碍患者存在脑白质纤维的完整性破坏现象。本课题推测认知功能障碍可能与Meynert基底核向不同皮质区域放射的纤维广泛性中断所引起。多领域认知功能障碍可能与胆碱能纤维中半卵圆中心、外囊区是脑血管病变好发部位,且易受小血管病的影响的特点有关[15]。认知功能障碍以视空间和执行力、注意力功能损害为主,可能与脑白质病变易影响前额叶﹣皮质下环路的结构和功能学说有关[16]。与语言、延迟记忆和抽象功能无明显相关性,可能与CHIPS侧重点的局限性相关,因为CHIPS忽略了涉及形成认知的其他胆碱能系统及相关的环路。
我们知道颈动脉系统供血于基底前胆碱能系统,隔区的血供来源于前交通动脉,Mynert基底核(Ch4)则大多由大脑前动脉近端发出的豆纹动脉所供血,这便可以解释半卵圆区、外囊及屏状核常受脑血管疾病影响导致失胆碱能神经支配状态[10]。其次,Willis动脉环粥样硬化是阿尔茨海默病(Alzheimer's disease, AD)的危险因素[17],可能导致了基底前脑胆碱能神经元的缺血缺氧。Rentsch-Granges等[18]研究提示颈动脉狭窄患者因低灌注可产生脑白质损伤。脑血流动力学改变、平均血流与认知功能障碍程度呈正相关[19]。颅内动脉狭窄是如何引起认知功能损害及对脑白质胆碱能通路影响的机制,目前仍无明确。本研究结果显示认知障碍患者中颅内血管狭窄比率较高,颅内动脉狭窄与脑白质胆碱能通路损害具有相关性,且影响多项认知功能。机制可能是脑白质是由细长的深穿支动脉供血,分支垂直且短,且侧脑室旁的脑白质处于动脉分界处,当血流动力学发生异常时,深穿支小动脉出现硬化或闭塞,导致它对缺血尤其敏感,脑白质疏松的形成则与脑白质胆碱能通路损害存在一定相关性,是认知功能损害发生的基本病理机制之一。脑动脉狭窄不仅可引起慢性脑血流低灌注状态,且脑血管狭窄后颅内血流动力学可发生变化,对认知功能、脑白质胆碱能通路产生影响。因此,颅内动脉狭窄在脑白质胆碱能通路病变致使多领域认知功能障碍过程中起到一定作用。本研究属于横断面研究,且需对患者的认知功能等方面进行随访。本研究亦存在样本量较少的缺点,需进一步验证结论。
| [1] |
Smith EE. Leukoaraiosis and stroke[J]. Stroke, 2010, 41(10 Suppl): 139-143. |
| [2] |
Bartus RT, Dean RL, Beer B, et al. The cholinergic hypothesis of geriatric memory dysfunction[J]. Science, 1982, 217(4558): 408-417. DOI:10.1126/science.7046051 |
| [3] |
Swartz RH, Sahlas DJ, Black SE. Strategic involvement of cholinergic pathways and executive dysfunction:does location of white matter signal hyperintensities matter?[J]. J Stroke Cerebrovasc Dis, 2003, 12(1): 29-36. DOI:10.1053/jscd.2003.5 |
| [4] |
Lee SJ, Kim JS, Lee KS, et al. The leukoaraiosis is more prevalent in the large artery atherosclerosis stroke subtype among Korean patients with ischemic stroke[J]. BMC Neurology, 2008, 8(1): 1-6. DOI:10.1186/1471-2377-8-1 |
| [5] |
李支援, 吕风亚, 张英. 大脑中动脉狭窄程度与不同急性脑梗死模式的相关性研究[J]. 国际神经病学神经外科学杂志, 2015, 42(3): 233-237. |
| [6] |
Portet F, Ousset PJ, Visser PJ, et al. Mild cognitive impairment (MCI) in medical practice:a critical review of the concept and new diagnostic procedure. Report of the MCI Working Group of the European Consortium on Alzheimer's Disease[J]. J Neurol Neurosurg Psychiatry, 2006, 77(6): 714-718. DOI:10.1136/jnnp.2005.085332 |
| [7] |
Chiti G, Pantoni L. Use of Montreal Cognitive Assessment in patients with stroke[J]. Stroke, 2014, 45(10): 3135-3140. DOI:10.1161/STROKEAHA.114.004590 |
| [8] |
黄纯臣, 李林昕, 韩翔, 等. 胆碱能通路损伤在血管性认知功能障碍中的作用[J]. 中华神经科杂志, 2010, 43(9): 612-616. DOI:10.3760/cma.j.issn.1006-7876.2010.09.004 |
| [9] |
Bohnen NI, Muler MLTM, Kuwabara H, et al. Age-associated leukoaraiosis and cortical cholinergic deafferentation[J]. Neurology, 2009, 72(16): 1411-1416. DOI:10.1212/WNL.0b013e3181a187c6 |
| [10] |
Selden NR, Gitelman DR, Salamon-Murayama N, et al. Trajectories of cholinergic pathways within the cerebral hemispheres of the human brain[J]. Brain, 1998, 121(Pt 12): 2249-2257. |
| [11] |
陈娟, 李瑜霞, 周晶, 等. MoCA、MMSE与AVLT在非痴呆型缺血性小血管性认知障碍的应用[J]. 华北理工大学学报(医学版), 2018, 1(20): 25-30. |
| [12] |
Luis CA, Keegan AP, Mullan M. Cross validation of the Montreal cognitive assessment in community dwelling older adults residing in the Southeastern US[J]. Int J Geriatr Psychiatry, 2010, 24(2): 197-201. |
| [13] |
Park HE, Park IS, Oh YS, et al. Subcortical whiter matter hyperintensities within the cholinergic pathways of patients with dementia and parkinsonism[J]. J Neurol Sci, 2015, 353(1-2): 44-48. DOI:10.1016/j.jns.2015.03.046 |
| [14] |
Weller RO, Hawkes CA, Kalaria RN, et al. White matter changes in dementia:role of impaired drainage of interstitial fluid[J]. Brain Pathol, 2015, 25(1): 63-78. DOI:10.1111/bpa.2015.25.issue-1 |
| [15] |
Wardlaw JM, Smith C, Dichgans M. Mechanism of sporadic cerebral small vessel disease:insights from neuroimaging[J]. Lancet Neurol, 2013, 12(5): 483-497. DOI:10.1016/S1474-4422(13)70060-7 |
| [16] |
Lamar M, Price CD, Penney D, et al. Alterations in working memory as a function of leukoaraiosis in dementia[J]. Neuropsychologia, 2007, 45(2): 245-254. DOI:10.1016/j.neuropsychologia.2006.07.009 |
| [17] |
Roher AE, Esh C, Rahman A, et al. Atherosclerosis of cerebral arteries in Alzheimer disease[J]. Stroke, 2004, 35(11 Suppl 1): 2623-2627. |
| [18] |
Rentsch-Granges V, Assal F, Pereira VM, et al. ADC mapping of chronic cerebral hypoperfusion induced by carotid artery stenosis[J]. J Neuroradiol, 2011, 38(4): 232-237. DOI:10.1016/j.neurad.2010.12.009 |
| [19] |
李政伟, 贾砚秋, 董艳红, 等. 血管性认知功能障碍患者经颅多普勒超声血流动力学变化与认知功能的关系[J]. 国际神经病学神经外科学杂志, 2016, 43(2): 108-111. |
 2018, Vol. 45
2018, Vol. 45




