扩展功能
文章信息
- 敖文玲, 胡明, 胡叶丽, 李方明, 王卫东, 陈为安
- AO Wen-Ling, HU Ming, HU Ye-Li, LI Fang-Ming, WANG Wei-Dong, CHEN Wei-An
- 帕金森病患者血浆中亲环素A的含量及其与炎症因子的相关性分析
- Plasma level of cyclophilin A and its correlation with inflammatory factors in patients with Parkinson's disease
- 国际神经病学神经外科学杂志, 2018, 45(4): 336-340
- Journal of International Neurology and Neurosurgery, 2018, 45(4): 336-340
-
文章历史
收稿日期: 2018-03-15
修回日期: 2018-07-15
2. 温州医科大学附属第一医院神经内科, 浙江省温州市 325035
中枢神经系统退行性疾病如帕金森病(Parkinson's disease, PD)等可诱导小胶质细胞(microglia)激活,促进多种促炎细胞因子的释放[1],同时可诱导一氧化氮、前列腺素E2和活性氧等的释放促进神经元的病变和凋亡,导致恶性循环,对中枢和外周神经系统产生严重损伤[2]。相关抗炎治疗也被证明可缓解神经退行性疾病患者神经元的炎症状态,因此抑制或缓解小胶质细胞炎症是减缓神经退行性疾病中神经元死亡的重要策略之一[3]。亲环素A(cyclophilin A, CyPA)是一种具有多种生物学功能的可释放型蛋白质,多项研究显示CyPA是炎症和氧化应激的新型介导物,是神经退行性疾病、心血管疾病、糖尿病、病毒感染和血栓形成等疾病的主要参与者[4-5]。在帕金森病患者外周血中CyPA含量变化如何及其与促炎细胞因子关系如何尚不清楚,因此本研究以帕金森患者及BV-2小胶质细胞为研究对象,探讨CyPA在帕金森患者神经元炎症状态中的作用,为帕金森病的抗炎治疗提供实验基础。
1 对象与方法 1.1 研究对象收集2015年6月至2017年6月我院神经内科收治的帕金森病患者80例(帕金森组),男48例,女32例,年龄59~92岁,平均年龄(72.7±9.5)岁。病程1~25年,其中1~5年20例,5~10年31例,10年以上29例。按照帕金森病Honehn&Yahr分级标准对所有患者进行分级,其中早期18例,中期34例,晚期28例。帕金森病诊断标准参照2016版中国帕金森病诊断标准。排除标准:①近期有全身性或系统性感染者;②合并自身免疫性疾病或活动性免疫性疾病者;③合并单一或多种恶性肿瘤者;④严重肝肾功能障碍者等。另选取与帕金森组年龄和性别构成相匹配的同期健康体检者80例为对照(对照组),其中男40例,女40例,年龄60~87岁,平均年龄(70.6±8.3)岁。
1.2 主要仪器和试剂 1.2.1 主要仪器全自动生化分析仪(Beckman Coulter,美国);低温高速离心机(Beckman Coulter,美国);超净工作台(苏州安泰,中国);普通PCR仪(Bio-Rad,美国);实时荧光定量PCR仪(ABI,美国);电泳仪、电转仪及凝胶成像系统(Bio-Rad,美国);恒温气浴摇床(海门其林贝尔仪器制造有限公司,中国)、多功能酶标仪(Molecular Devices,美国)。
1.2.2 主要试剂LPS(Abcam,美国);hs-CRP,TNF-α,IL-6和IL-1β ELISA试剂盒(Biolegend,美国);总RNA提取试剂盒(天根生化科技(北京)有限公司,中国);逆转录试剂盒(宝生物工程(大连)有限公司,日本);荧光定量PCR试剂盒(QIAGEN,美国);PCR引物(华大基因,中国);anti-CyPA(Abcam,美国);anti-GAPDH及HRP标记二抗(北京中杉金桥生物技术有限公司,中国)、ECL发光液(ThermoFisher,美国)。
1.3 实验方法 1.3.1 血浆CyPA及血清促炎细胞因子检测所有受检者空腹采集外周静脉血,1 h内离心分离血浆或血清。离心速度为3000 r/min,离心10 min。分离血浆或血清后,全自动生化分析仪检测CyPA和超敏C反应蛋白(hypersensitive C-reactive protein, hs-CRP)、肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、白细胞介素6(interleukin 6, IL-6)和白细胞介素1β(interleukin 1β, IL-1β)的含量。
1.3.2 BV-2小胶质细胞培养采用含10%胎牛血清和1%青链霉素的DMEM/F12培养液培养BV-2小胶质细胞,置于37℃,含5% CO2培养箱中静置培养。待细胞融合度达到80%时,以0.25%胰酶-EDTA消化细胞并进行传代培养。
1.3.3 RT-qPCR检测CyPA mRNA的表达变化按RNA提取试剂盒和逆转录试剂盒说明书提取总RNA并逆转录为cDNA。以cDNA为模板进行RT-qPCR反应。CyPA和GAPDH引物序列见表 1。反应条件如下:95℃变性5 min,95℃变性10 s,59℃退火30 s,72℃延伸30 s,40个循环。根据目的基因的相对量=2(CtGAPDH-CtCyPA)计算CyPA mRNA的表达变化。
| 基因名称 | 引物序列(5'-3') | 产物大小(bp) |
| CyPA | 上游 ACTCCTCATTTAGATGGGCATCA | 126 |
| 下游 GAGTATCCGTACCTCCGCAAA | ||
| GAPDH | 上游 GTCGCCAGCCGAGCCACATC | 107 |
| 下游 CCAGGCGCCCAATACGACCA |
以RIPA Buffer提取总蛋白,加入5×SDS Loading Buffer,99℃加热5 min使蛋白变性。取20 μg进行SDS-PAGE凝胶电泳,切取凝胶进行电转,35 V湿转过夜,5%BSA室温封闭2 h,PBST洗3次,每次5 min;室温孵育一抗1 h,PBST洗3次,每次5 min;室温孵育二抗30 min,PBST洗三次,每次5 min:室温孵育ECL发光液1 min,进行凝胶成像并拍照,以灰度值CyPA/灰度值GAPDH计算目的蛋白的表达变化。
1.4 统计学分析采用SPSS 19.0软件进行统计分析,计量资料以均数±标准差(x±s)表示,两组间比较采用student's t检验,多样本均数间比较采用单因素方差分析,组间的两两比较采用Student-Newman-Keuls检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 帕金森组和对照组CyPA和促炎细胞因子含量比较帕金森组血浆CyPA,血清hs-CRP、TNF-α、IL-6和IL-1β含量均高于对照组,差异有统计学意义(P < 0.05),见表 2。
| (x±s) | ||||||
| 组别 | 例数 | CyPA(ng/L) | hs-CRP(mg/L) | TNF-α(pg/mL) | IL-6(pg/mL) | IL-1β(pg/mL) |
| 对照组 | 80 | 2.35±0.37 | 1.74±0.86 | 165.76±82.16 | 2.80±1.41 | 22.22±14.07 |
| 帕金森组 | 80 | 6.02±0.57 | 4.93±1.56 | 332.69±87.53 | 20.2±7.05 | 231.11±72.58 |
| t | 55.36 | 16.00 | 12.44 | 21.41 | 25.27 | |
| P | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | |
相关性分析结果显示,帕金森病患者血浆CyPA含量与TNF-α、IL-6和IL-1β呈正相关关系(P < 0.05),与hs-CRP无明显相关性(P > 0.05),见图 1。
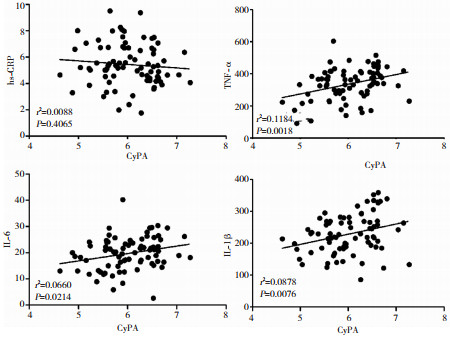
|
| 图 1 帕金森病患者CyPA含量与促炎细胞因子含量的相关性。 |
帕金森病患者血浆CyPA含量与疾病病程长短无关(P > 0.05),而与疾病严重程度有关(P < 0.05),随着疾病加重,CyPA含量升高,见表 3。
| 指标 | 疾病病程(年) | H&Y分级 | |||||
| > 10 | 1~5 | 5~10 | 早期 | 中期 | 晚期 | ||
| CyPA(ng/L) | 5.98±0.55 | 5.99±0.58 | 6.02±0.46 | 5.51±0.51 | 6.00±0.43 | 6.34±0.36 | |
| F | 0.041 | 20.630 | |||||
| P | 0.959 | 0.000 | |||||
与未处理LPS组比较,LPS处理BV-2小胶质细胞后,CyPA mRNA和蛋白的表达增加,两组比较,差异有统计学意义(P < 0.05),见图 2。
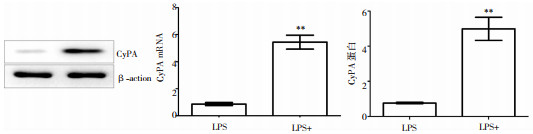
|
| 图 2 LPS诱导的BV-2小胶质细胞炎症模型CyPA mRNA和蛋白的表达变化 注:**为与LPS-组比较,P < 0.01 |
采用siRNA敲减LPS诱导的BV-2小胶质细胞中CyPA的含量,结果显示,敲减CyPA可减少TNF-α、IL-6和IL-1β的含量,与对照组比较,差异有统计学意义(P < 0.05),而对hs-CRP含量无明显影响(P > 0.05),见图 3。
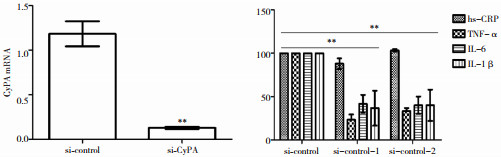
|
| 图 3 CyPA对细胞促炎因子表达的影响 注:**为与LPS-组比较,P < 0.01 |
帕金森病最主要的病理改变是中脑黑质多巴胺能神经元的变性死亡,并由此引起纹状体多巴胺含量显著性减少而致病。但目前具体的病因仍不清楚,遗传因素、环境因素、年龄老化和氧化应激等均可能参与帕金森病多巴胺能神经元的变性死亡过程[6]。有研究发现[7],神经炎症是帕金森等神经退行性疾病的一种主要病理过程,在帕金森病患者的黑质纹状体中存在大量小胶质细胞激活,激活后产生的多种细胞因子(如TNF-α、IL-6和IL-1β等)可以引起炎症反应,促进神经元的病变和凋亡,导致恶性循环,对中枢和外周神经系统产生严重损伤。因此,控制小胶质细胞炎症是帕金森的治疗策略之一[8]。本研究以帕金森患者和BV-2小胶质细胞为研究对象,寻找控制小胶质细胞炎症反应的可能靶点,为帕金森病的治疗提供实验基础。帕金森病患者外周血促炎细胞因子含量检测结果显示,hs-CRP、TNF-α、IL-6和IL-1β含量高于对照组,提示帕金森患者确实处于炎症状态,与文献报道一致。
亲环素A(CyPA)是最早发现的亲环素家族蛋白,由165个氨基酸组成,存在于哺乳动物所有类型细胞中。CyPA具有肽脯氨酰顺反异构酶活性,作为分子伴侣参与体内多种蛋白的成熟、折叠、活化、稳定及定位[9]。近年来的研究发现,CyPA与炎症的发生密切相关,是氧化应激和炎症的新型介导物[10, 11]。CyPA是一种胞内蛋白,但多种因素可导致其释放,如炎症、缺氧、氧化应激及其他刺激。Heinzmann等[12]研究发现,新型细胞外CyPA抑制剂MM284可减少肌钙蛋白Ⅰ诱导的心肌炎小鼠模型的心肌炎症。Li等[13]研究发现,在LPS诱导的小鼠急性肺损伤模型中,CyPA抗体处理可减轻肺组织炎症反应,并可显著减少血清中IL-1β的含量。本研究结果显示,CyPA含量与TNF-α、IL-6和IL-1β呈正相关关系,与hs-CRP无明显相关性,且帕金森病患者血浆CyPA含量与疾病病程长短无关,而与疾病严重程度有关,提示CyPA可能与疾病进展有关。在LPS诱导的BV-2小胶质细胞炎症模型结果显示,敲减CyPA的表达可减少TNF-α、IL-6和IL-1β含量,而对hs-CRP无明显影响,说明CyPA可通过促进促炎细胞因子的分泌导致炎症反应。Sun等[14]研究发现CypA可与NF-κB亚基p65/RelA相互作用并促进NF-κB激活信号传导,而TNF-α、IL-6和IL-1β均为NF-κB信号通路的炎症因子,因此本研究结果与Sun等[14]文献报道一致。
综上所述,CyPA可能通过NF-κB信号通路促进促炎细胞因子的分泌进而导致炎症反应,而炎症反应又可进一步促进小胶质细胞释放CyPA,导致恶性循环,加重神经系统的炎症反应。本研究为以神经炎症为病理过程的神经退行性疾病的抗炎治疗提供了实验基础。
| [1] |
Sznejder-Pachołek A, Joniec-Maciejak I, Wawer A, et al. The effect of α-synuclein on gliosis and IL-1α, TNFα, IFNγ, TGFβ expression in murine brain[J]. Pharmacol Rep, 2017, 69(2): 242-251. DOI:10.1016/j.pharep.2016.11.003 |
| [2] |
Lee DS, Lee M, Sung SH, et al. Involvement of heme oxygenase-1 induction in the cytoprotective and neuroinflammatory activities of Siegesbeckia Pubescens isolated from 5, 3'-dihydroxy-3, 7, 4'-trimethoxyflavone in HT22 cells and BV2 cells[J]. Int Immunopharmacol, 2016, 40: 65-72. DOI:10.1016/j.intimp.2016.08.030 |
| [3] |
Weng L, Zhang H, Li X, et al. Ampelopsin attenuates lipopolysaccharide-induced inflammatory response through the inhibition of the NF-κB and JAK2/STAT3 signaling pathways in microglia[J]. Int Immunopharmacol, 2017, 44: 1-8. DOI:10.1016/j.intimp.2016.12.018 |
| [4] |
汤镇, 曾丹. 亲环素A的相关研究进展[J]. 检验医学与临床, 2016, 13(4): 556-559. DOI:10.3969/j.issn.1672-9455.2016.04.053 |
| [5] |
Pasetto L, Pozzi S, Castelnovo M, et al. Targeting Extracellular Cyclophilin A Reduces Neuroinflammation and Extends Survival in a Mouse Model of Amyotrophic Lateral Sclerosis[J]. J Neurosci, 2017, 37(6): 1413-1427. DOI:10.1523/JNEUROSCI.2462-16.2016 |
| [6] |
Bjørklund G, Stejskal V, Urbina MA, et al. Metals and Parkinson's disease: Mechanisms and biochemical processes[J]. Curr Med Chem, 2017. [Epub ahead of print] http://www.researchgate.net/publication/321334348_Metals_and_Parkinson's_disease_Mechanisms_and_biochemical_processes
|
| [7] |
王莹雪, 卞育婕, 周玉奇, 等. 帕金森病动物模型神经炎症反应与损伤的研究进展[J]. 神经解剖学杂志, 2017, 33(1): 90-94. |
| [8] |
Lee DS, Kwon KH, Cheong SH. Taurine Chloramine Suppresses LPS-Induced Neuroinflammatory Responses through Nrf2-Mediated Heme Oxygenase-1 Expression in Mouse BV2 Microglial Cells[J]. Adv Exp Med Biol, 2017, 975: 131-143. DOI:10.1007/978-94-024-1079-2 |
| [9] |
Tsai SF, Hsieh CC, Wu MJ, et al. Novel findings of secreted cyclophilin A in diabetic nephropathy and its association with renal protection of dipeptidyl peptidase 4 inhibitor[J]. Clin Chim Acta, 2016, 463: 181-192. DOI:10.1016/j.cca.2016.11.005 |
| [10] |
Xue C, Sowden M, Berk BC. Extracellular Cyclophilin A, Especially Acetylated, Causes Pulmonary Hypertension by Stimulating Endothelial Apoptosis, Redox Stress, and Inflammation[J]. Arterioscler Thromb Vasc Biol, 2017, 37(6): 1138-1146. DOI:10.1161/ATVBAHA.117.309212 |
| [11] |
Zhang M, Tang J, Yin J, et al. The clinical implication of serum cyclophilin A in patients with chronic obstructive pulmonary disease[J]. Int J Chron Obstruct Pulmon Dis, 2018, 13: 357-363. DOI:10.2147/COPD |
| [12] |
Heinzmann D, Bangert A, Müller AM, et al. The Novel Extracellular Cyclophilin A (CyPA)-Inhibitor MM284 Reduces Myocardial Inflammation and Remodeling in a Mouse Model of Troponin Ⅰ-Induced Myocarditis[J]. PLoS One, 2015, 10(4): e0124606. DOI:10.1371/journal.pone.0124606 |
| [13] |
Li W, Liu W, Chen C, et al. Effect of extracellular cyclophilin A on inflammatory response and anti-inflammatory activity of antibody against cyclophilin A[J]. Sheng Wu Gong Cheng Xue Bao, 2018, 34(1): 90-101. |
| [14] |
Sun S, Guo M, Zhang JB, et al. Cyclophilin A (CypA) interacts with NF-κB subunit, p65/RelA, and contributes to NF-κB activation signaling[J]. PLoS One, 2014, 9(8): e96211. DOI:10.1371/journal.pone.0096211 |
 2018, Vol. 45
2018, Vol. 45




