扩展功能
文章信息
- 熊炬, 李晶, 王佳, 周文胜
- XIONG Ju, LI Jing, WANG Jia, ZHOU Wen-Sheng
- 蛋白酶抑制剂H89对神经元细胞氧糖剥夺再灌注后高尔基体形态及细胞凋亡的影响
- Effect of protease inhibitor H89 on morphology of the Golgi apparatus and apoptosis after oxygen-glucose deprivation followed by reperfusion in neurons
- 国际神经病学神经外科学杂志, 2018, 45(3): 287-292
- Journal of International Neurology and Neurosurgery, 2018, 45(3): 287-292
-
文章历史
收稿日期: 2017-10-21
修回日期: 2018-04-11
2. 长沙市精神病医院神经内科, 湖南省长沙市 410004;
3. 湖南省人民医院(湖南师范大学附属第一医院)省老年医学研究所, 湖南省长沙市 410016
脑梗死的病理生理机制极其复杂,其中缺血再灌注损伤是导致神经功能缺损的主要原因[1-3]。脑缺血再灌注损伤的发生机制有多种因素参与,氧化应激与其密切相关[4, 5]。既往认为线粒体和溶酶体是介导氧化应激最重要的两个细胞器,而越来越多的研究显示,高尔基体(Golgi apparatus, GA)也参与到氧化应激当中[6]。过于强烈的氧化应激将导致高尔基体碎裂,介导细胞凋亡应激信号的转导与放大,触发高尔基体相关凋亡通路。在以氧化应激为主要发生机制的脑缺血再灌注损伤中,是否同样发生高尔基体碎裂,通过干预高尔基体形态改变是否可以减轻神经元细胞凋亡,是本实验的目的。H89是常用的PKA抑制剂,可以通透细胞,选择性抑制多种蛋白激酶(包括PKA、PKC和PKD,其中PKA和PKD涉及到对高尔基体形态的控制),H89对PKA的选择性抑制作用更强[7-9]。在用NMDA介导皮质神经元细胞凋亡的实验中,加入H89干预后能明显减轻高尔基体碎裂,延缓细胞凋亡[7]。本实验对小鼠海马神经元细胞系HT22细胞进行氧糖剥夺再灌注以模拟缺血再灌注损伤,通过加入H89干预,以探讨H89在缺血再灌注损伤中对高尔基体形态及细胞凋亡的影响。
1 材料与方法 1.1 材料小鼠海马神经元细胞系HT22(本室保存);胎牛血清(美国Gemini公司);高糖DMEM培养基和无糖DMEM培养基(石家庄Kccell公司);Hoechest33258(美国Sigma公司);MTT(美国Sigma公司);H89(上海碧云天);GM130抗体(美国Abcam公司);GAAP抗体(美国Santa cruz公司);β-tubulin抗体(杭州联科生物);β-actin抗体(美国Proteintech公司);二抗和荧光二抗(美国Proteintech公司);ECL超敏发光液和PVDF膜(美国Millipore公司)。
1.2 方法 1.2.1 细胞培养、分组用含有10%胎牛血清的高糖DMEM完全培养基,在5%CO2、37℃恒温恒湿培养箱培养HT22细胞。待细胞融合至80%~90%即可传代,取细胞形态良好、对数增殖期培养的细胞用于后续实验。实验分为对照组、模型组和H89干预组,模型组与H89干预组按再灌注时间点分6h、12h和24h亚组。
1.2.2 建立HT22细胞氧糖剥夺再灌注(OGD/R)损伤模型首先用无糖DMEM培养基冲洗细胞3次,替换掉完全培养基,放置于含1%O2、5%CO2和94%N2的三气培养箱中缺氧缺糖培养6 h,然后将培养基替换为完全培养基,放置于37℃、5%CO2常规培养箱中复氧培养,分别继续培养6 h、12 h和24 h。
1.2.3 MTT检测细胞存活率各组细胞各设3个复孔,每孔加入25 μL溶解于DMEM的MTT溶液(5 mg/mL),在培养箱中孵育4 h,弃掉培养液,加入150 μL DMSO溶液,37℃摇床低速振荡10 min,用酶标仪检测细胞在490 nm处的吸光度(A)值。用每组A值与空白对照组A值的比值来计算细胞存活率,实验重复3次,最后取平均值。
1.2.4 Hoechst33258检测细胞凋亡率各组HT22细胞加入Hoechest33258溶液(5 μg/ml),37℃孵育10 min。抗荧光淬灭剂封片,避光,荧光显微镜观察拍片。随机选取3个高倍视野,计算每个视野细胞凋亡率(凋亡细胞数/总细胞数×100%)。
1.2.5 细胞免疫荧光观察高尔基体的碎裂通过GM130标记高尔基体,β-Tubulin标记细胞微管结构,观察高尔基体的形态变化。各组HT22细胞经4%多聚甲醛室温固定后,经0.5%tritonX-100通透30 min,用兔源GM130单抗(1 :100)和小鼠源β-tubulin单抗(1 :200)4℃孵育过夜,TBS洗,FITC山羊抗兔和Alex Fuor 595山羊抗小鼠荧光二抗室温孵育1 h,TBS洗,封片剂封片,奥林巴斯荧光倒置显微镜电脑采像。
1.2.6 Western blot检测GM130和GAAP蛋白表达收集各组HT22细胞,提取总蛋白,BCA蛋白定量试剂盒检测蛋白浓度,按每孔上样量50 μg进行SDS-PAGE电泳,恒流冰浴电转至PVDF膜上,5%牛血清白蛋白室温封闭2 h,加入相应一抗,抗GM130(1 :1000)、GAAP(1 :100)和β-actin(1 :4000),4℃孵育过夜。用TBST洗3次,每次10 min。加入相应二抗37℃孵育1 h,TBST漂洗4次,ECL显影和采图。β-actin为内参,利用Quantity one软件将目标条带与β-actin条带吸光度值之比为其蛋白表达水平的相对值,实验重复3次。
1.3 统计学分析所有数据应用SPSS 19.0统计软件进行统计学分析。数据均采用均数±标准差(x ±s)表示,多组间比较应用单因素方差分析,两组间比较用LSD-t检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 H89干预对氧糖剥夺再灌注后HT22细胞活力的影响模型组与H89干预组HT22细胞经氧糖剥夺6 h,再灌注6 h、12 h和24 h,细胞活力与对照组比较呈下降趋势,差异均有统计学意义(P < 0.05)。H89干预组细胞活力较模型组有所上升,其中在12 h时间点有显著差异(P < 0.05),但在6 h和24 h时间点无差异(P>0.05)。见表 1。
| 组别 | R6h | R12h | R24h |
| 对照组 | 0.2184±0.0027 | 0.2184±0.0027 | 0.2184±0.0027 |
| 模型组 | 0.1664±0.0067* | 0.1314±0.0047* | 0.1060±0.0069* |
| H89干预组 | 0.1769±0.0059* | 0.1467±0.0090*# | 0.1190±0.0095* |
| 注:*表示与对照组比较,P < 0.05;#表示与模型组对应时间点两两比较,P < 0.05。 | |||
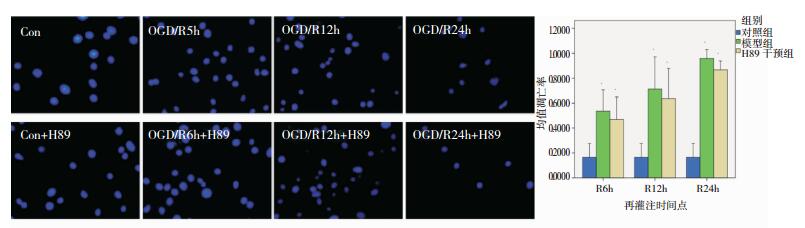
模型组和H89干预组随再灌注时间的延长,HT22细胞凋亡率与对照组比较显著上升,差异均有统计学意义(P < 0.05)。H89干预组与模型组分别在对应的各时间点比较,凋亡率有所下降,但差异均无统计学意义(P>0.05)。见图 1。
|
| 图 1 H89干预对HT22细胞凋亡的影响 注:A:模型组与H89干预组各时间点Hoechst33258细胞凋亡(×400)。B:模型组与H89干预组各时间点Hoechst33258细胞凋亡率比较。*表示与对照组比较,P < 0.05。 |
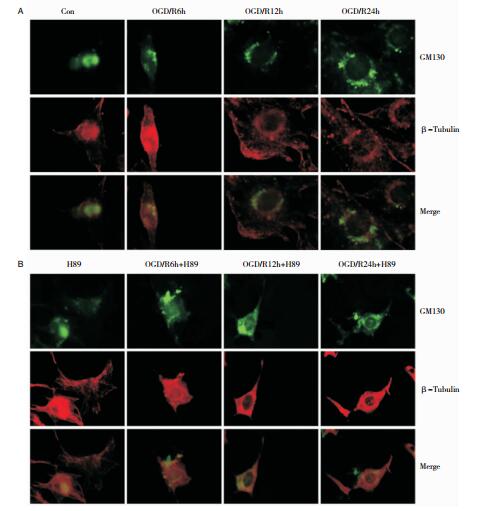
在对照组中,HT22细胞内高尔基体结构紧密,聚集于核边,不分散;在模型组再灌注6h时间点,部分细胞高尔基体结构较对照组稍有松散,可见少量碎裂片段,但仍聚集于核周;在模型组再灌注12h和24h时间点,高尔基体出现明显碎裂,结构松散,可见较多碎裂片断,呈点状、颗粒状或片断状,与细胞核聚集不紧密,且部分分布于细胞浆中(图 2A)。在H89干预组再灌注6h和12h时间点,可见高尔基体结构松散,形态基本完整未发生明显碎裂,与同期模型组比较碎裂程度有所减轻;在H89干预组再灌注24 h后,高尔基体出现体积扩大,囊膜结构发生明显碎裂,与同期模型组比较碎裂程度无显著差异(图 2B)。
|
| 图 2 H89干预对HT22细胞高尔基体形态的影响 注:A:免疫荧光观察模型组细胞高尔基体形态变化(×400)。B:免疫荧光观察H89干预组细胞高尔基体形态变化(×400)。 |
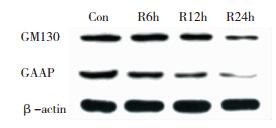
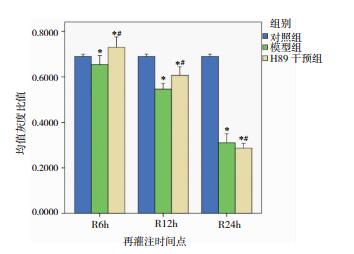
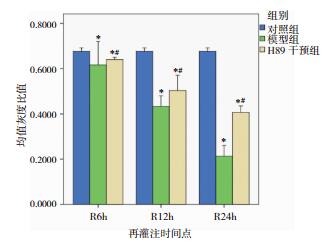
模型组与H89干预组GM130和GAAP蛋白表达水平在12h和24h时间点与对照组比较下降明显,差异有统计意义(P < 0.05)。H89干预组的GM130蛋白表达水平与同期模型组比较无显著差异(P>0.05);H89干预组GAAP蛋白表达水平仅在24h时间点较同期模型组显著增高,差异有统计学意义(P < 0.05),其余时间点与同期模型组比较差异无统计学意义。见图 3、图 4、图 5、图 6。
|
| 图 3 模型组GM130与GAAP蛋白表达变化 |

|
| 图 4 H89干预组GM130与GAAP蛋白表变化 |
|
| 图 5 模型组与H89干预组各时间点GM130蛋白表达 注:*表示与对照组比较,P < 0.05;#表示H89干预组与模型组对应时间点两两比较,P < 0.05。 |
|
| 图 6 模型组与H89干预组各时间点GAAP蛋白表达 注:*表示与对照组比较,P < 0.05;#表示H89干预组与模型组对应时间点两两比较,P < 0.05。 |
脑梗死后缺血再灌注诱发的严重而持续的氧化应激反应,导致神经细胞发生凋亡,是脑梗死后神经功能缺损的主要原因[3, 10-12]。2011年胡治平课题组在国际上首次提出“高尔基体应激(Golgi apparatus stress, GA stress)”概念[6],系统和全面地阐述了高尔基体与氧化应激的密切联系。在氧化应激损伤中,高尔基体参与应激信号的感知与处理,通过启动信号通路来减轻应激损伤,如果氧化应激过于强烈,损伤不可逆转,则触发细胞凋亡[13]。高尔基体在与氧化应激密切相关的多种神经系统疾病中表现出重要的形态变化,如脑缺血[14]、肌萎缩侧索硬化(ALS)[15, 16]、帕金森病(PD)[17, 18]和阿尔茨海默病(AD)[19, 20]等疾病中均发现了高尔基体碎裂的现象,并随时间延长而加重。最近的研究表明,高尔基体是细胞内死亡信号途径的重要感受者与放大者,在细胞凋亡早期,核染色体DNA还未改变之前,高尔基体就已出现结构和功能的变化,说明其在细胞凋亡过程中起重要的早期启动作用[7, 21]。
在本实验中,HT22细胞经氧糖剥夺再灌注后细胞活性降低,凋亡率上升,且随再灌注时间的延长,上述损伤表现逐渐加重,这种变化规则基本符合缺血再灌注损伤的病理生理特点。HT22细胞经氧糖剥夺再灌注后高尔基体形态出现异常,随再灌注时间的延长,高尔基体逐渐发生碎裂,呈长条状或颗粒状,尤以再灌注12h和24h时间点最为明显。因此,我们认为,在脑缺血再灌注损伤中,同样发生了高尔基体应激,高尔基体形态出现碎裂。同时,高尔基体碎裂时间点与细胞活性下降、凋亡率上升及蛋白表达水平下降时间点基本一致,故可认为高尔基体碎裂与神经元细胞凋亡有一定相关性。既往认为高尔基体碎裂是细胞凋亡的晚期效应,但近年来更多的研究[22]表明,高尔基体碎裂可能是其更主动地参与细胞凋亡及凋亡启动的表现。在本实验中,高尔基体碎裂究竟是细胞凋亡的结果还是参与启动凋亡,我们通过干预实验予以证实。本实验中我们使用H89干预高尔基体的碎裂,通过检测细胞活性、凋亡率、GM130与GAAP蛋白表达水平及观察高尔基体形态变化,以探讨是否可以通过干预高尔基体的形态变化从而减轻神经元细胞在缺血再灌注损伤中发生的细胞凋亡[22],但实验结果显示,各项检测指标均没有表现出显著的差异。
H89是广谱的蛋白酶抑制剂,有研究表明H89可以保持高尔基体形态的完整。H89作为PKA抑制剂,其对高尔基体的保护作用是比较明确的,同时还通过其他途径产生神经细胞保护作用[7, 9, 23, 24]。Nakagomi等[7]在一项用NMDA损伤鼠皮质神经元细胞诱导细胞发生凋亡的实验中发现,加入H89干预后能显著减轻高尔基体的碎裂和延缓细胞凋亡。但我们的干预实验不符合预期,加入H89后干预组的细胞活性、凋亡率和蛋白表达水平与模型组比较有一定的提高或减轻,但没有统计学差异;免疫荧光所观察到的干预组细胞高尔基体形态在再灌注早中期较模型组相对完整,但在再灌注后期没有差异。我们可以认为“在脑缺血再灌注损伤中,同样发生了高尔基体碎裂”,但还不能得出“在脑缺血再灌注损伤中通过干预高尔基体形态改变可以减轻神经元细胞凋亡”这一结论。究其原因,H89使用浓度不符合实验要求可能是实验结果不符合预期的主要原因。在前期实验中,我们参考国外文献[7]使用终浓度为1 mM剂量的H89对细胞进行干预处理,结果所有细胞均发生死亡,考虑该文献中实验所用细胞与我们实验所用细胞不同,我们再次进行了预实验以探索H89的适合浓度。在预实验中,使用50 μM、100 μM、200 μM、400 μM和700μM多个剂量处理细胞并测定MTT值,结果显示终浓度为100 μM的H89剂量为对细胞活性无影响的最大剂量,在后续的干预实验中均采用此剂量,尽管该剂量对细胞活性无明显影响,但是否适合氧糖剥夺再灌注这一实验方法,是否适合HT22细胞以及在氧糖剥夺再灌注损伤中能否对HT22细胞高尔基体起到很好的保护作用我们并不确定,也没有相关的文献支持。结合实验结果来看,考虑100 μM的H89剂量可能并不是符合本实验的最佳干预剂量,这可能是实验结果不符合预期的最主要原因,同时,也不排除其他的因素对实验结果所产生的影响。在后续的实验中,我们将继续探索适合本实验的最佳H89终浓度,同时也对造模等其他实验方法进行优化。
| [1] |
Awooda HA, Lutfi MF, Sharara GGM, et al. Oxidative/nitrosative stress in rats subjected to focal cerebral ischemia/reperfusion[J]. Int J Health Sci (Qassim), 2015, 9(1): 17-24. DOI:10.12816/0024679 |
| [2] |
Tao T, Li CL, Yang WC, et al. Protective effects of protocol against whole cerebral ischemia/reperfusion injury in rats through the inhibition of the apoptosis-inducing factor pathway[J]. Brain Res, 2016, 1644: 9-14. DOI:10.1016/j.brainres.2016.05.006 |
| [3] |
Gottlieb RA. Cell death pathways in acute ischemia/reperfusion injury[J]. J Cardiovasc Pharmacol Ther, 2011, 16(3-4): 233-238. DOI:10.1177/1074248411409581 |
| [4] |
严利, 周文胜, 王佳. 过氧化氢干预下Rab30在PC12细胞中的表达及促凋亡通路[J]. 国际神经病学神经外科学杂志, 2016, 43(6): 516-520. |
| [5] |
Niizuma K, Yoshioka H, Chen H, et al. Mitochondrial and apoptotic neuronal death signaling pathways in cerebral ischemia[J]. Biochim Biophys Acta, 2010, 1802(1): 92-99. DOI:10.1016/j.bbadis.2009.09.002 |
| [6] |
Jiang Z, Hu Z, Zeng L, et al. The role of the Golgi apparatus in oxidative stress:is this organelle less significant than mitochondria?[J]. Free Radic Biol Med, 2011, 50(8): 907-917. DOI:10.1016/j.freeradbiomed.2011.01.011 |
| [7] |
Nakagomi S, Barsoum MJ, Bossy-Wetzel E, et al. A Golgi fragmentation pathway in neurodegeneration[J]. Neurobiol Dis, 2008, 29(2): 221-231. DOI:10.1016/j.nbd.2007.08.015 |
| [8] |
Bejarano E, Cabrera M, Vega L, et al. Golgi structural stability and biogenesis depend on associated PKA activity[J]. J Cell Sci, 2006, 119(Pt 18): 3764-3775. |
| [9] |
Song J, Cheon SY, Lee WT, et al. PKA Inhibitor H89(N-[2-p-bromocinnamylamino-ethyl]-5-isoquinolinesulfonamide) Attenuates Synaptic Dysfunction and Neuronal Cell Death following Ischemic Injury[J]. Neural Plast, 2015, 2015: 374520. |
| [10] |
Li K, Ding D, Zhang M. Neuroprotection of Osthole againstCerebral Ischemia/Reperfusion Injury through an Anti-apoptotic Pathway in Rats[J]. Biol Pharm Bull, 2016, 39(3): 336-342. DOI:10.1248/bpb.b15-00699 |
| [11] |
Saad MA, Abdelsalam RM, Kenawy SA, et al. Ischemic preconditioning and postconditioning alleviates hippocampal tissue damage through abrogation of apoptosis modulated by oxidative stress and inflammation during transient global cerebral ischemia-reperfusion in rats[J]. Chem Biol Interact, 2015, 232: 21-29. DOI:10.1016/j.cbi.2015.03.007 |
| [12] |
Palencia G, Medrano Já, Ortiz-Plata A, et al. Anti-apoptotic, anti-oxidant, and anti-inflammatory effects of thalidomide on cerebral ischemia/reperfusioninjury in rats[J]. J Neurol Sci, 2015, 351(1-2): 78-87. DOI:10.1016/j.jns.2015.02.043 |
| [13] |
Hicks SW, Machamer CE. Golgi structure in stress sensing and apoptosis[J]. Biochim Biophys Acta, 2005, 1744: 406-414. DOI:10.1016/j.bbamcr.2005.03.002 |
| [14] |
Hu Z, Zeng L, Xie L, et al. Morphological alteration of Golgi apparatus and subcellular compartmentalization of TGF-beta1 in Golgi apparatus in gerbils following transient forebrain ischemia[J]. Neurochem Res, 2007, 32(11): 1927-1931. DOI:10.1007/s11064-007-9382-1 |
| [15] |
Sundaramoorthy V, Sultana JM, Atkin JD. Golgi fragmentation in amyotrophic lateral sclerosis, an overview of possible triggers and consequences[J]. Front Neurosci, 2015, 9: 400. |
| [16] |
Haase G, Rabouille C. Golgi Fragmentation in ALS Motor Neurons. New Mechanisms Targeting Microtubules, Tethers, and Transport Vesicles[J]. Front Neurosci, 2015, 9: 448. |
| [17] |
Rendón WO, Martínez-Alonso E, Tomás M, et al. Golgi fragmentation is Rab and SNARE dependent in cellular models of Parkinson's disease[J]. Histochem Cell Biol, 2013, 139(5): 671-684. DOI:10.1007/s00418-012-1059-4 |
| [18] |
Coune PG, Bensadoun JC, Aebischer P, et al. Rab1A over-expression prevents Golgi apparatus fragmentation and partially corrects motor deficits in an alpha-synuclein based rat model of Parkinson's disease[J]. J Parkinsons Dis, 2011, 1(4): 373-387. |
| [19] |
Joshi G, Bekier ME 2nd, Wang Y. Golgi fragmentation in Alzheimer's disease[J]. Front Neurosci, 2015, 9: 340. |
| [20] |
Joshi G, Chi Y, Huang Z, et al. Aβ-induced Golgi fragmentation in Alzheimer's disease enhances Aβ production[J]. Proc Natl Acad Sci U S A, 2014, 111(13): E1230-E1239. DOI:10.1073/pnas.1320192111 |
| [21] |
Machamer CE. The Golgi complex in stress and death[J]. Front Neurosci, 2015, 9: 421. |
| [22] |
Li T, You H, Mo X, et al. GOLPH3 Mediated Golgi Stress Response in Modulating N2A Cell Death upon Oxygen-Glucose Deprivation and Reoxygenation Injury[J]. Mol Neurobiol, 2016, 53(2): 1377-1385. DOI:10.1007/s12035-014-9083-0 |
| [23] |
Morgado-Díaz JA, Montesano G, De Souza Fernandes S, et al. Golgi complex disassembly caused by light-activated calphostin C involves MAPK and PKA[J]. Tissue Cell, 2007, 39(3): 161-169. DOI:10.1016/j.tice.2007.03.001 |
| [24] |
Amini E, Nassireslami E, Payandemehr B, et al. Paradoxical role of PKA inhibitor on amyloidβ-induced memory deficit[J]. Physiol Behav, 2015, 149: 76-85. DOI:10.1016/j.physbeh.2015.05.029 |
 2018, Vol. 45
2018, Vol. 45




