扩展功能
文章信息
- 徐凡, 杜荣, 吴长武, 秦超影, 汪浚泉, 肖凯, 刘庆
- XU Fan, DU Rong, WU Changwu, QIN Chaoying, WANG Junquan, XIAO Kai, LIU Qing
- Linc00152在脑胶质瘤中的表达及其与患者临床预后的关系
- Expression of Linc00152 in glioma and its association with prognosis
- 国际神经病学神经外科学杂志, 2018, 45(3): 243-246
- Journal of International Neurology and Neurosurgery, 2018, 45(3): 243-246
-
文章历史
收稿日期: 2018-03-18
修回日期: 2018-05-15
2. 湘潭市中心医院神经外科, 湖南 湘潭 411100
2. Department of Neurosurgery, Xiangtan Central Hospital, Xiangtan 411100, Hunan, China
人脑胶质瘤是神经系统中最常见的原发肿瘤,具有侵袭性,约占原发性恶性脑肿瘤的80%[1]。尽管相关治疗手段(包括手术,放疗和化疗等)发展迅速,但并未大幅度改善脑胶质瘤患者的预后,其中位生存期仅为诊断后约15个月[2]。因此,探讨脑胶质瘤侵袭的分子机制,为发现潜在的治疗靶点提供重要的理论依据,对改善患者预后具有重要意义。
长链非编码RNA(Long intergenic non-coding RNA,lncRNA)是长度超过200个核苷酸的内源性小RNA,其不具有蛋白质编码能力[3]。目前研究显示,lncRNAs与肿瘤发生、发展、转移密切相关[4]。
最近研究发现lncRNAs参与脑胶质瘤的发生和发展[5]。Linc00152为LncRNAs中的成员之一,在多种肿瘤组织中表达上调并可作为诊断和预后的潜在分子标志物;细胞水平研究显示,linc00152可促进细胞增殖、运动,抑制细胞凋亡[6]。新近研究表明,Linc00152在胶质瘤组织和胶质瘤干细胞(glioma stem cells,GSCs)中表达上调[7]。本研究分别检测linc00152在胶质瘤细胞系与肿瘤组织中的表达,分析其与临床病理特征及预后的关系,以探索linc00152在脑胶质瘤中的功能,并探讨其作为脑胶质瘤治疗靶点的可行性。
1 材料和方法 1.1 细胞系和培养人类神经胶质瘤细胞系(SF126,SHG-44,SF767,A172,U87和U251)和正常人星形胶质细胞(NHA)购自于美国模式培养物集存库(Manassas,VA,USA)。用含10%胎牛血清和抗生素(100u/ ml青霉素和100mg / ml链霉素)DMEM培养基在37℃、5% CO2的孵箱中培养。在使用之前,所有细胞系均通过短串联重复DNA(STR)分析进行鉴定,且排除支原体感染。
1.2 人体组织样本收集2013年3月至2017年10月在中南大学湘雅医院神经外科接受外科手术切除并经术后病理组织学检查确诊为脑胶质瘤的73个脑胶质瘤组织和73个癌旁脑组织样本,将新鲜组织浸入RNAlater(Ambion公司)中,立即置于液氮冷冻,并于-80℃保存。性别、年龄、随访和预后等临床数据从医疗记录中获得。本研究获得了所有患者的书面知情同意书及医院伦理委员会的批准。
1.3 RNA提取和qRT-PCR取适量细胞或冻存组织,利用Trizol试剂(Invitrogen,CA,USA)提取总RNA。取1μg总RNA,利用逆转录试剂盒(Thermo Fisher Scientific,MA,USA)合成cDNA,-80℃保存备用。按照SYBR Premix Dimer Eraser(Takara,Dalian,China)说明书配制荧光实时定量PCR反应体系,利用CFX96荧光实时定量PCR检测系统(Bio-Rad,CA,USA)检测靶基因的相对表达水平。通过测量Ct值并使用相对于GAPDH的2-ΔΔct方法进行归一化来量化每个基因的表达。引物序列如下:Linc00152:F:5’-AAAATCACGACTCAGCCCCC-3’;R:5’-AATGGGAAACCGACCAGACC-3’; GAPDH:F:5’-GGGAGCCAAAAGGGTCAT-3’;R: 5’-GTCCTTCCACGATACCAA-3’。
1.4 统计分析所有实验进行三次,数据用SPSS 17.0及GraphPad Prism 5分析。组间分析采用配对t检验;Linc00152表达水平与各病理参数关系分析采用χ2检验分析;Linc00152表达与脑胶质瘤总生存期之间的关系采用Kaplan-Meier法分析;各个协变量的联合效应采用Cox比例风险回归模型分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 Linc00152在脑胶质瘤组织及细胞系中的表达情况我们分别分析了73例脑胶质瘤组织和73例癌旁脑组织中Linc00152的表达情况。如图 1所示,与癌旁脑组织(n=73)相比,在胶质瘤组织(n=73)中Linc00152的表达显着上调(P < 0.001,图 1a)。根据世界卫生组织(WHO)的分类,将胶质瘤样本分为4级,其中Ⅰ级(4例),Ⅱ级(21例),Ⅲ级(25例)和Ⅳ级(23例)。与癌旁组相比,肿瘤组中的Linc00152均显著上调;高级别肿瘤(WHO Ⅲ级和Ⅳ级)中的Linc00152表达显著高于低级别肿瘤(WHO级别Ⅰ和Ⅱ)(P < 0.001,图 1b)。
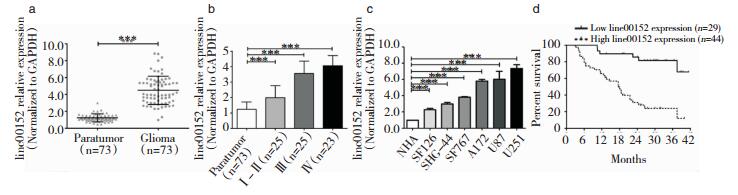
|
| 图 1 Linc00152在胶质瘤组织和细胞系中表达上调,并且与胶质瘤患者的不良预后相关。a.Linc00152在胶质瘤组织(n=73)和癌旁脑组织(n=73)中的相对表达。通过qRT-PCR测定Linc00152的表达,并归一化为GAPDH表达(P < 0.001)。b.通过qRT-PCR在不同病理分级的胶质瘤组织中测定Linc00152的表达水平。c.通过qRT-PCR在正常人星形胶质细胞(NHA)和不同脑胶质瘤细胞系中测量Linc00152表达水平。d.胶质瘤患者的总体生存相对于Linc00152表达水平的Kaplan-Meier曲线。低水平Linc00152表达患者的存活时间显着长于高水平Linc00152表达患者的存活时间。 |
我们对六种神经胶质瘤细胞系(SF126,SHG-44,SF767,A172,U87和U251)和正常人星形胶质细胞(NHA)Linc00152的表达进行分析。与NHA相比,脑胶质瘤细胞系中Linc00152的表达显著升高(P < 0.001,图 1c)。
2.2 Linc00152表达与胶质瘤患者临床病理参数相关性分析根据Linc00152的表达情况,73例神经胶质瘤患者被分为两组:高Linc00152表达组(n=44)和低Linc00152表达组(n=29)。如表 1中所示,高水平的Linc00152表达与临床分级显著相关(P=0.011)。Linc00152表达与年龄、性别、肿瘤大小之间均无统计学相关性。
| 参数 | 例数 | Linc00152 | χ2 | P | |
| 低 | 高 | ||||
| 年龄(岁) | 29 | 44 | |||
| <45 | 42 | 15 (35.7) | 27 (64.3) | 0.665 | 0.415 |
| ≥45 | 31 | 14 (45.2) | 17 (54.8) | ||
| 性别 | |||||
| 女性 | 36 | 13 (36.1) | 23 (63.8) | 0.038 | 0.845 |
| 男性 | 37 | 16 (43.2) | 21(56.8) | ||
| 肿瘤直径(cm) | |||||
| <5 | 39 | 16 (41.0) | 23 (59.0) | 0.059 | 0.808 |
| ≥5 | 34 | 13 (38.2) | 21 (61.8) | ||
| 组织病理学 | |||||
| Ⅰ~Ⅱ级 | 25 | 15 (60.0) | 10 (40.0) | 6.527 | 0.011 |
| Ⅲ~Ⅳ级 | 48 | 14 (29.2) | 34 (70.8) | ||
我们使用Kaplan-Meier分析来评估Linc00152表达对患者总体存活(OS)的影响。结果显示,Linc00152低表达患者的总生存期显著高于高表达者,差异具有统计学意义(p < 0.001,图 1d)。使用COX风险比例回归模型分析73例患者的生存率和病理特征(表 2)。单因素分析显示胶质瘤临床分级(RR=0.383; 95%CI:1.089-5.216)和Linc00152表达(RR=6.131; 95%CI:2.634-14.272)与脑胶质瘤患者预后相关; 多因素分析显示胶质瘤临床分级(RR=3.030; 95%CI:1.185-5.551)和Linc00152表达(HR=3.043; 95%CI:1.231-7.522)是脑胶质瘤患者预后的独立危险因素(见表 2)。
| 变量 | 单因素分析 | 多因素分析 | |||||
| RR | 95%CI | P | RR | 95%CI | P | ||
| 年龄(≤45 vs.>45) | 1.034 | 0.544-1.965 | 0.920 | -- | -- | -- | |
| 性别(男vs.女) | 1.031 | 0.543-1.955 | 0.927 | -- | -- | -- | |
| 组织病理学(Ⅰ-Ⅱ级vs. Ⅲ-Ⅳ级) | 0.383 | 1.089-5.216 | 0.030 | 3.030 | 1.185-5.551 | 0.044 | |
| Linc00152 (低vs.高) | 6.131 | 2.634-14.272 | 0.000 | 3.043 | 1.231-7.522 | 0.016 | |
| P < 0.1.缩写:RR:相对风险,CI:可信区间。 | |||||||
在过去的几十年中,随着测序技术和生物信息学的研究进展,越来越多的非编码RNA被发现并鉴定,目前已经鉴定的lncRNAs有上百个。最近的研究表明,lncRNA异常表达与多种类型肿瘤的发生、发展紧密相关[8-12]。
Linc00152编码828个核苷酸,定位于2p11.2,属基因间lncRNA,位于PAFAH1B1P1和LOC107985796两基因之间。报道显示,Linc00152参与多种肿瘤发生发展过程。Ji J等[13]发现,linc00152通过调控mTOR信号通路靶向EpCAM进而促进肝癌细胞增殖。Linc00152的过表达与肺癌患者不良预后显著相关,分子机制研究表明,linc00152可与EZH2相互作用,抑制IL24表达,进而促进肺腺癌细胞增殖[14-15]。Linc00152在Hela细胞中显著高表达,参与调控细胞周期M的进程,促进细胞有丝分裂[16]。Linc00152还通过结合EZH2,抑制p15和p21表达,参与调控胃癌细胞的细胞周期进程[17]。另外,Linc00152可作为内源竞争性RNA(competing endogenous RNA,ceRNA)增强结直肠癌细胞对奥沙利铂的耐药性[18]。
在本研究中,我们分析了脑胶质瘤组织与细胞系中的Linc00152表达情况,发现Linc00152在胶质瘤组织和胶质瘤细胞系中的表达显着上调。进一步分析发现Linc00152高表达与肿瘤的高级别临床分级显著相关;Linc00152低表达患者总生存期显著高于高表达者;Linc00152表达是胶质瘤患者预后的独立危险因素。
综上所述,Linc00152在脑胶质瘤组织与肿瘤细胞系中表达上调,且与患者肿瘤进展程度和预后显著相关,表明其可能参与脑胶质瘤的发生发展过程。Linc00152的表达可作为胶质瘤患者的独立预后因素,可进一步研究其作为脑胶质瘤治疗的分子靶点的潜在价值。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7-30. DOI:10.3322/caac.v68.1 |
| [2] |
Omuro A, DeAngelis LM. Glioblastoma and other malignant gliomas:A clinical review[J]. JAMA, 2013, 310(17): 1842-1850. DOI:10.1001/jama.2013.280319 |
| [3] |
Huarte M. The emerging role of lncRNAs in cancer[J]. Nat Med, 2015, 21(11): 1253-1261. DOI:10.1038/nm.3981 |
| [4] |
Gomes CC, de Sousa SF, Calin GA, et al. The emerging role of long noncoding RNAs in oral cancer[J]. Oral Surg Oral Med Oral Pathol Oral Radiol, 2017, 123(2): 235-241. DOI:10.1016/j.oooo.2016.10.006 |
| [5] |
Fan C, Tang Y, Wang J, et al. Role of long non-coding RNAs in glucose metabolism in cancer[J]. Mol. Cancer, 2017, 16(1): 130. DOI:10.1186/s12943-017-0699-3 |
| [6] |
Li J, Wang XC, Tang JW, et al. HULC and Linc00152 act as novel biomarkers in predicting diagnosis of hepatocellular carcinoma[J]. Cell Physiol Biochem, 2015, 37(2): 687-696. DOI:10.1159/000430387 |
| [7] |
Yu M, Xue Y, Zheng J, et al. Linc00152 promotes malignant progression of glioma stem cells by regulating miR-103a-3p/FEZF1/CDC25A pathway[J]. Mol Cancer, 2017, 16(1): 110. DOI:10.1186/s12943-017-0677-9 |
| [8] |
Prensner JR, Chinnaiyan AM. The emergence of lncRNAs in cancer biology[J]. Cancer Discov, 2011, 1(5): 391-407. DOI:10.1158/2159-8290.CD-11-0209 |
| [9] |
Hosseini ES, Meryet-Figuiere M, Sabzalipoor H, et al. Dysregulated expression of long noncoding RNAs in gynecologic cancers[J]. Mol Cancer, 2017, 16(1): 107. DOI:10.1186/s12943-017-0671-2 |
| [10] |
Deguchi S, Katsushima K, Hatanaka A, et al. Oncogenic effects of evolutionarily conserved noncoding RNA ECONEXIN on gliomagenesis[J]. Oncogene, 2017, 36: 4629-4640. DOI:10.1038/onc.2017.88 |
| [11] |
Liu C, Sun Y, She X, et al. CASC2c as an unfavorable prognosis factor interacts with miR-101 to mediate astrocytoma tumorigenesis[J]. Cell Death Dis, 2017, 8(3): e2639. DOI:10.1038/cddis.2017.11 |
| [12] |
Wang ZY, Hu M, Dai MH, et al. Upregulation of the long non-coding RNA AFAP1-AS1 affects the proliferation, invasion and survival of tongue squamous cell carcinoma via the Wnt/beta-catenin signaling pathway[J]. Mol Cancer, 2018, 17(1): 3. DOI:10.1186/s12943-017-0752-2 |
| [13] |
Ji J, Tang JW, Deng L, et al. LINC00152 promotes proliferation in hepatocellular carcinoma by targeting EpCAM via the mTOR signaling pathway[J]. Oncotarget, 2015, 6(40): 42813-42824. |
| [14] |
Feng S, Zhang J, Su W, et al. Overexpression of LINC00152 correlates with poor patient survival and knockdown impairs cell proliferation in lung cancer[J]. Sci Rep, 2017, 7(1): 2982-2988. DOI:10.1038/s41598-017-03043-x |
| [15] |
Chen QN, Chen X, Chen ZY, et al. Long intergenic non-coding RNA 00152 promotes lung adenocarcinoma proliferation via interacting with EZH2 and repressing IL24 expression[J]. Mol Cancer, 2017, 16: 17. DOI:10.1186/s12943-017-0581-3 |
| [16] |
Notzold L, Frank L, Gandhi M, et al. The long non-coding RNA LINC00152 is essential for cell cycle progression through mitosis in HeLa cells[J]. Sci Rep, 2017, 7(1): 2265-2271. DOI:10.1038/s41598-017-02357-0 |
| [17] |
Chen WM, Huang MD, Sun DP, et al. Long intergenic non-coding RNA 00152 promotes tumor cell cycle progression by binding to EZH2 and repressing p15 and p21 in gastric cancer[J]. Oncotarget, 2016, 7(9): 9773-9787. |
| [18] |
Yue B, Cai D, Liu C, et al. Linc00152 functions as a competing endogenous RNA to confer oxaliplatin resistance and holds prognostic values in colon cancer[J]. Mol Ther, 2016, 24(12): 2064-2077. DOI:10.1038/mt.2016.180 |
 2018, Vol. 45
2018, Vol. 45




