扩展功能
文章信息
- 廖宇翔, 刘博, 李健, 肖格磊, 廖新斌, 张治平, 赵杰, 刘景平
- LIAO Yu-xiang, LIU Bo, LI Jian, XIAO Ge-lei, LIAO Xin-bin, ZHANG Zhi-ping, ZHAO Jie, LIU Jing-ping
- 髓母细胞瘤复发相关因素分析及治疗方式探讨
- Factors for the recurrence of medulloblastoma and related treatment strategies
- 国际神经病学神经外科学杂志, 2018, 45(3): 234-237
- Journal of International Neurology and Neurosurgery, 2018, 45(3): 234-237
-
文章历史
收稿日期: 2018-03-02
修回日期: 2018-04-26
髓母细胞瘤(Medulloblastoma,MB)是最常见的小儿后颅窝恶性肿瘤,它起源于中枢神经原始神经上皮细胞,属于神经外胚层肿瘤的一种(PNET)。流行病学研究表明其首次发病平均年龄为9岁,且较多见于男性。MB通常因梗阻性脑积水及小脑受损相关的临床表现而被发现,发病之后进展较快且常合并严重神经功能损害乃至危及生命。近几十年来,虽然随着治疗手段的不断进步,手术已经能将大部分的肿瘤做到完全切除,总体疗效有了显著改善。但术后肿瘤局部复发、异位转移,或沿脑脊液播散性种植等仍难以避免,一旦出现以上事件,则整体预后十分不理想[1]。
本文回顾性分析了我院神经外科自2012年2月至2014年8月收治并且得到完整随访记录的39例髓母细胞瘤患者的临床资料,初步探讨影响MB患者肿瘤复发的相关因素。并对如何提高MB患者治疗效果进行了探讨。
1 临床资料与方法 1.1 一般资料2012年2月至2014年8月,我院神经外科收治并经病理学确诊为髓母细胞瘤的患者共115例,选取有完整随访信息的患者共39例进行回顾性研究。其中,男性25例,占64.1%;女性14例,占35.9%;患者年龄最小为1岁,最大41岁,平均年龄12.8岁,将所有患者年龄以14岁为界,分为大龄组(12例),及低龄组(27例)。
1.2 临床及影像学表现患者主要首发症状(含伴发)包括:头痛(28例)、恶心(16例)、呕吐(12例)、视物模糊(5例)等颅高压表现,另有行走不稳(19例)、平衡性差(12例)等小脑功能失调表现。大部分患者为急性起病,且病情进展较快,至入院就诊时,平均病程为3.8月。术前影像学检查显示病变所在部位:小脑蚓部28例,小脑半球10例,脑干1例,均为单发。术前均已经影像学检查排除了肿瘤远处转移的可能。
1.3 治疗方式所有患者均由我院神经外科高年资医生行开颅手术治疗。术后病理确诊后,均明确向患者家属建议尽早行术后放射治疗或化疗。39例患者中有15例患者仅行开颅手术治疗,24例患者进行了术后放疗及化疗。随访显示患者开始放疗的时间在术后2周至1月左右,采用的方式主要有全脑+脊髓放疗、全脑+后颅窝放疗,及后颅窝病灶加强照射。推荐的放疗剂量案为:全脑全脊髓放疗36Gy;病灶局部加强18Gy。化疗药物有替莫唑胺、顺铂、司莫司汀、长春新碱、尼妥珠单抗靶向治疗等。因不同患者的放化疗方案、时间均不统一,难以将其分类比较,故不纳入讨论。
1.4 随访情况采用门诊、电话方式进行随访,记录患者的检查结果、诊疗过程、一般情况等。以患者首次开颅手术当天为起点。将术后首次发现肿瘤复发、播散种植、转移或死亡定义为终点事件。将起点至终点事件之间的时间定义为无进展生存期(Event-Free-Survival, EFS)。对于未发生上述终点事件的患者以2017年12月的末次随访时间为终点。
1.5 统计学方法所有数据均采用SPSS 19统计学软件进行数据分析。使用Kaplan-Meier法进行EFS计算并绘制生存曲线;使用Log-Rank test对不同因素等对EFS的影响进行单因素分析,P<0.05认为有统计学意义;最后采用COX回归多因素模型分析,研究各因素是否独立地对EFS存在影响。确定影响髓母细胞瘤复发的临床因素。
2 结果 2.1 治疗情况所有患者均经我院神经外科高年资医生行开颅手术治疗,病变均在显微镜下行全部切除,或在尽量保留神经功能的情况下行大部分切除。所有患者未出现严重的手术相关并发症,术后恢复情况良好。其中15例患者仅行手术治疗,24例患者行手术后放化疗或单纯行放疗、化疗。
2.2 根据随访结果截止2017年12月,全部39例患者中有37例已观察到终点事件,均为肿瘤原位复发、播散或转移。按复发部位(含多发):原位复发23例,颅内异位转移12例,椎管内播散转移5例,神经系统外转移2例。所有患者总体无进展生存期(EFS)均值为20.5月,中位数为16.0月;仅手术治疗组EFS均值为9.7月,中位数为6.0月;手术+放化疗组EFS均值为27.8月,中位数为21.0月。
2.3 Kaplan-Meier单因素分析我们将可能对髓母细胞瘤预后有影响的因素,包括性别、年龄、肿瘤位置、治疗方式等分组纳入单因素分析,Log-Rank test法提示行手术+放化疗组患者的EFS明显长于仅行手术组患者;大龄组患者的EFS明显高于低龄组。差异均有统计学意义(P<0.05)。而肿瘤首发部位、性别、首发症状等对EFS没有显著影响。见图 1、2,表 1。
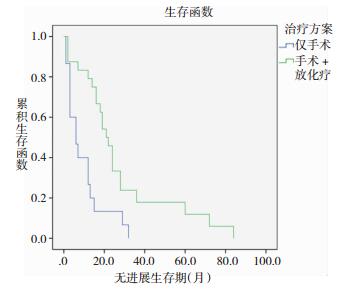
|
| 图 1 不同治疗方式对患者EFS的影响 |
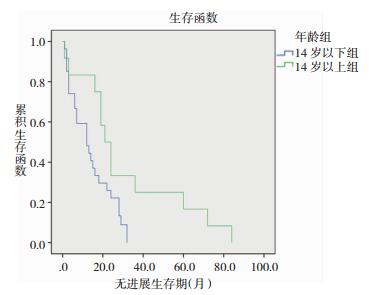
|
| 图 2 年龄对患者的EFS的影响 |
| 临床因素 | 组别 | 患者例数 | EFS中位时间(月) | P值 | 结论 |
| 治疗方式 | 仅手术 | 15 | 6.0±2.6 | 0.002 | 两组差异有统计学意义 |
| 手术+放化疗 | 24 | 21.0±2.1 | |||
| 年龄组 | 14岁以下 | 27 | 12.0±3.9 | 0.031 | 两组差异有统计学意义 |
| 14岁以上 | 12 | 21.0±2.9 |
将单因素分析中对髓母细胞瘤预后有显著影响的因素,纳入COX回归分析,提示治疗方式是髓母细胞瘤患者EFS的独立影响因素;而年龄因素对EFS的影响无统计学意义,说明患者年龄不是影响髓母细胞瘤预后的独立因素,年龄因素可能与其他因素存在平行关系。见表 2。
| 临床因素 | B | SE | Wald | df | Sig. | Exp(B) | 结论 |
| 治疗方式 | 0.845 | 0.408 | 4.291 | 1 | 0.038 | 2.329 | 有独立影响 |
| 年龄组 | 0.471 | 0.466 | 1.019 | 1 | 0.313 | 1.601 | 无独立影响 |
髓母细胞瘤是一种最为常见的小儿颅内恶性肿瘤,世界卫生组织WHO(2016)中枢神经系统肿瘤分类将髓母细胞瘤归类为Ⅳ级肿瘤。其总体治疗效果不佳,长期生存率低下,一直困扰着国内外神经外科学界。有些患者术后虽然获得了较长的生存时间,但也因疾病本身或手术并发症以及治疗副作用的困扰使得生存质量不高,包括长时间的残疾、内分泌紊乱和认知功能损害等[2]。又因髓母细胞瘤的恶性生物学行为,到目前为止,其复发仍无法避免,虽然在目前的治疗方式下,髓母细胞瘤相较于其他颅内恶性肿瘤如高级别胶质瘤等,有着相对更长的总生存时间(Overall Survival, OS),但髓母细胞瘤复发形式多样,可颅内复发,亦可播散至脊髓甚至神经系统以外,且一旦复发,疾病便已难以再得到有效控制,患者则进入疾病临终期。因此,在尽可能完整切除肿瘤的基础上,及时给予其他辅助治疗,遏制肿瘤复发、播撒种植,延长患者的无进展生存期显得尤为重要。
基于以上原因,我们认为无进展生存期(EFS)相较于总生存时间(OS)能更客观、准确地反映髓母细胞瘤患者的预后情况。我们此次的研究表明,髓母细胞瘤手术后的EFS与治疗策略的选择有着直接的关系,采用手术+放化疗的治疗模式使患者EFS明显好于仅手术患者。进一步印证了以手术为基础结合术后放化疗的综合治疗对治疗髓母细胞瘤的重要性。但我们的研究中仍有一部分患者并未选择进行术后放化疗,这一方面与患者及家属对待恶性肿瘤的消极态度有关,另外也说明目前髓母细胞瘤的整体治疗效果还有待进一步提高。
外科手术作为治疗颅内MB的首选,对改善患者临床症状有明确的效果,肿瘤的切除程度与预后存在正相关性,但术中亦应强调保护患者神经功能[3]。对于手术后续治疗方案的选择,依然存在不同的意见[4]。目前主流的治疗措施是手术+全脑脊髓放射治疗(CSI)+辅助化疗为主的综合治疗,相较于单纯手术可以明显提高患者整体疗效[5],这与我们的研究结论相一致。国外研究报道选择的放疗剂量一般在25~45Gy之间不等,后颅窝放疗剂量一般超过50Gy。亦有研究表明,选择加速超分割放射治疗(Hyperfractionated Accelerated Radiotherapy)较常规放疗可获得更好的生存质量和预后[6]。而对于儿童患者,特别是3岁以下儿童,因其脑组织发育尚未完善,一般建议选择先行小剂量放疗或单纯化学治疗。综合多项研究结果表明,小儿患者总体预后较成人患者更差[7, 8]。这一点与我们的研究中单因素分析结果类似。一方面可能因小儿髓母细胞瘤病理分型不同于更年长的患者,另外则可能因延迟放疗导致肿瘤迅速复发[8]。因此,髓母细胞瘤术后只要伤口愈合良好,无其他禁忌,即应尽早开始放疗。
辅助性化疗的意义在于进一步提高术后患者的生存质量,减少放射治疗剂量及其副作用,以及作为肿瘤复发患者失去手术机会时的一种姑息性治疗。一项综合了多个临床研究共1080例患者的Meta分析指出放射治疗的益处仅在根据患者不同情况进行综合治疗的背景下才得以体现,而并不能简单的认为辅助性放疗能使患者受益。这项研究亦指出,放疗前化疗或放疗后放疗对患者预后并无明显影响[9]。化疗的另外一个问题是副作用,包括骨髓抑制反应,胃肠道反应,神经毒性反应等多种副反应,使得患者术后生存质量不高。随着对肿瘤分子生物学特性的研究,未来更倾向于根据髓母细胞瘤的分子分型,基于特定的信号通路,来选择合适的靶向治疗药物进行治疗。目前研究得较为充分的有平滑受体拮抗剂(smoothened receptor antagonists)如vismodegib,这种药物已在临床前试验及Ⅰ期临床试验中被证明对髓母细胞瘤有明确抑制作用[10]。如同其他很多人类恶性肿瘤一样,髓母细胞瘤未来的药物治疗方向将是基于肿瘤不同分子分型的个体化用药。
综上所述,对于髓母细胞瘤,目前最佳的治疗方案是尽早行手术全切,术后伤口愈合即开始行放化疗,但因髓母细胞瘤在中枢神经肿瘤中仍属相对少见,关于影响其预后因素的研究还不够充分。近年来,众多神经外科及肿瘤科同行致力于优化放、化疗方案使患者获得更好的预后,取得了可喜的进展。但即便经过积极的综合治疗,有一部分患者治疗效果仍不理想。不过令人兴奋的是,随着对髓母细胞瘤病理及分子生物学研究的进展,分子靶向治疗已经成为控制肿瘤发生发展的突破口。另外,除了延长患者的无进展生存期,未来也应更加关注如何减轻治疗的副作用,努力提高患者的生存质量。
| [1] |
Bautista F, Fioravantti V, de Rojas T, et al. Medulloblastoma in children and adolescents:a systematic review of contemporary phase Ⅰ and Ⅱ clinical trials and biology update[J]. Cancer Med, 2017, 6(11): 2606-2624. DOI:10.1002/cam4.2017.6.issue-11 |
| [2] |
Rusert J M, Wu X, Eberhart C G, et al. SnapShot:Medulloblastoma[J]. Cancer Cell, 2014, 26(6): 940. DOI:10.1016/j.ccell.2014.11.015 |
| [3] |
Khalil EM. Treatment results of adults and children with medulloblastoma NCI, Cairo University experience[J]. J Egypt Natl Canc Inst, 2008, 20(2): 175-186. |
| [4] |
林瑜亮, 孙红军, 荔志云. 不同联合放化疗方式对儿童髓母细胞瘤疗效的系统评价[J]. 国际神经病学神经外科学杂志, 2016, 43(1): 1-7. |
| [5] |
De B, Beal K, De Braganca KC, et al. Long-term outcomes of adult medulloblastoma patients treated with radiotherapy[J]. J Neurooncol, 2018, 136(1): 95-104. DOI:10.1007/s11060-017-2627-1 |
| [6] |
Veneroni L, Boschetti L, Barretta F, et al. Quality of life in long-term survivors treated for metastatic medulloblastoma with a hyperfractionated accelerated radiotherapy (HART) strategy[J]. Childs Nerv Syst, 2017, 33(11): 1969-1976. DOI:10.1007/s00381-017-3548-1 |
| [7] |
Kann BH, Park HS, Lester-Coll NH, et al. Postoperative Radiotherapy Patterns of Care and Survival Implications for Medulloblastoma in Young Children[J]. JAMA Oncol, 2016, 2(12): 1574-1581. DOI:10.1001/jamaoncol.2016.2547 |
| [8] |
Hudson TJ. Genome variation and personalized cancer medicine[J]. J Intern Med, 2013, 274(5): 440-450. DOI:10.1111/joim.2013.274.issue-5 |
| [9] |
Michiels EM, Schouten-Van Meeteren AY, Doz F, et al. Chemotherapy for children with medulloblastoma[J]. Cochrane Database Syst Rev, 2015, 1: D6678. |
| [10] |
Srinivasan VM, Ghali MG, North RY, et al. Modern management of medulloblastoma:Molecular classification, outcomes, and the role of surgery[J]. Surg Neurol Int, 2016, 7(Suppl 44): S1135-S1141. |
 2018, Vol. 45
2018, Vol. 45




