扩展功能
文章信息
- 何永跃, 刘洛同, 董程远, 李祥龙, 韩吉中, 刘亮, 陈礼刚
- HE Yong-Yue, LIU Luo-Tong, DONG Cheng-Yuan, LI Xiang-Long, HAN Ji-Zhong, LIU Liang, CHEN Li-Gang
- 两种手术方法治疗慢性硬膜下血肿伴急性出血的效果分析
- Clinical effect of two surgical methods in treatment of chronic subdural hematoma with acute hemorrhage
- 国际神经病学神经外科学杂志, 2018, 45(2): 143-146
- Journal of International Neurology and Neurosurgery, 2018, 45(2): 143-146
-
文章历史
收稿日期: 2017-12-15
修回日期: 2018-01-23
慢性硬膜下血肿(chronic subdural hematoma, CSDH)急性出血是指硬脑膜与蛛网膜之间的慢性血肿伴发急性出血,多考虑因血肿壁层包膜与硬膜间连接血管急性破裂所致,CT上可见高密度的新鲜出血和较低密度的陈旧性血肿。CSDH一旦并发急性出血,可造成患者颅内压急剧升高,有报道[1]称CSDH伴发急性出血是患者意识障碍的独立危险因素。我院2008年5月至2017年8月间,共收治CSDH伴发急性出血患者47例,其中24例采用钻孔释放陈旧性血液缓解颅内压力并适当冲洗,在术腔内靠近急性血肿区域放置硅胶管持续引流。23例患者实施开颅硬膜下血肿清除手术治疗,回顾性分析两种术式患者的术腔持续引流时间、住院日、术后1个月残余血肿量、3个月随访复发例数等临床随访资料,总结经验并报道如下。
1 资料与方法 1.1 临床资料47例CSDH伴急性出血患者中男27例,女20例;年龄52~78岁,平均(63.4±8.3)岁,患者入院前均有外伤史;伤后未引起重视者38例,9例伤后立即到医院查头颅CT提示未见明显异常;其中血肿位于右侧22例,左侧25例。入院Markwalder’s CSDH神经功能障碍分级0级0例,Ⅰ级23例,Ⅱ级17例,Ⅲ级7例;所有患者行头颅CT提示硬膜下大面积新月形低密度影内含不同程度高密度区域,脑组织受压中线移位。排除标准:(1)伴有其他疾病或手术不耐受患者(2)两侧均有血肿患者(3)CSDH复发患者(4)头颅CT提示CSDH无伴发急性出血患者(5)近期口服抗凝药患者。
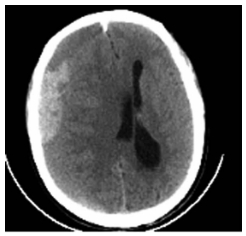
1.2 影像学资料本组影像学资料均来源于西南医科大学附属医院影像科,证实均为CSDH患者突发急性出血,头颅CT均提示患者单侧硬膜下大面积新月形低密度影、等密度影或稍高密度影,内含有体积不等高密度区域,脑组织受压脑室变小,中线移位。CT下CSDH伴急性出血形态学信息包括:血肿呈新月形,与脑组织密度相比可呈低密度影、等密度影或稍高密度影,无脑沟脑回等结构,内包含高密度区域提示新近出血,中线结构有不同程度偏移(如图 1)。
|
| 图 1 CSDH伴发急性出血患者头颅CT,高密度区域为新鲜出血,右侧侧脑室明显受压,中线向左偏移。 |
所有入院患者均急诊完善凝血功能、血常规等检查。23例患者采用开颅清除血肿,根据头颅CT对血肿定量、定位,设计骨窗范围,全麻下行开颅硬膜下血肿清除术。术中见:血肿分两部分,陈旧性血肿液化良好,剪开硬膜时顺切口溢出;急性出血形成血肿呈暗红色胶冻状,与血肿包膜连接紧密,予以清除并切除包膜组织。24例患者采用颅骨钻孔、术腔植入硅胶管持续引流,选择血肿最厚层面,头皮切口3~4 cm,颅骨骨孔直径约1.5 cm,“十”字切开硬膜,缓慢释放大量陈旧性血肿,降低颅内压力,基本解除血肿对脑组织压迫,空针抽取生理盐水,通过硅胶管向血肿腔各个方向冲洗,直至冲洗液基本清亮,血肿腔置硅胶管引流,末端靠近急性出血区域,术后持续低位引流。
1.4 随访本组数据按时随访患者共44例,影像学随访包括患者在术后1月、3月复查头颅CT,采用改良多田公式计算患者颅内残余血肿吸收情况,有无血肿再次复发;术后1周、1月、3月采用Markwalder’s CSDH评估患者预后。
2 结果 2.1 术后影像学结果根据患者术后复查CT影像,开颅患者硬膜下血肿清除较满意,术腔极少血肿,可见脑组织复张良好,骨窗周围骨质不连续;钻孔引流患者术腔仍可见高密度血肿,脑组织轻度受压,钻孔处较小骨质缺损。
2.2 术后临床随访结果 2.2.1 患者Markwalder’s CSDH神经功能障碍分级随访结果本组患者共47例,统计按时随访44例患者术前,术后1周、1月、3月Markwalder’s CSDH神经功能障碍分级如表 1。
| 手术方式 | 术前 | 术后1周 | 术后1月 | 术后3月 | |||||||||||||||
| 0 | Ⅰ | Ⅱ | Ⅲ | 0 | Ⅰ | Ⅱ | Ⅲ | 0 | Ⅰ | Ⅱ | Ⅲ | 0 | Ⅰ | Ⅱ | Ⅲ | ||||
| 开颅 | 2 | 12 | 5 | 2 | 10 | 7 | 3 | 1 | 17 | 3 | 1 | 0 | 20 | 1 | 0 | 0 | |||
| 钻孔 | 5 | 13 | 4 | 1 | 15 | 6 | 2 | 0 | 19 | 2 | 1 | 1 | 20 | 1 | 2 | 0 | |||
根据术后Markwalder’s CSDH神经功能障碍分级提示大多数患者,不论采取开颅血肿清除还是钻孔术腔持续引流,患者总体预后均较好,钻孔患者术后3月分级中有大于Ⅱ级者提示可能为复发,完善颅脑CT证实为复发患者。
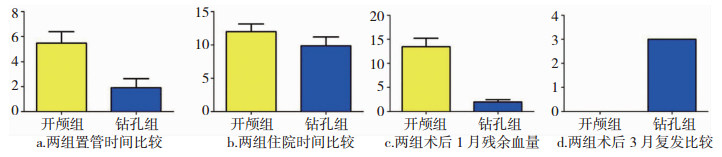
2.2.2 对引流时间、住院日、术后1月残余血肿量、3月随访复发例数统计学分析结果分别对按时随访患者术后引流时间、住院日、术后1月残余血肿量、3月随访复发例数选择SPSS 22.0系统软件作为本文统计分析资料;进行结果检验时采用χ2进行相关分析(如表 1);有统计学意义时的表示方法为P<0.05;(计量资料以x±s表示)是计量资料的表示方法,进行结果检验时采用t进行相关分析(如图 2)。
|
| 图 2 两组手术方式患者置管时间、住院时间、1月残血量、3月复发例数比较。 |
| 组别 | 例数 | 置管时间/天 | 住院时间/天 | 术后1月残余血肿量/ml | 3月随访复发例数 |
| 开颅组 | 21 | 1.9±0.7 | 10.8±1.3 | 2.0±0.5 | 0 |
| 钻孔组 | 23 | 5.5±0.9 | 11.2±1.2 | 13.4±1.8 | 3 |
| t | 14.19 | 5.61 | 29.95 | 5.23 | |
| P | <0.05 | 0.05 | <0.05 | <0.05 |
术后两组患者除平均住院日(P>0.05)无统计学意义外,引流时间、术后1月残血、3月内复发例数等均有统计学意义(P < 0.05)。该临床结果提示慢性硬膜下血肿伴发急性出血患者采用开颅清除血肿手术优于钻孔术腔持续引流。
3 讨论慢性硬膜下血肿急性出血目前多认为是硬脑膜与包膜壁层连接血管破裂出血所致[2],Tanaka等[3]已经证实进入血肿包膜的连接血管来自硬脑膜,笔者检索国内外学者对单纯CSDH治疗方式的相关报道,考虑整体疗效、住院时间、治疗费用等因素,采用单纯钻孔引流仍是治疗首选[4],Van Der Veken等对比开颅清除血肿与单纯钻孔总结出前者术中暴露更好,术后复发率低等优点,在并发症方面二者无明显差异[5],对于CSDH伴发急性出血患者,颅内出血量迅速增加,出血侧压力增高,导致中线移位增大,有报道[6, 7]称中线移位大于1cm增加血肿复发几率,然而急性出血是否与复发相关尚缺乏直接证据。采用开颅清除血肿,术中完全暴露血肿腔,陈旧性血液引流更彻底,较大血凝块清除等可更快解除脑组织压迫,患者症状缓解快,术中视野暴露范围较广,有利于查找出血点止血,术中去除包膜组织,闭塞硬膜与壁层包膜之间新生血管,可大大降低再次出血风险,降低复发率[5]等,Kayaci等[8]研究表明,血肿内膜剥离后同样有利于脑组织复张,气颅发生明显减少,降低术后复发可能,术后复查颅脑CT,若脑组织复张良好,早期拔除引流管,可降低颅内感染风险。然而采用开颅血肿清除缺点在于患者需采用全身麻醉,住院费用较高、手术创面较钻孔更大等。由于CSDH患者慢性出血时间相对较长,一般形成时间在3周以上,故脑组织受压缓慢加重,脑组织适应并耐受,即使伴发急性出血,亦少有明显脑疝表现,加上钻孔引流可以释放大部分陈旧性不凝血,能够明显解除血肿占位效应,因此钻孔术腔持续引流对于此类患者也是非常安全的术式,术中生理盐水反复冲洗,可基本引流出液化良好的血液,后期较长时间保留引流管,对急性出血亦能起到一定引流效果,若拔管后残存少量血肿,自身亦能液化吸收;单采用传统钻孔引流,其缺陷在于:术腔血凝块难以完全清除,难以切除血肿包膜组织,术后引流管放置时间较长,增加颅内感染风险,患者置管期间需卧床,易并发肺部感染、深静脉血栓等,患者脑组织持续受压,术腔残血存在,反复刺激脑组织,患者头昏、头痛症状缓解慢,甚至诱发癫痫等。
综上,开颅清除CSDH伴急性出血整体效果明显优于钻孔持续引流术,其具有术后引流时间短,远期恢复良好,包括术后脑组织复张良好、颅内残留血肿吸收更快、并发症低等优点。还有报道称术后中线长时间偏向健侧,脑组织复张差,可能增加复发风险[9]。笔者认为,采用开颅清除血肿为患者带来更多益处,可作为慢性硬膜下血肿伴急性出血的首选治疗方式。
| [1] |
Honda Y, Sorimachi T, Momose H, et al. Mitsunori Matsumae Chronic subdural haematoma associated with disturbance of consciousness:significance of acute-on-chronic subdural haematoma[J]. Neurol Res, 2015, 37(11): 985-992. DOI:10.1179/1743132815Y.0000000083 |
| [2] |
刘永刚, 林贵军, 高峰. 慢性硬膜下血肿发病机制与治疗进展[J]. 国际神经病学神经外科学杂志, 2007, 34(3): 233-236. |
| [3] |
Tanaka T, Kaimori M. Histological study of vascular structure between the dura mater and the outer membrane in chronic subdural hematoma in an adult[J]. No Shinkei Geka, 1999, 27(5): 431-436. |
| [4] |
Regan JM, Worley E, Shelburne C, et al. Burr hole washout versus craniotomy for chronic subdural hematoma:patient outcome and cost analysis[J]. PLoS One, 2015, 10(1): e0115085. DOI:10.1371/journal.pone.0115085 |
| [5] |
Van Der Veken J, Duerinck J, Buyl R, et al. Mini-craniotomy as the primary surgical intervention for the treatment of chronic subdural hematoma-a retrospective analysis[J]. Acta Neurochir (Wien), 2014, 156(5): 981-987. DOI:10.1007/s00701-014-2042-8 |
| [6] |
Jung YG, Jung NY, Kim EL, et al. Independent predictors for recurrence of chronic subdural hematoma[J]. J Korean Neurosurg Soc, 2015, 57(4): 262-270. |
| [7] |
黄冠又, 张欣, 明悦, 等. 影响慢性硬膜下血肿钻孔引流术后复发的因素分析[J]. 国际神经病学神经外科学杂志, 2016, 43(2): 124-127. |
| [8] |
Kayaci S, Kanat A, Koksal V, et al. Effect of inner membrane tearing in the treatment of adult chronic subdural hematoma:a comparative study[J]. Neurol Med Chir (Tokyo), 2014, 54(5): 363-373. DOI:10.2176/nmc.oa.2013-0147 |
| [9] |
Staniši'c M, Hald J, Rasmussen IA, et al. Volume and densities of chronic subdural haematoma obtained from CT imaging as predictors of postoperative recurrence:a prospective study of 107 operated patients[J]. Acta Neurochir (Wien), 2013, 155(2): 323-333. DOI:10.1007/s00701-012-1565-0 |
 2018, Vol. 45
2018, Vol. 45




