扩展功能
文章信息
- 王瑞, 李玉, 王波, 马继龙, 哏二所凹, 王崇谦
- WANG Rui, LI Yu, WANG Bo, MA Ji-Long, Gen-Er-Suo-Ao, WANG Chong-Qian
- β-羟基丁酸对糖氧剥夺原代神经元的保护作用及其机制研究
- Protective effect of β-hydroxybutyrate on primary neurons with glucose-oxygen deprivation and related mechanism
- 国际神经病学神经外科学杂志, 2018, 45(1): 58-64
- Journal of International Neurology and Neurosurgery, 2018, 45(1): 58-64
-
文章历史
收稿日期: 2017-10-10
修回日期: 2018-01-09
2. 昆明医科大学第一附属医院, 云南省 昆明市 650000
在缺血性脑卒中发生过程中,缺血组织的氧化应激反应会引起神经元DNA损伤,引起基因功能缺失,进一步引起胶质细胞和血管细胞的凋亡发生[1]。氧化应激导致的神经元损伤和血脑屏障功能障碍是脑卒中治疗的难点[2],在大脑中,乙酰乙酸和β-羟基丁酸(β-hydroxybutyric, BHB)可代替葡萄糖为大脑提供能量[3],也有研究表明β-羟丁酸可减轻多巴胺能神经元的变性并可改善线粒体呼吸功能[4]。通过综合国内外研究,BHB的脑保护作用机制仍不明确,基于此我们进行体外神经元细胞培养,并制作糖氧剥夺细胞模型,不同浓度BHB预处理后观察神经元细胞活力变化和线粒体氧化应激损伤情况,探讨BHB发挥神经保护作用的机制。
1 材料与方法 1.1 材料 1.1.1 实验动物孕28 d的SD大鼠,雌性,购自昆明医科大学实验动物中心,清洁级SPF实验动物室饲养,通风良好,循环光照,给予清洁饲料与饮水。
1.1.2 主要试剂与仪器BHB(上海基实有限公司);Neurobasal-A培养基、B27和澳洲源胎牛血清(gibco);EGF重组蛋白(peprotech);阿糖胞苷(sigma);CCK8试剂(同仁化学);MitoSOX Red探针(thermo);PBS缓冲液和HBSS缓冲液(gibco);Trizol试剂(thermo);cDNA合成试剂盒(Fermentas);QPCR试剂盒(SYBR FAST qPCR Master Mix,Kapa);引物合成(invitrogen);β-actin抗体、ERK1/2抗体、NSE抗体和p-erk1/2(T202/204)抗体(CST);SMCT1抗体、cytochrome-c抗体和active-caspase3抗体(abcam);Dylight 488标记二抗(jackson Immuno);DAPI荧光封片剂(中杉);二抗(abmart);HRP底物显色试剂盒(millipore);细胞培养级DMSO(sigma)。
显微手术器械(上海金钟);体式显微镜(olympus);三气培养箱(Healforce);全波长酶标仪(molecular device);QPCR仪(ABI Stepone);化学发光仪(Bio-Rad);荧光显微镜(Olympus)。
1.2 方法 1.2.1 神经元培养戊巴比妥钠溶液(30 mg/kg)腹腔注射麻醉孕鼠,75%乙醇消毒腹部,超净台中腹正中切口暴露双侧子宫,取胎鼠,体式显微镜下取皮质放入无菌PBS液,吹打3~5次制成单细胞悬液,200目细胞筛过滤,800 rpm离心3 min,完全培养基(Neurobasal-A medium+2% B27+10 ng/ml EGF+10% FBS)重悬后接种至包被多聚赖氨酸孔板中,48 h后加5 μg/ml阿糖胞苷培养24 h,换液为完全培养基培养。
1.2.2 神经元染色鉴定实验细胞接种至24孔爬片(3孔重复),生长第11 d,75%乙醇固定,室温1 h。PBS洗涤2次,0.3% TritonX-100透化15 min,PBS洗涤2次,加NSE抗体(1 :200)孵育过夜,PBS洗涤3次,加Dylight 488标记的二抗(1 :2000)室温避光孵育1 h,PBS避光洗涤2次,DAPI荧光封片剂封片,荧光显微镜观察细胞着色情况。
1.2.3 不同浓度BHB对神经元活力的影响(CCK8实验)细胞接种至96孔板,生长第10 d,分组(每组3孔重复):正常组(Blank),Blank+不同浓度(2 mM、5 mM、10 mM、20 mM和50 mM)BHB作用24 h组,以观察梯度浓度BHB对神经元的毒性作用,24 h后,每孔加10 μlCCK8溶液,培养箱孵育2 h,酶标仪450 nm波长测OD值。
1.2.4 实验分组及缺氧实验 1.2.4.1 实验分组① Blank组不做处理,正常培养;②单纯缺氧组在细胞生长对数期,培养基换为Neurobasal-A基础培养基(不含B27和EGF等营养因子),适应性培养1 h;③2 mM BHB预处理24 h+缺氧组;④5 mM BHB预处理24 h+缺氧组;⑤10 mM BHB预处理24 h+缺氧组。③、④和⑤组在细胞生长对数期,换液为含对应浓度BHB的完全培养基作用24 h后,换液为含对应浓度BHB的Neurobasal-A培养基培养1 h。将细胞放入三气培养箱(气体组成:2%O2+5%CO2+93%N2)缺氧培养2 h。
1.2.4.2 缺氧实验及线粒体超氧化物检测细胞缺氧培养2 h后行线粒体超氧化物检测(Mitosox Red探针):各组缺氧培养后(正常组除外),避光,超净台HBSS缓冲液洗涤2次,加Mitosox Red探针,37℃培养箱孵育10 min;避光,HBSS缓冲液洗涤3次;倒置荧光显微镜观察细胞红色荧光(各孔均一化曝光时间),获取图像用Image Pro Plus 6.0软件行荧光强度测定。
1.2.4.3 CCK8实验各组细胞每孔加10 μl CCK8溶液,培养箱孵育2 h,酶标仪450 nm波长测OD值。
1.2.4.4 QPCR实验各组细胞用Trizol法提取总RNA,分光光度计测各组RNA浓度,总RNA上样量1 μg,cDNA合成试剂盒合成cDNA第一条链,QPCR试剂盒进行QPCR反应,反应体系10 μl:上游引物0.5 μl,下游引物0.5 μl,Master mix 5 μl,模板cDNA 1 μl,去核酸水3 μl。反应条件:95℃ 3 min;95℃ 3 s,60℃ 30 s进行40个循环;溶解曲线分析:95℃:15 s;60℃:30 s;95℃:15 s。反应后收集Ct值行2-△△Ct值分析。
1.2.4.5 Western Blot实验各组细胞PBS洗涤2次,吸弃液体,加预冷RIPA裂解液提取总蛋白。BCA法测蛋白浓度。沸水加热变性,取80 μg蛋白上样、电泳,转膜。5% BSA封闭2 h,TBS溶液洗膜3次,每次5 min。加抗体:β-actin(ACTB,1 :2000)、SMCT1(1 :500)、cytochrome-c(1 :500)、active-caspase3(1 :2000)、ERK1/2(1 :1000)和phospho-ERK1/2(1 :1000),4℃孵育过夜,TBST溶液漂洗5次,每次5 min。加HRP标记的二抗,37℃孵育1 h,TBST溶液洗膜3次,每次5 min。HRP底物显色试剂盒进行显影,化学发光仪扫描PVDF膜,得蛋白条带用Image J软件分析灰度值,以与内参β-actin条带灰度值比值作为蛋白表达量数据,其中ERK1/2蛋白磷酸化计算方法:p-ERK1/2蛋白表达量/ERK1/2蛋白表达量,此比值为磷酸化水平数据。
1.3 统计学分析每组均5孔重复,所得数据SPSS 18.0统计软件包处理,计量资料以均数±标准差(x±s)表示,多组数据比较以单因素方差分析(one-way ANOVA)检验,P < 0.05为差异有统计学意义。
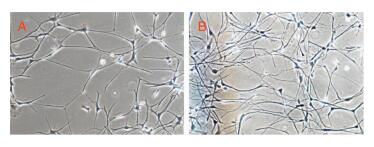
2 结果 2.1 神经元培养与鉴定神经元生长第8天(图 1A),典型样生长,胞体透亮,胞体两侧有长轴突伸出,呈网状;第11天,神经元细胞生长至对数期(图 1B)。
|
| 图 1 大鼠神经元原代培养(100×) 注:A:神经元生长第8天;B:神经元生长第11天。 |
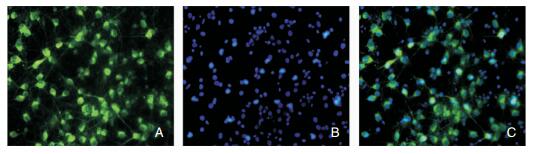
神经元生长第11天,细胞固定后行神经元标记物(NSE)荧光染色,图 2可见NSE抗体染色阳性,说明培养细胞为神经元。
|
| 图 2 大鼠神经元细胞鉴定染色(100×) 注:A:NSE染色;B:DAPI染色;C:Merged。 |
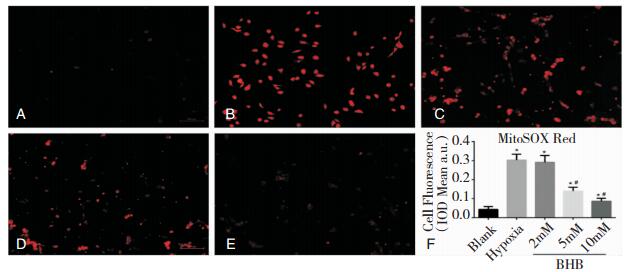
Blank组(图 3A和图 3F)线粒体超氧化物几乎未见,说明细胞状态良好。糖氧剥夺2 h后(图 3B),线粒体超氧化物检测阳性细胞数急剧增加,与Blank组比有显著差异(图 3F)。在BHB预处理后再进行糖氧剥夺处理,与缺氧组比,2 mM浓度BHB(图 3C和图 3F)对缺氧细胞无明显影响(P>0.05);BHB在5 mM浓度(图 3D和图 3F)和10 mM浓度(图 3E和图 3F)时显著降低缺氧细胞中线粒体超氧化物生成(P < 0.05);相比5 mM浓度,10 mM浓度BHB抗线粒体氧化作用更强(P < 0.05)。
|
| 图 3 各组神经元Mitosox Red探针染色图(100×) 注:A:Blank组;B:单纯缺氧组;C:2 mM BHB预处理24 h+缺氧组;D:5 mM BHB预处理24 h+缺氧组;E:10 mM BHB预处理24 h+缺氧组;*:与Blank组比较,P < 0.05;#:与单纯缺氧组比较,P < 0.05。 |
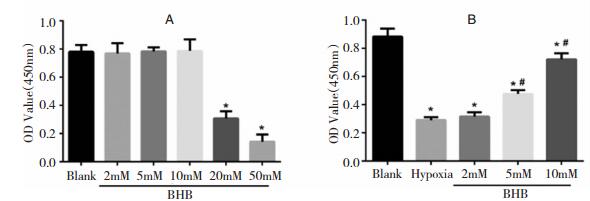
为观察BHB不同浓度对正常神经元活力影响,设置2 mM、5 mM、8 mM、10 mM、20 mM和50 mM梯度浓度分别作用神经元24 h。从图 4A看出,低浓度(2 mM、5 mM和10 mM)BHB时,神经元活力无明显变化(P>0.05),说明这些浓度段BHB对神经元无明显毒副作用。高浓度(20 mM和50mM)时,神经元活力出现显著降低(P < 0.05),说明高浓度BHB对神经元活力有毒性作用。
|
| 图 4 CCK8实验 注:A:不同浓度BHB对正常神经元活力的影响;B:不同浓度BHB对糖氧剥夺神经元活力的影响;*:与Blank组比较,P < 0.05;#:与单纯缺氧组比较,P < 0.05。 |
所以我们使用2 mM、5 mM和10 mM三个浓度进行缺氧实验,观察BHB是否发挥神经元保护作用。从图 4B看出,与Blank组比,糖氧剥夺后神经元活力显著降低(P < 0.01)。给予2 mM浓度BHB后,相比缺氧组,神经元活力无显著变化(P>0.05);给予5 mM和10 mM浓度BHB后,相比缺氧组,神经元活力均显著增强(P < 0.05)。
2.5 QPCR实验从图 5A看出,与Blank组比,糖氧剥夺组SMCT1 mRNA表达显著降低(P < 0.05);BHB预处理后,与单纯缺氧组比,2 mM组的SMCT1 mRNA无明显变化(P>0.05);5 mM与10 mM组SMCT1mRNA表达显著增强(P < 0.05),其中10 mM组变化最显著。
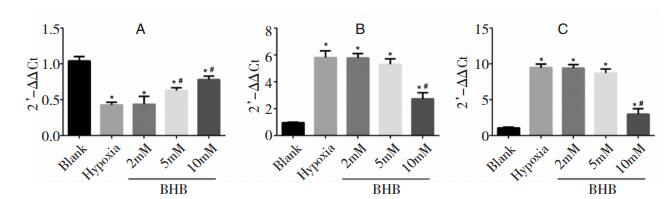
|
| 图 5 QPCR实验(2-△△Ct法) 注:A:各组神经元细胞中SMCT1/SLC5A8 mRNA的表达情况;B:各组神经元细胞中细胞色素C mRNA的表达情况;C:各组神经元细胞中caspase 3 mRNA的表达情况;*:与Blank组比较,P < 0.05;#:与单纯缺氧组比较,P < 0.05。 |
从图 5B和图 5C看出,与正常神经元比,糖氧剥夺组Cytochrome C与caspase 3 mRNA表达显著升高(P < 0.05);BHB预处理后,与单纯缺氧组比,2 mM组与5 mM组Cytochrome C与caspase 3 mRNA表达无明显变化(P>0.05),10 mM组Cytochrome C与caspase3 mRNA表达显著降低,差异有统计学意义(P < 0.05)。
2.6 Western Blot实验从图 6和图 7A看出,与Blank组比,单纯缺氧神经元中SMCT1蛋白表达急剧下降(P < 0.05);与单纯缺氧组比,BHB-2 mM预处理组SMCT1蛋白表达无显著差异(P>0.05);与单纯缺氧组比BHB-5 mM与10 mM预处理组SMCT1蛋白表达均显著升高(P < 0.05)。
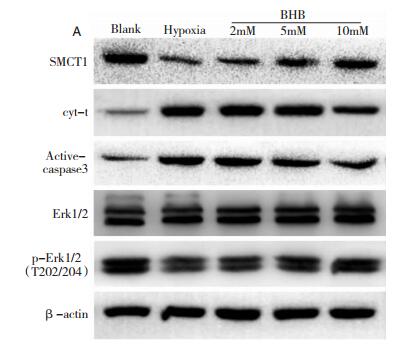
|
| 图 6 Western Blot实验条带图 |
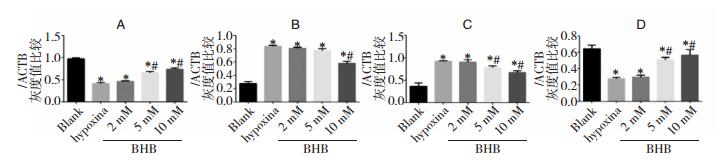
|
| 图 7 Western Blot实验柱形图 注:A:各组SMCT1蛋白表达差异柱形图;B:各组细胞色素C蛋白表达差异柱形图;C:各组细胞active-caspase 3蛋白表达差异柱形图;D:各组细胞ERK1/2蛋白磷酸化水平表达差异柱形图;*:与Blank组比较,P < 0.05;#:与单纯缺氧组比较,P < 0.05。 |
从图 6和图 7B看出,与Blank组比,单纯缺氧神经元中Cytochrome C蛋白表达有显著升高(P < 0.05);与单纯缺氧组比,BHB-2 mM及BHB-5 mM预处理的Cytochrome C蛋白表达均无明显差异(P>0.05);与单纯缺氧组比,BHB-10 mM预处理组Cytochrome C蛋白表达显著升高(P < 0.05)。
从图 6和图 7C看出,与Blank组比,缺氧神经元中活化的caspase3蛋白表达量明显升高(P < 0.05);与单纯缺氧组比,BHB-2 mM预处理组的活化caspase3表达量无显著差异(P>0.05);与单纯缺氧组比,BHB-5 mM与10 mM组的活化caspase3蛋白表达量显著回升(P < 0.05),其中10 mM组升高最明显(P < 0.05)。
从图 6和图 7D看出,与Blank组比,缺氧神经元中ERK1/2蛋白磷酸化水平明显降低(P < 0.05);与单纯缺氧组比,BHB-2 mM预处理组的ERK1/2蛋白磷酸化水平无显著差异(P>0.05);与单纯缺氧组比,BHB-5 mM与10 mM组的ERK1/2蛋白磷酸化水平显著回升(P < 0.05),其中10 mM组升高最明显(P < 0.05)。
3 讨论在缺血性脑卒中发生过程中,神经元细胞是首先受损单元。细胞线粒体功能障碍、氧化应激[5]和蛋白质合成功能障碍等病理反应是导致神经元损伤的首要因素。其中线粒体功能障碍所致能量摄取障碍起核心作用,线粒体通过释放Cytochrome C等凋亡因子[6]及线粒体自噬等途径诱导细胞凋亡[7]。Chen等[8]研究指出,“富裕环境”下脑卒中大鼠神经功能改善明显,且神经元细胞形态,尤其线粒体超微结构改善更明显。Sun等[9]研究表明线粒体通道蛋白CHCD4的下调可减少缺氧性脑损伤的脑内神经元细胞凋亡。
钠离子偶联单羧酸转运蛋白SMCT1是神经元摄取酮体、乳酸能量的特异通道[10],BHB经SMCT1转运进入胞内,通过β-氧化途径和作为一种组蛋白乙酰化酶的抑制剂发挥作用[11],有研究表明,SMCT1是BHB的特异性转运体蛋白[11, 12]。在神经系统特别是神经元细胞中发现有SMCT1存在,在神经元利用乳酸、酮体等作为能量来源时的主要介导物质[10]。在糖尿病大鼠给予酮体饮食的研究中发现,SMCT1转运蛋白在脑内海马区和皮质均有增多,同时伴随酮体BHB氧化供能增加[13]。
Forero等[14]研究表明,BHB通过提高SMCT1表达水平,可减少小鼠癫痫样活动。在红藻氨酸诱导的癫痫大鼠模型中,腹腔注射BHB可减少大鼠癫痫样活动次数。BHB还可通过H3K9BHB调节BDNF表达,改善抑郁小鼠的行为[15]。
从我们研究中也可发现,在BHB预处理组的SMCT mRNA与蛋白均有普遍升高,且对BHB有剂量依赖性。
本实验中,神经元糖氧剥夺后,神经元细胞活力降低,线粒体超氧化物生成增多,说明糖氧剥夺可引起神经元细胞线粒体的氧化应激,导致功能障碍。经过BHB预处理的神经元细胞,在糖氧剥夺实验中细胞活力比对照组表现更好,且有一定剂量依赖性,说明适量BHB在体外神经元缺氧模型中可以发挥神经元保护作用。同时在BHB预处理组的SMCT mRNA与蛋白均有普遍升高,且对BHB有剂量依赖性。在低氧发生时,细胞线粒体外膜转运孔发生崩裂,在氧化磷酸化作用下,线粒体基质解偶联膨胀,释放细胞色素C,细胞色素C可进一步激活凋亡诱导因子如caspase3和核酸内切酶G,这些AIF又进一步进入胞核引起DNA断裂。在神经元细胞中,这个过程还依赖于还原性谷胱甘肽。ERK1/2信号通路在神经元生成过程中有重要作用[16],在缺氧发生后,ERK 1/2的蛋白磷酸化失活,导致线粒体功能障碍[17],引起细胞凋亡发生。ROS抑制剂可通过激活ERK1/2信号通路和GSK3β信号通路,降低葡萄糖缺乏导致的神经毒性。
结合我们的研究可看出,神经细胞发生糖氧剥夺后,细胞氧化应激引起线粒体超氧化物生成增多,线粒体功能障碍导致Cytochrome C释放,进而引起细胞凋亡。在这个过程中,ERK1/2信号通路发挥了关键作用,神经细胞氧化应激损伤移植了ERK1/2蛋白的磷酸化,而BHB可重新增强ERK1/2蛋白信号的磷酸化激活,我们推测,BHB经SMCT1转运体进入神经细胞后,激活胞内ERK1/2信号通路,进而进入线粒体影响Cytochrome C释放,发挥神经保护作用。
| [1] |
Li P, Stetler RA, Leak RK, et al. Oxidative stress and DNA damage after cerebral ischemia:Potential therapeutic targets to repair the genome and improve stroke recovery[J]. Neuropharmacology, 2017. |
| [2] |
Lv J, Hu W, Yang Z, et al. Focusing on claudin-5:A promising candidate in the regulation of BBB to treat ischemic stroke[J]. Prog Neurobiol, 2017. |
| [3] |
Itoh T, Quastel JH. Ribonucleic acid biosynthesis in adult and infant rat brain in vitro[J]. Science, 1969, 164(3875): 79-80. DOI:10.1126/science.164.3875.79 |
| [4] |
Tieu K, Perier C, Caspersen C, et al. D-beta-hydroxybutyrate rescues mitochondrial respiration and mitigates features of Parkinson disease[J]. J Clin Invest, 2003, 112(6): 892-901. DOI:10.1172/JCI200318797 |
| [5] |
陈婵, 邹望远, 王锷, 等. 高压氧与脑缺血再灌注损伤中的氧化应激[J]. 国际神经病学神经外科学杂志, 2008, 35(4): 311-314. |
| [6] |
姜辰, 叶建林. 基于线粒体的缺血性脑卒中病理机制研究进展[J]. 国际神经病学神经外科学杂志, 2017, 44(3): 323-326. |
| [7] |
Anzell AR, Maizy R, Przyklenk K, et al. Mitochondrial Quality Control and Disease:Insights into Ischemia-Reperfusion Injury[J]. Mol Neurobiol, 2017. |
| [8] |
Chen X, Zhang X, Xue L, et al. Treatment with Enriched Environment Reduces Neuronal Apoptosis in the Periinfarct Cortex after Cerebral Ischemia/Reperfusion Injury[J]. Cell Physiol Biochem, 2017, 41(4): 1445-1456. DOI:10.1159/000468368 |
| [9] |
Sun Y, Li T, Xie C, et al. Haploinsufficiency in the mitochondrial protein CHCHD4 reduces brain injury in a mouse model of neonatal hypoxia-ischemia[J]. Cell Death Dis, 2017, 8(5): e2781. DOI:10.1038/cddis.2017.196 |
| [10] |
Martin PM, Gopal E, Ananth S, et al. Identity of SMCT1(SLC5A8) as a neuron-specific Na+-coupled transporter for active uptake of L-lactate and ketone bodies in the brain[J]. J Neurochem, 2006, 98(1): 279-288. DOI:10.1111/jnc.2006.98.issue-1 |
| [11] |
Stilling RM, van de Wouw M, Clarke G, et al. The neuropharmacology of butyrate:The bread and butter of the microbiota-gut-brain axis[J]. Neurochem Int, 2016, 99: 110-132. DOI:10.1016/j.neuint.2016.06.011 |
| [12] |
Dave RA, Morris ME. Semi-mechanistic kidney model incorporating physiologically-relevant fluid reabsorption and transporter-mediated renal reabsorption:pharmacokinetics of γ-hydroxybutyric acid and L-lactate in rats[J]. J Pharmacokinet Pharmacodyn, 2015, 42(5): 497-513. DOI:10.1007/s10928-015-9441-1 |
| [13] |
de Assis AM, da SJS, Rech A, et al. Cerebral Ketone Body Oxidation Is Facilitated by a High Fat Diet Enriched with Advanced Glycation End Products in Normal and Diabetic Rats[J]. Front Neurosci, 2016, 10: 509. |
| [14] |
Forero-Quintero LS, Deitmer JW, Becker HM. Reduction of epileptiform activity in ketogenic mice:The role of monocarboxylate transporters[J]. Sci Rep, 2017, 7(1): 4900. DOI:10.1038/s41598-017-05054-0 |
| [15] |
Chen L, Miao Z, Xu X. β-hydroxybutyrate alleviates depressive behaviors in mice possibly by increasing the histone3-lysine9-β-hydroxybutyrylation[J]. Biochem Biophys Res Commun, 2017, 490(2): 117-122. DOI:10.1016/j.bbrc.2017.05.184 |
| [16] |
Zeng XJ, Yu SP, Zhang L, et al. Neuroprotective effect of the endogenous neural peptide apelin in cultured mouse cortical neurons[J]. Exp Cell Res, 2010, 316(11): 1773-1783. DOI:10.1016/j.yexcr.2010.02.005 |
| [17] |
Pucci B, Indelicato M, Paradisi V, et al. ERK-1 MAP kinase prevents TNF-induced apoptosis through bad phosphorylation and inhibition of Bax translocation in HeLa Cells[J]. J Cell Biochem, 2009, 108(5): 1166-1174. DOI:10.1002/jcb.v108:5 |
 2018, Vol. 45
2018, Vol. 45




