扩展功能
文章信息
- 陈妍林, 李志军, 巴黎, 张旻
- CHEN Yan-Lin, LI Zhi-Jun, BA Li, ZHANG Min
- 自噬及Rab9在阿尔茨海默病神经元变性过程中的作用
- Roles of autophagy and Rab9 in neuronal degeneration of Alzheimer's disease
- 国际神经病学神经外科学杂志, 2018, 45(1): 37-41
- Journal of International Neurology and Neurosurgery, 2018, 45(1): 37-41
-
文章历史
收稿日期: 2017-10-13
修回日期: 2018-01-11
2. 华中科技大学同济医学院附属同济医院神经内科, 湖北省 武汉市 430030
2. Department of Neurology, Tongji Medical College, Huazhong University of Science and Technology, WuHan 430000, China
阿尔茨海默病(Alzheimer’s disease, AD)是累及中枢神经系统的神经元变性疾病。细胞外β淀粉样蛋白(amyloid-β, Aβ)沉积形成的老年斑是AD的核心病理改变之一。大量研究表明,自噬在细胞内Aβ及其前体蛋白APP(amyloid precursor protein, APP)的转运、代谢和清除过程中起到了非常重要的作用[1],这已成为AD神经元变性机制的研究热点。APP在不同细胞器间的运输及囊泡的融合由Rab-GTP酶家族精密调控[2]。其成员之一的Rab9是表达于晚期内体的特异性小分子GTP激酶,参与内体、溶酶体和高尔基复合体间的囊泡运输和信号传导[3]。研究显示,选择性自噬的过程也依赖于Rab9[4]。但是,自噬和Rab9在AD的神经元变性过程中会发生什么样的改变,迄今为止并没有阐明。故本研究以12月龄的APPswe/PS1dE9双转基因小鼠为对象,采用免疫荧光和Western Blot等实验技术对小鼠脑组织内Aβ1-16、LC3B和Rab9进行细胞内定位及定量分析,初步探讨阿尔茨海默病神经元变性过程中自噬及Rab9的作用。
1 材料与方法 1.1 材料 1.1.1 实验动物杂合型APPswe/PS1dE9双转基因小鼠(以下简称转基因小鼠,Tg)购于美国Jackson实验室,在华中科技大学同济医学院动物中心饲养,给予高温高压消毒的标准啮齿类动物饲料及饮水,饲养环境保持12 h的明暗周期,室温25℃,湿度50%。将杂合型APPswe/PS1dE9双转基因小鼠与同系野生型小鼠(以下简称野生型小鼠,Wt)交配繁殖传代,子代小鼠在2月龄剪尾进行PCR基因型鉴定,于12月龄时,以同龄同窝同性别野生型小鼠为对照组,每组4只小鼠。
1.1.2 主要试剂及设备Mouse anti-Human Beta Amyloid (Aβ) monoclonalantibody (6E10)购于Covance (America)公司;Rabbit anti LC3B polyclonal antiboby购于Cell Signaling;Goat anti Rab9A polyclonal antibody购于Santa cruz;Alexa Fluor ® 594-Donkey anti-mouse IgG、Alexa Fluor ® 594-Donkey anti-rabbit IgG和Alexa Fluor ® 488-Donkey anti-Goat IgG均购于Molecular Probes公司;正常驴血清(NDS)购于联科生物公司;牛血清白蛋白(BSA)购于美国SIGMA公司;冰冻切边修复液(5×)、DAPI、PMSF、RIPA裂解液和BCA蛋白浓度测定试剂盒均购于上海碧云天生物技术公司;Western凝胶试剂盒和β-actin抗体均购于武汉博士德生物工程有限公司;ECL底物液购于Thermo;显影定影试剂盒购于武汉巴菲尔生物;PVDF膜购于Millipore;免荧光倒置显微镜购于OLYMPUS, LEICA公司;冰冻切片机购于德国Leica;微量加样器购自Eppendorf公司;蛋白电泳仪电源、垂直电泳槽、电转仪和酶标仪均购自BIO-RAD。
1.2 方法 1.2.1 小鼠脑组织取材12月龄小鼠经腹腔注射氯胺酮麻醉后,4℃的0.01 mol/L生理盐水心脏灌流,取脑,矢状位切开,左侧半于4%多聚甲醛中固定16 h后,梯度沉糖(顺序经历10%、20%和30%蔗糖溶液),OCT包埋后于恒冷箱冰冻切片机冠状位连续冰冻切片,片厚20 μm;贴于防脱玻片上进行免疫荧光染色。右侧半于EP管中称量后用于Western Blot蛋白定量分析。
1.2.2 免疫荧光染色取小鼠冰冻切片晾干后,经70%甲酸室温处理10 min(仅限于6E10染色时),PBS漂洗后,冰冻切片修复液(1×)于37℃抗原修复25 min,滴加适量一抗溶液(稀释比例:6E10:1 :1000;LC3B:1 :200;Rab9A:1 :100),于4℃过夜孵育,PBS漂洗后加入二抗溶液(用PBS稀释,Alexa Fluor ® 594-Donkey anti-mouce IgG:1 :200;Alexa Fluor ® 594-Donkey anti-rabbit IgG:1 :200;Alexa Fluor ® 488-Donkey anti-Goat IgG:1 :100),室温避光孵育1 h,PBS漂洗后加入DAPI(1×)复染2 min;PBS漂洗,去离子水洗1 min;梯度酒精脱水晾干(100%、95%、80%和70%,各3 min),甘油封片,荧光显微镜下观察拍照。
1.2.3 脑组织Western Blot小鼠脑组织加入含PMSF的RIPA裂解液(100 :1),0~4℃冰水混合物中用1 ml玻璃匀浆器进行组织匀浆后,离心取上清所需蛋白,测定浓度,加上样Buffer,置于沸水中10 min,取50 μg蛋白样品进行SDS-PAGE电泳,转移到PVDF膜后,用相应一抗4℃孵育过夜(抗体稀释倍数:LC3B:1 :600;Rab9:1 :400),PBS洗3次去除多余抗体,室温孵育二抗(1 :40000稀释),通过凝胶成像系统观察结果。
1.3 统计与分析本研究中所有数据均采用均数±标准差(x±s)表示,应用SPSS 17统计软件进行统计分析,两组之间比较采用独立样本t检验,P < 0.05,判断为差异具有统计学意义;Image J分析Western Blot条带灰度值,计算并统计各蛋白条带相对于β-actin条带的灰度值比;采用GraphPad Prism 5制作统计图表。
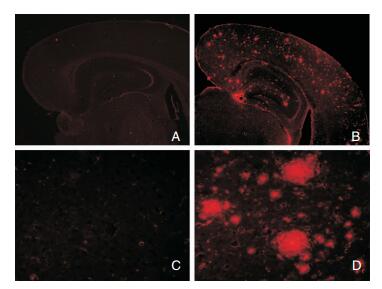
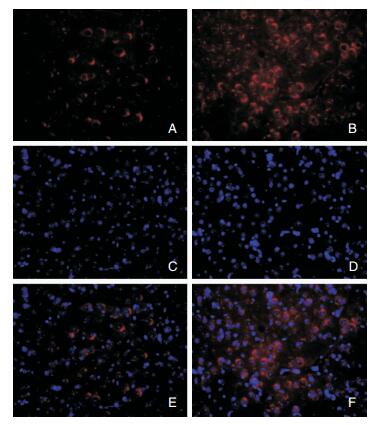
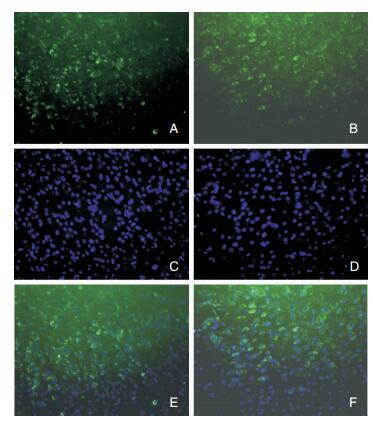
2 结果 2.1 免疫荧光染色12月龄APPswe/PS1dE9双转基因小鼠脑内可见Aβ沉积,可见大量典型的老年斑—有致密核心的神经炎性斑块,主要分布在皮质和海马(图 1)。12月龄APPswe/PS1dE9双转基因小鼠脑内可见自噬的增加(图 2)。两组小鼠脑内均有Rab9的表达,均分布于胞浆中,但二者表达形态有所不同:与对照组比较,12月龄APPswe/PS1dE9双转基因小鼠脑内Rab9呈粗颗粒状,聚集成“半月形”,分布在核周区(图 3)。
|
| 图 1 不同基因型小鼠6E10免疫荧光染色结果 注:A:野生型小鼠,×10倍;B:APPswe/PS1dE9双转基因小鼠,×10倍;C:野生型小鼠,×40倍;D:APPswe/PS1dE9双转基因小鼠,×40倍。 |
|
| 图 2 不同基因型小鼠LC3B免疫荧光染色结果,×40倍 注:A:野生型小鼠LC3B;B:APPswe/PS1dE9双转基因小鼠LC3B;C:野生型小鼠DAPI;D:APPswe/PS1dE9双转基因小鼠DAPI;E:野生型小鼠LC3B-DAPI;F:APPswe/PS1dE9双转基因小鼠LC3B-DAPI。 |
|
| 图 3 不同基因型小鼠Rab9免疫荧光染色结果,×40倍 注:A:野生型小鼠Rab9;B:APPswe/PS1dE9双转基因小鼠Rab9;C:野生型小鼠DAPI;D:APPswe/PS1dE9双转基因小鼠DAPI;E:野生型小鼠Rab9-DAPI;F:APPswe/PS1dE9双转基因小鼠Rab9-DAPI。 |
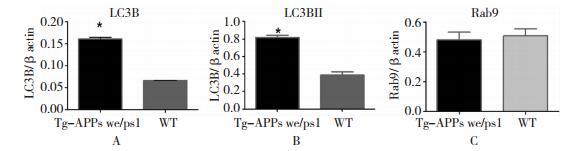
LC3B-Ⅱ是自噬小体特异性的标志物,该蛋白的表达提示出现了自噬的诱导[4]。本研究经Western Blot发现,虽然在转基因小鼠及野生型小鼠脑内均有LC3B表达,但转基因小鼠表达量明显增多(0.819±0.034 vs. 0.390±0.047, P=0.0005);与对照组相比,APPswe/PS1dE9双转基因小鼠脑内LC3B-Ⅱ的表达量明显增高(0.162±0.004 vs. 0.067±0.001, P < 0.0001),表明在AD中,存在自噬诱导的增加。本研究发现不同基因型小鼠脑内Rab9表达量无统计学差异(0.481±0.071 vs. 0.508±0.064, P>0.05)。见图 4和图 5。
|
| 图 4 不同基因型小鼠脑内LC3B、Rab9表达水平的定量分析 注:A:不同基因型小鼠脑内LC3B表达水平比较,P < 0.05;B:不同基因型小鼠脑内LC3BII表达水平比较,P < 0.05;C:不同基因型小鼠脑内Rab9表达水平比较,P>0.05;*:转基因小鼠与野生型小鼠比较。 |

|
| 图 5 不同基因型小鼠脑内LC3B、Rab9和β-actin电泳条带图 注:LC3B条带中分别为16KD的LC3B-Ⅰ和14KD的LC3B-Ⅱ。 |
本试验中12月龄的APPswe/PS1dE9双转基因小鼠在皮质和海马区域出现大量的有“致密核心”的老年斑,说明该小鼠能够在12月龄时出现AD患者特征性的病理改变,可以用于AD的发病机制研究。
本实验发现,APPswe/PS1dE9双转基因小鼠脑内LC3B表达明显增多,表明在AD小鼠脑内有自噬小体的增多。自噬是细胞通过自我吞食(self-eating)消除和降解受损、衰老的细胞器和变性蛋白质等生物大分子,为细胞的再生和修复提供原料的过程[5, 6],与细胞正常生理功能的维系密不可分。细胞内LC3B主要有两种类型,一种是LC3B-I,分子量为16 KD,主要位于细胞质;另外一种为LC3B-II,分子量14 KD,定位于自噬小体膜,是自噬小体,尤其是自噬诱导特异性的标记物[7, 8]。在本研究中,我们发现,LC3B阳性的细胞在AD转基因小鼠的新皮质和海马显著增加。进一步的Western Blot发现,APPswe/PS1dE9双转基因小鼠脑内LC3B-Ⅱ明显增多,说明在AD小鼠的大脑中,可能存在自噬诱导的异常激活,导致自噬增加。自噬小体的增多和堆积是否还与自噬小体的降解受损有关,有待进一步研究。由于APP可以在自噬小体中经过β和γ分泌酶的切割产生Aβ,因此,这些自噬小体将成为Aβ的“生成基地”,从而诱导细胞死亡[6, 9]。虽然自噬能清除异常聚集的蛋白,但上调的自噬也促进了Aβ有关的病理改变发生。不仅如此,Aβ能够破坏溶酶体对自噬小体内容物的降解能力,从而形成一个不断放大的恶性循环,加速神经元变性。这些可能是自噬过程参与了AD的神经元变性的机制所在。
有研究发现,β淀粉样蛋白前体蛋白(amyloid precursor protein, APP)在不同细胞器间的运输及细胞器间囊泡的融合由Rab-GTP酶家族精密调控[2]。其中的成员之一,Rab9主要分布在晚期内体,少量分布在高尔基体及溶酶体[9, 10]。细胞内的APP主要通过以下两种途径代谢[11]:①自噬途径:细胞内的APP,被包裹后成为自噬前体结构(pre-autophagosomalstructure, PAS),封闭后形成自噬小体(autophagosome, AP),在与溶酶体融合成自噬溶酶体(autophaglysosome, AL),最后经溶酶体降解。②内吞途径:APP内吞后形成囊泡,经高尔基体介导或直接与早期内体融合,成熟为晚期内体,一部分直接与溶酶体融合而降解另一部分先与自噬小体融合成自噬内体,然后再与溶酶体融合而降解。Rab9为晚期内体特异性小分子GTP激酶[3],通过参与晚期内体、溶酶体及反式高尔基体网状结构之间的囊泡转运[12],参与APP的代谢调控。正常情况下,新合成的溶酶体酶依赖6-磷酸甘露糖受体(mannose-6-phosphate receptors, MPRs)从高尔基体运输到溶酶体,然后,在Rab9和Tip47(Rab9的效应子)的帮助下,MPRs从晚期内体送回高尔基体以恢复自身活性[4, 13]。由此推测,Rab9通过影响自噬途径中溶酶体酶的转运者MPRs而影响APP代谢的自噬途径。自噬有依赖Atg5、Atg7和LC3的传统自噬和依赖Rab9的选择性自噬两种[4, 14]。Nishida等[4]发现,采用RNAi沉默Rab9能减慢自噬过程,并且抑制自噬小体的成熟。由此可见,Rab9在内体和自噬小体的成熟及物质转运和清除过程中起到了关键作用。有研究发现,在神经系统异常变性病C型Niemann-Pick病(NPC)的细胞和小鼠模型中,虽然Rab9的表达水平正常,但大量的Rab9被扣留在去磷酸化的中间丝(intermediate filament, IF)波形蛋白(vimentin)中而不能发挥正常的功能,导致6-磷酸甘露糖受体(MPRs)无法转运出晚期内体而被溶解和囊泡运输障碍,进而出现细胞的死亡[15-17]。将外源性的Rab9过表达于NPC的细胞或小鼠模型中可以纠正此时的晚期内体功能障碍,使NPC细胞存活增加和小鼠脑内Tau蛋白的过度磷酸化减轻,延缓浦肯野神经元的死亡减少和运动功能改善[18]。NPC有“少年型AD”之称,患者脑内可以见到大量神经原纤维缠结和广泛的神经元变性,同时在海马锥体细胞和浦肯野神经元中还能检测到APP代谢异常和Aβ42的沉积[13],表明该病可能和AD具有相同的神经病理信号传递机制。而本研究发现,APPswe/PS1dE9双转基因小鼠脑内Rab9表达水平虽然与野生型小鼠无显著性差异,但Rab9在两种小鼠脑细胞内的分布形态有明显差异。推测在阿尔茨海默病神经元变性过程Rab9在细胞内的分布发生了异常改变,从而导致其不能发挥正常功能。这种现象背后的机制值得开展进一步的深入研究加以明确。
APPswe/PS1dE9双转基因小鼠较好的体现了AD患者的神经病理特点—典型的“有致密核心”老年斑,可用于AD发病机制及治疗探索的研究。自噬诱导的增加、Rab9的功能和/或分布异常可能参与了AD的神经元变性过程。
| [1] |
Li Q, Liu Y, Sun M. Autophagy and Alzheimer's Disease[J]. Cell Mol Neurobiol, 2017, 37(3): 377-388. DOI:10.1007/s10571-016-0386-8 |
| [2] |
Pfeffer SR. Rab GTPases:master regulators that establish the secretory and endocytic pathways[J]. Mol Biol Cell, 2017, 28(6): 712-715. DOI:10.1091/mbc.E16-10-0737 |
| [3] |
Kucera A, Bakke O, Progida C. The multiple roles of Rab9 in the endolysosomal system[J]. Commun Integr Biol, 2016, 9(4): e1204498. DOI:10.1080/19420889.2016.1204498 |
| [4] |
Nishida Y, Arakawa S, Fujitani K, et al. Corrigendum:Discovery of Atg5/Atg7-independent alternative macroautophag[J]. Nature, 2016, 533(7601): 130. |
| [5] |
Karabiyik C, Lee MJ, Rubinsztein DC. Autophagy impairment in Parkinson's disease[J]. Essays Biochem, 2017, 61(6): 711-720. DOI:10.1042/EBC20170023 |
| [6] |
Zare-Shahabadi A, Masliah E, Johnson GV, et al. Autophagy in Alzheimer's disease[J]. Rev Neurosci, 2015, 26(4): 385-395. |
| [7] |
He Y, Zhao X, Subahan NR, et al. The prognostic value of autophagy-related markers beclin-1 and microtubule-associated protein light chain 3B in cancers:a systematic review and meta-analysis[J]. Tumour Biol, 2014, 35(8): 7317-7326. DOI:10.1007/s13277-014-2060-4 |
| [8] |
周瑾瑕, 李东方, 毕方方. 自噬在Duchenne型肌营养不良中的研究[J]. 国际神经病学神经外科学杂志, 2017, 44(4): 365-369. |
| [9] |
Tam JH, Seah C, Pasternak SH. The Amyloid Precursor Protein is rapidly transported from the Golgi apparatus to the lysosome and where it is processed into beta-amyloid[J]. Mol Brain, 2014, 7: 54. DOI:10.1186/s13041-014-0054-1 |
| [10] |
Junaid M, Muhseen ZT, Ullah A, et al. Molecular modeling and molecular dynamics simulation study of the human Rab9 and RhoBTB3 C-terminus complex[J]. Bioinformation, 2014, 10(12): 757-763. DOI:10.6026/bioinformation |
| [11] |
Nixon RA, Yang DS. Autophagy failure in Alzheimer's disease—locating the primary defect[J]. Neurobiol Dis, 2011, 43(1): 38-45. DOI:10.1016/j.nbd.2011.01.021 |
| [12] |
Szatmari Z, SassM. The autophagic roles of Rab small GTPases and their upstream regulators:a review[J]. Autophagy, 2014, 10(7): 1154-1166. DOI:10.4161/auto.29395 |
| [13] |
Cermak S, Kosicek M, Mladenovic-Djordjevic A, et al. Loss of Cathepsin B and L Leads to Lysosomal Dysfunction, NPC-Like Cholesterol Sequestration and Accumulation of the Key Alzheimer's Proteins[J]. PLoS One, 2016, 11(11): e0167428. DOI:10.1371/journal.pone.0167428 |
| [14] |
Shimizu S, Arakawa S, Nishida Y. Autophagy takes an alternative pathway[J]. Autophagy, 2010, 6(2): 290-291. DOI:10.4161/auto.6.2.11127 |
| [15] |
Pu J, Guardia CM, Keren-Kaplan T, et al. Mechanisms and functions of lysosome positioning[J]. J Cell Sci, 2016, 129(23): 4329-4339. DOI:10.1242/jcs.196287 |
| [16] |
Ganley IG, Pfeffer SR. Cholesterol accumulation sequesters Rab9 and disrupts late endosome function in NPC1-deficient cells[J]. J Biol Chem, 2006, 281(26): 17890-17899. DOI:10.1074/jbc.M601679200 |
| [17] |
Ng EL, Gan BQ, Ng F, et al. Rab GTPases regulating receptor trafficking at the late endosome-lysosome membranes[J]. Cell Biochem Funct, 2012, 30(6): 515-523. DOI:10.1002/cbf.v30.6 |
| [18] |
Kaptzan T, West SA, Holicky EL, et al. Development of a Rab9 transgenic mouse and its ability to increase the lifespan of a murine model of Niemann-Pick type C disease[J]. Am J Pathol, 2009, 174(1): 14-20. DOI:10.2353/ajpath.2009.080660 |
 2018, Vol. 45
2018, Vol. 45




