扩展功能
文章信息
- 江录伟, 钱若兵, 傅先明, 彭楠, 张栋, 夏春生, 张旭, 牛朝诗, 汪业汉
- JIANG Luwei, QIAN Ruo-bing, FU Xian-ming, PENG Nan, ZHANG Dong, XIA Chun-sheng, ZHANG Xu, NIU Chao-shi, WANG Ye-han
- 难治性癫痫患者脑网络介数及其异常脑区间功能连接变化研究
- Changes in betweenness in brain network and functional connectivity between brain regions with abnormal betweenness among patients with refractory epilepsy
- 国际神经病学神经外科学杂志, 2018, 45(1): 30-33
- Journal of International Neurology and Neurosurgery, 2018, 45(1): 30-33
-
文章历史
收稿日期: 2017-07-19
修回日期: 2018-01-02
近年来RS-fMRI(resting-state functional magnetic resonance imaging)的相关研究发现癫痫是一种脑网络疾病[1],而癫痫患者的脑网络具有小世界属性(具有较小的平均路径长度,较大的聚类系数)[2],介数(betweenness)是脑功能研究中对脑功能进行评价的一个重要指标,代表节点在脑网络信息传递中的影响力,基于介数策略对具有小世界属性的网络进行研究,可以了解脑网络功能变化[3]。本研究通过图论的分析方法,通过介数属性研究难治性癫痫患者脑网络的改变及这种变化与认知功能障碍的相关性。
1 材料与方法 1.1 研究对象 1.1.1 癫痫组系安徽医科大学附属省立医院神经外科癫痫门诊收治的难治性癫痫患者20例(表 1)。入选标准:①病程2年及以上符合难治性癫痫的诊断标准,符合国际抗癫痫联盟(International League Against Epilepsy, ILAE)2001年癫痫分类;②CT、MRI等常规影像学检查未发现明显的致病灶;③在发作间期和发作期脑电图描记出典型的正常背景下双侧全面棘慢波或棘波发放;④无神经及精神方面的疾病及相关病史;⑤无其他身体发育异常。
| 项目 | 年龄(岁) | 文化程度(年) | 例数(男/女) | 发病年龄 | 病程(年) |
| 难治性癫痫组 | 22.16±7.57 | 16.41±4.23 | 20(9/11) | 16.72±6.58 | 12.37±3.24 |
| 健康对照组 | 23.37±6.9 | 15.05±3.75 | 20(10/10) | - | - |
| 检验值 | -0.76 | -1.35 | 0.83a | - | - |
| P值 | 0.30 | 0.27 | 0.64 | - | - |
| 注:a为χ2值,其余为t值 | |||||
系同期招募的正常对照组20例(表 1),排除神经精神系统疾病及其他相关器质性疾病,同时排除MRI检查禁忌,无精神类药物服用史,CT、MRI及脑电图检查均正常,右利手。两组被试的性别、年龄、及文化程度均相匹配,并差异无统计学意义(P>0.05,表 1),具有可比性。本研究已通过安徽医科大学附属省立医院伦理委员会的批准,所有受试者在实验前均被告知本研究内容及相应的权利与义务,并签署知情同意书。
1.2 方法 1.2.1 RS-fMRI数据采集:使用Philips 3.0 T磁共振成像系统,16通道标准头线圈对被试进行扫描,嘱癫痫组受试者在扫描前正常服用抗癫痫药。扫描前所有被试者安静地平躺于扫描仪内、闭目放松,无躯体动作,不进行系统性思维活动,佩戴降噪耳机及配套海绵垫固定被试者头部。扫描参数为:扫描视野:240mm×240mm,矩阵:64×64,重复时间/回波时间:2000ms/40ms,层厚:4mm,间距:0mm,隔层扫描,扫描层数共25层,共180个动态,扫描耗时约6min。
1.2.2 数据预处理运用MRIcovert软件将DICOM格式文件转换为NIFTI格式,然后在Matlab软件环境下使用GRETNA 1.2.0(http://www.nitrc.org/projects/gretna)软件中Network Construction模块对数据进行预处理及网络矩阵构建:①时间层校正:剔除前10个时间点图像,以降低机器启动不稳定带来的误差;②头动校正:手动剔除平动﹥1mm或转动﹥1.5°的被试,本研究无剔除数据;③空间标准化:所有个体的脑图均采用3mm×3mm×3mm重采样至蒙特利尔神经病研究所(Montreal Neurological Institute, MNI)标准脑空间的功能像模板;④平滑处理:以半峰全宽为6mm的高斯核进行平滑;⑤去线性漂移:去除空间平滑后的线性漂移;⑥低频滤波:提取0.01-0.08Hz的脑低频信号;⑦全脑信号、脑白质信号、脑脊液信号等协变量的去处除;⑧建立以AAL_90为模版的90×90的矩阵。
1.2.3 脑网络分析① 将得到的矩阵用GRETNA软件Network Analysis模块计算出各节点的介数值。②将癫痫组和对照组组的介数值行独立样本t检验,找出具有显著性的节点。③将介数有差异的节点用BrainNet Viewer 1.6(http://www.nitrc.org/projects/bnv/)成像。
1.2.4 功能连接分析① 使用静息态处理软件REST将介数值有差异的脑区作为感兴趣区(region of interest,ROI),使用ROI相关两两之间做功能连接;②将结果行独立样本t检验,得到有差异的连接,使用BrainNet Viewer将显著性连接成像。
1.2.5 统计学分析运用统计学软件SPSS 16.0对计量数据进行统计学计算,对于符合正态分布的计量资料用均数±标准差(x±s)表示,两组间正态分布计量资料比较采用t检验;两组间计数资料的比较采用卡方检验,P < 0.05表示差异具有有统计学意义。
2 结果 2.1 一般资料分析难治性癫痫组和健康对照组在年龄、文化程度、性别方面的差异并不具有统计学意义(P>0.05)。
2.2 脑网络改变将患者组与正常对照组介数进行两独立样本t检验,得到有差异的脑区(表 2、图 1),其中额下回三角部、嗅皮质介数均值升高,其余介数均值降低。
| 脑区 | 左/右半球 | 坐标值 | t值 | 介数平均值 | |||
| x | y | z | 患者组 | 对照组 | |||
| 背外侧额上回 | 右侧 | 21.9 | 31.12 | 43.82 | -2.40 | 8.08±10.40 | 19.68±16.60 |
| 眶部额上回 | 左侧 | -16.56 | 47.32 | -13.31 | -2.50 | 9.53±7.54 | 17.39±9.62 |
| 三角部额下回 | 右侧 | 50.33 | 30.16 | 14.17 | 2.05 | 28.42±23.30 | 13.32±19.24 |
| 嗅皮质 | 右侧 | 10.43 | 15.91 | -11.26 | 2.13 | 16.06±12.69 | 7.91±6.98 |
| 前扣带回 | 左侧 | -4.04 | 35.40 | 13.95 | -3.32 | 11.37±7.23 | 29.12±22.72 |
| 颞上回 | 右侧 | 58.15 | -21.78 | 6.80 | -2.19 | 13.43±9.23 | 25.16±21.61 |
| 颞下回 | 右侧 | 53.69 | -31.07 | -22.32 | -2.17 | 8.47±8.23 | 17.21±15.23 |
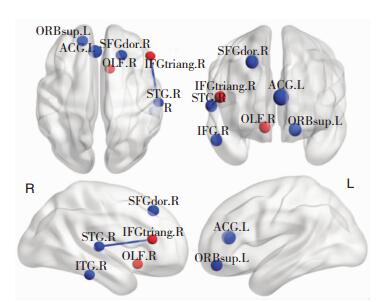
|
| 图 1 介数变化有差异的脑区及其功能连接的变化(蓝色节点表示脑区介数均值降低,红色节点表示脑区介数均值升高,蓝色边表示脑区间功能连接降低;SFGdor:背外侧额上回;ORBsup:眶部额上回;IFGtriang:额下回三角部;OLF:嗅皮质;ACG:前扣带回;STG:颞上回;ITG:颞下回,L:左侧;R:右侧) |
将介数有差异的患者组和正常对照组的脑区进行功能连接分析,功能连接结果进行两独立样本t检验,结果显示(见表 3、图 1)
| 组别 | t值 | P值 | ||
| 患者组 | 对照组 | |||
| 例数 | 20 | 20 | - | - |
| 额下回三角部与颞上回之间的连接 | 1.14±0.57 | 0.72±0.33 | -2.75 | 0.010 |
近年来的研究发现[4]人脑的功能和结构网络符合复杂网络模型。在网络中,节点介数的定义是经过该节点的最短路径占网络中所有最短路径总数的比例,反映了该节点(即脑区)在整个脑网络中的重要程度,介数的值越高表明通过该节点的信息量越大,对整个网络的影响力越大,反之越小。
本研究发现,难治性癫痫患者右侧额上回背外侧,左侧额上回眶部,左侧前扣带回,右侧颞上回、右侧颞下回脑区的介数值出现明显的下降,表明这些脑区在整个脑网络中的重要性有所下降以及与其他脑区信息沟通的能力下降;右侧额下回三角部,右侧嗅皮质脑区的介数值增加,很有可能是脑网络的一种代偿机制。
Posner等[5]提出了注意网络理论,认为注意功能主要由三个成分构成:警觉、定向、执行功能。前额叶是位于大脑皮层最前方的部分,是注意网络的执行功能的重要基础,负责接收和处理由大脑其他部分传入的各种认知信息,并及时对认知活动进行有效的调控,对大脑整体有指导性和组织性的影响。注意网络的执行功能在受到损害后,分析处理矛盾信息时的能力下降,处理干扰信息的效率变慢,反应时间延长。同时,前额叶不仅负责执行加工,还与工作记忆等复杂高级的认知活动相关。Tachibana等[6]利用假名挑选测试让被试者处理连续和离散的双重任务,通过fMRI评估被试处理双重任务时执行功能血氧变化,研究发现被试在处理双重任务时前额叶较单一任务明显激活,因此表明前额叶是短期存储和执行功能的重要介质。本研究中眶部额上回、额下回三角部、额上回背外侧这些介数发生改变的脑区均位于前额叶。前额叶癫痫特征性的痫性放电常导致广泛皮层损害,相关研究[7, 8]表明颞叶、海马、杏仁核等处痫性放电的传播方向通常是前额叶,异常的痫性放电可以导致前额叶功能的异常。同时,前额叶也参与执行功能中对于注意的控制,Kim等认为前扣带回和前额叶是认知控制的主要脑区,认知控制是指在面对干扰和冲突时灵活调整行为并管理相关与不相关冲突信息的能力[9]。认知控制的两个关键阶段分别是冲突觉察和冲突控制,负责对认知行为的监控和调节,前扣带回主要负责冲突觉察即检查当前信息流中的冲突与潜在冲突,而冲突控制则由背外侧前额叶负责即通过加强控制解决冲突[10]。本研究发现背外侧前额叶的部分脑区与前扣带回的介数属性均发生改变,这极有可能是癫痫患者的认知控制网络发生了变化。尽管前额叶皮层可能是与执行功能最为密切的脑区,但其他一些脑区也会参与执行功能信息的处理,这是大脑的分布式加工。已有研究表明,颞叶癫痫患者同样也有执行功能的损伤[11],此处皮层与边缘系统和海马关系密切,有研究认为[12]颞叶起源的痫性放电通过边缘系统环路传递到额叶,从而影响额叶皮层的功能。颞叶皮层同样有着复杂而重要的认知功能,有可能颞叶同样也参与执行功能的信息加工,本研究发现难治性癫痫患者前额叶部分脑区介数值异常的同时,颞叶部分脑区的介数值也存在异常。在对介数有差异的脑区进行功能连接分析时,我们还发现前额叶(额下回三角部)与颞叶(颞上回)之间的功能连接减弱。扣带束是主要负责连接这两处皮层区域的主要纤维,颞叶与额叶皮层的损伤可引起扣带束纤维的连接性受损[13],此外,由于癫痫的反复性放电会导致白质纤维束发生改变,轴突膜的退化和髓鞘的丢失以及反复放电引起神经元变性是纤维束完整性改变的主要原因,导致前额叶与颞叶之间的功能连接减弱,这一改变也会导致执行功能的损伤。
综上所述,本研究发现难治性癫痫患者脑网络介数值异常脑区主要分布在额上回、额下回、颞上回、颞下回和前扣带回等皮质,这些脑区主要位于前额叶与颞叶,负责执行功能与注意的控制;同时额叶与颞叶之间的功能连接降低,很可能是额叶与颞叶之间的纤维束损伤所致,这同样会导致执行网络信息交流受损,导致执行功能进一步损伤,但是其对认知执行功能具体损伤机制有待进一步阐明;此外,癫痫患者的发作表现会随脑内异常放电位置的不同而出现差异,难治性癫痫患者亦如此,本研究发现的异常脑区是否和这些放电的位置有关还有待阐明,下一阶段将fMRI结合脑电图继续对异常脑区进行深入研究并探究脑网络异常导致难治性癫痫患者认知执行功能改变的具体机制。
| [1] |
Blumenfeld H. What is a seizure network? Long-range network consequences of focal seizures[J]. Adv Exp Med Biol, 2014, 813: 63-70. DOI:10.1007/978-94-017-8914-1 |
| [2] |
李顺利, 钱若兵, 傅先明, 等. 难治性癫痫患者脑功能网络小世界属性变化的静息态MRI[J]. 中华神经科杂志, 2015, 48(8): 677-680. |
| [3] |
Lu ZM, Li XF. Attack Vulnerability of Network Controllability[J]. PLoS One, 2016, 11(9): e0162289. DOI:10.1371/journal.pone.0162289 |
| [4] |
Chen ZJ, He Y, Rosa-Neto P, et al. Revealing modular architecture of human brain tructural networks by using cortical thickness from MRI[J]. Cereb Cortex, 2008, 18(10): 2374-2381. DOI:10.1093/cercor/bhn003 |
| [5] |
Posner MI, Sheese BE, Odluda ş Y, et al. Analyzing and shaping human attentional networks[J]. Neural Netw, 2006, 19(9): 1422-1429. DOI:10.1016/j.neunet.2006.08.004 |
| [6] |
Tachibana A, Noah JA, Bronner S, et al. Activation of dorsolateral prefrontal cortex in a dual neuropsychological screening test:an fMRI approach[J]. Behav Brain Funct, 2012, 8(1): 26-34. DOI:10.1186/1744-9081-8-26 |
| [7] |
McDonald CR, Delis DC, Norman MA, et al. Response inhibition and set shifting in patients with frontal lobe epilepsy or temporal lobe epilepsy[J]. Epilepsy Behav, 2005, 7(3): 438-446. DOI:10.1016/j.yebeh.2005.05.005 |
| [8] |
Moore PM, Baker GA. The neuropsychological and emotional consequences of living with intractable temporal lobe epilepsy:implications for clinical management[J]. Seizure, 2002, 11(4): 224-230. DOI:10.1053/seiz.2001.0668 |
| [9] |
Kim C, Chung C, Kim J. Conflict adjustment through domain-specific multiple cognitive control mechanisms[J]. Brain Res, 2012, 1444(12): 55-64. |
| [10] |
Botvinick MM, Braver TS, Barch DM, et al. Conflict monitoring and cognitive control[J]. Psychol Rev, 2001, 108(3): 624-652. DOI:10.1037/0033-295X.108.3.624 |
| [11] |
Kim CH, LeeSA, Yoo HJ, et al. Executive performance on the Wisconsin Card Sorting Test in mesial temporal lobe epilepsy[J]. EurNeurol, 2007, 57(1): 39-46. |
| [12] |
Sloan DM, Bertram EH. Changes in midline thalamic recruiting responses in the prefrontal cortex of the rat during the development of chronic limbic seizures[J]. Epilepsia, 2009, 50(3): 556-565. DOI:10.1111/epi.2009.50.issue-3 |
| [13] |
Bigler ED. Anterior and middle cranial fossa in traumatic brain injury:relevant neuroanatomy and neuropathology in the study of neuropsychological outcome[J]. Neuropsychology, 2007, 21(5): 515-531. DOI:10.1037/0894-4105.21.5.515 |
 2018, Vol. 45
2018, Vol. 45




