扩展功能
文章信息
- 朱强, 陈思源, 王集生, 于书卿
- 小细胞肺癌垂体转移1例并文献复习
- 国际神经病学神经外科学杂志, 2017, 44(6): 649-652
-
文章历史
收稿日期: 2017-07-22
修回日期: 2017-11-14
垂体转移癌发病率低,临床症状与其余鞍区肿瘤相似,进展较快,影像学无特异性,预后较差,极易误诊。本文报道1例垂体转移癌病人,结合文献复习,加深对本病的认识,希望为本病的临床诊治提供参考。
1 病例摘要患者男性,54岁,主因左眼视力进行性下降10天至无光感20天收入院。自发病来,无头痛头晕,无恶心呕吐,无多饮多尿。入院体检:神清、语利,精神可,右眼粗测视力正常,左眼视力丧失,右眼视野粗测颞侧缺损,双眼各方向眼动充分,双瞳等大正圆,直径约3mm,右眼直接对光反应敏感,间接对光反应消失,左眼直接对光反应消失,间接反应敏感,余检查未见明显异常。辅助检查:入院后完善相关检查,血常规、生化与凝血等检查均未见明显异常,激素检查如表格1;垂体泌乳素(PRL):19.1(2.50~17.00) ng/mL、生长激素(GH):3.12(0.00~0.30) ng/m,稍高于正常值,孕酮 < 0.20(0.86~2.90) ng/mL、睾酮 < 0.20(1.6~7.26) ng/mL,余正常。胸片:右上肺结节灶,两肺门影大,两肺纹理重,右侧胸膜局部增厚可能。门诊眼科检查:右眼视力0.4,左眼无光感。视野:右眼大部分视野缺损,鼻上残损视岛。左眼无视力,无法检测。头颅CT:蝶鞍扩大,鞍底受压下降,鞍内可见长圆形稍高密度影,边缘清,左侧海绵窦受压。诊断:鞍区占位性病变:垂体瘤(图B)。头颅MRI:蝶鞍扩大,鞍底下陷,鞍内可见一团块状等T1等T2混杂信号影,信号均匀,边界不清,双侧海绵窦受累,鞍内团块影可见明显不均匀强化,大小约有19 mm × 21 mm × 24 mm,诊断:鞍内占位,考虑垂体腺瘤(图C)。
2 诊疗经过根据患者头颅CT和MRI,以及左眼视力进行性下降等表现,术前诊断患者鞍区占位:垂体腺瘤。考虑肿瘤体积以及侵袭情况,为求最大程度切除肿瘤,采取冠切右额入路切除肿瘤。
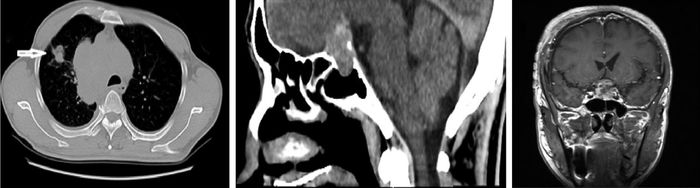
|
| 图 1 A图:肺部CT:箭头所示:右肺上叶可见结节样高密度影,大小约2.0*2.1cm,边缘毛糙,可见分叶及毛刺。B图:头颅矢状面CT:蝶鞍扩大,鞍底受压下降,鞍内可见长圆形稍高密度影,边缘清。C图:头颅冠状面增强MRI:鞍内团块影可见明显不均匀强化,双侧海绵窦受累,左侧较右侧重。 |
术中见肿瘤突起于第一间隙,灰黄色,血供丰富,肿瘤包裹左侧视神经,右侧视神经受压移位,肿瘤与两侧视神经粘连紧密,以刮匙沿各方向刮除肿瘤,实质部分质地韧,较难刮除,可见肿瘤破坏鞍底、鞍膈硬脑膜,最终大部切除肿瘤。术后病人诉左眼视力无明显好转。术后激素检查示:孕酮和睾酮仍旧低,甲状腺激素稍低:49.79(62.88~150.84) nmol/L,考虑与手术有关,余激素正常,给予口服优甲乐。术后一周,患者自感右眼视力进行性下降。眼科会诊:右眼视力0.25,左眼无光感。视野:右眼大部分视野缺损,鼻上残损视岛。左眼无视力,无法检测。病理回报:小细胞癌(图D)。遂行胸部CT示:右肺上叶占位病变,考虑周围型肺癌,右侧胸膜下结节,转移?纵隔多发淋巴结增大融合、右肺门淋巴结增大融合,肿瘤转移可能(图A)。病人后续转至当地医院肿瘤科继续治疗,行腹部CT示:肝脏多发占位,后拒绝治疗。两月后,因多器官系统衰竭死亡。
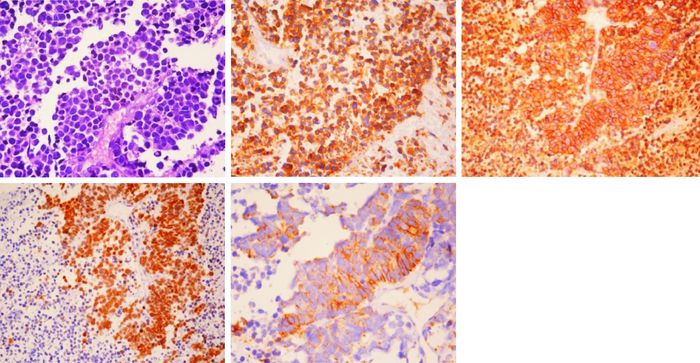
|
| 图 2 D图:光学显微镜所见,HE染色,X400倍,镜下:细胞圆形或卵圆形,呈淋巴细胞样,形态均一,核位于中央,染色质细而弥散呈粉尘状,胞浆稀少呈嗜碱性,细胞弥漫分布,成条索状或小梁状,所见符合小细胞癌。E-H图:光学显微镜所见,X400倍,免疫组化染色。E图:Syn在肿瘤细胞的胞浆呈阳性表达;F图: CD56弥漫表达于肿瘤细胞的细胞膜; G图:TTF1在肿瘤细胞的胞核阳性表达;H图:CK阳性表达于肿瘤细胞的胞浆。 |
垂体转移癌临床十分罕见,极易误诊。多发于60~70岁,男女比例没有明显的差异[1-3]。几乎所有组织的肿瘤都可以转移至垂体,女性主要由乳腺癌转移而来的,猜想可能与垂体的高泌乳素微环境有利于乳腺癌细胞的增殖相关[4, 5];男性主要由肺癌转移而来,其他常见的原发肿瘤有甲状腺癌、肝癌、胃肠道癌、前列腺癌,甲状腺癌,黑色素瘤、肾癌等[3, 6]。国外大样本恶性肿瘤病人尸检时发现有临床症状的垂体转移癌病人仅占6.8%,大部分垂体转移癌没有明显的转移症状,考虑可能是被原发肿瘤晚期表现所掩盖,难以及时发现垂体转移[1, 4, 7]。
症状性垂体转移癌患者往往有以下表现:头痛,视力视野的改变,眼球异常运动,尿崩症,垂体前叶功能不全等[4, 6, 8],考虑为垂体转移癌向蝶鞍的各个方向侵袭,快速生长导致占位效应,或破坏垂体,导致垂体激素水平变化所造成。据文献报道,症状性垂体转移癌病人中,中枢性尿崩症约占42.3%~59%,但中枢性尿崩在垂体腺瘤中罕见[3, 9]。猜测其发生与肿瘤转移至垂体后叶有关,而病理和尸检结果也符合这一猜测:原发肿瘤转移至垂体后叶约占52%,转移至前叶约21%。这一差异可能与垂体后叶直接接受动脉血供,而垂体前叶接受垂体门脉系统供应相关,但具体机制仍不明确[6, 10]。据Al-Aridi[6]报道垂体转移癌患者激素变化以PRL最为常见,但PRL水平一般小于200ng/mL, 考虑由肿瘤压迫垂体柄造成,这点与垂体大腺瘤患者泌乳素水平升高相似[3]。本例患者泌乳素:19.1ng/mL,稍增高,考虑肿瘤压迫垂体柄造成,术前未予处理,术后恢复正常。垂体转移癌患者的促肾上腺皮质激素、促甲状腺激素和促性腺激素降低较垂体腺瘤发生率高。对于垂体激素水平的改变,手术治疗大多无效,激素替代是简单有效的治疗手段。由于垂体转移癌的高增殖性和强侵袭性,垂体转移癌患者的头痛、视力视野改变和眼球运动异常等表现通常较其余鞍区肿瘤进展快。如果患者在有原发肿瘤病史的情况下,出现鞍区占位,并且出现尿崩症、头痛等表现且进展迅速的情况,诊断需考虑垂体转移癌的可能性。影像学检查并不能提供鉴别诊断的价值。MRI上表现为稍长Tl、长T2信号,不均匀强化,缺少正常垂体后叶高信号表现,与垂体腺瘤类似。但垂体转移癌易早期累及鞍上,骑跨鞍隔呈哑铃形;肿瘤侵袭性强,常侵袭鞍旁海绵窦,导致颅神经功能障碍[8, 11, 12];MRI常有上垂体柄增粗,同时病人伴有尿崩症[3, 11]。当出现上述影像学表现时,紧密结合临床症状,如尿崩症、神经功能缺失快速进展等,则更需怀疑垂体转移癌的可能。
垂体转移癌的治疗应为个体化治疗,综合患者原发肿瘤情况、临床症状和身体状况,采取相应的治疗[13, 14]。治疗手段主要有:手术、放疗、化疗和激素替代疗法等。而患者的生存期主要取决于原发肿瘤的类别,但总体预后较差,中位生存期仅为12.9个月[11]。垂体转移癌患者发现转移时,已为原发肿瘤晚期,原发肿瘤多没有手术机会,全身化疗是影响患者总体预后以及无进展生存期的最重要因素。临床中需根据患者的原发肿瘤类型采取相应的全身化疗,靶向治疗等[2]。手术治疗主要适用于有症状的垂体转移癌患者,重在缓解症状,为后续治疗提供病理诊断,但并不能延长垂体转移癌病人的总体生存期,以及纠正转移癌导致的激素紊乱[15, 16]。经鼻内镜、显微镜或开颅手术切除肿瘤安全有效,但垂体转移癌侵袭性强,常破坏鞍底、鞍膈硬脑膜,质地韧,肿瘤与周围组织粘连较紧,血供丰富,难以全切[14, 16]。
放疗在垂体转移癌的治疗中非常重要。同时随着放射治疗技术的发展,立体定向放射外科治疗(stereotactic radiosurgery, SRS)在脑肿瘤的治疗中也扮演着越来越重要的角色。SRS具有精准、有效和风险低等优点,但对于垂体转移癌的治疗仍缺乏数据的支持。笔者综合分析了Kano[13]、Mori[17]和Iwai[18]的案例的38位患者。通过放疗前后垂体功能以及颅神经功能状况对比,肿瘤影像学的表现,来评估立体定向放射治疗的疗效。SRS前,38人中:颅神经异常有23人;SRS后13人得到缓解。影像学表现上:15人肿瘤体积缩小,无进展11人,复发进展4人,有效控制率为86.7%。同时SRS对患者的垂体功能没有明显的影响。虽然病例样本较少,但仍可以看出SRS对于缓解肿瘤压迫导致的颅神经功能缺失症状、缩小肿瘤体积以及延缓其发展有较好的疗效。鉴于垂体转移癌病人生存期短,SRS相比手术痛苦少、风险低,并有较为显著的疗效,可作为尝试的治疗手段之一。
总的来说,垂体转移癌发病率低,临床症状与其余鞍区肿瘤类似,但进展快,影像学无特异性,需紧密联系症状与影像学表现,极易误诊。积极的化疗、合理的手术和立体定向放射外科治疗以及激素替代治疗等能提高患者的生活质量和延长生存时间,但总体预后仍较差。
| [1] |
Siqueira PF, Mathez AL, Pedretti DB, et al. Pituitary metastasis of lung neuroendocrine carcinoma:case report and literature review[J]. Arch Endocrinol Metab, 2015, 59(6): 548-553. DOI:10.1590/2359-3997000000139 |
| [2] |
Park Y, Kim H, Kim EH, et al. Effective Treatment of Solitary Pituitary Metastasis with Panhypopituitarism in HER2-Positive Breast Cancer by Lapatinib[J]. Cancer Res Treat, 2016, 48(1): 403-408. DOI:10.4143/crt.2014.165 |
| [3] |
Komninos J, Vlassopoulou V, Protopapa D, et al. Tumors metastatic to the pituitary gland:case report and literature review[J]. J Clin Endocrinol Metab, 2004, 89(2): 574-580. DOI:10.1210/jc.2003-030395 |
| [4] |
Morita A, Meyer FB, Laws ER Jr. Symptomatic pituitary metastases[J]. J Neurosurgery, 1998, 89(1): 69-73. DOI:10.3171/jns.1998.89.1.0069 |
| [5] |
Peppa M, Papaxoinis G, Xiros N, et al. Panhypopituitarism due to metastases to the hypothalamus and the pituitary resulting from primary breast cancer:a case report and review of the literature[J]. Clin Breast Cancer, 2009, 9(4): E4-7. DOI:10.3816/CBC.2009.n.047 |
| [6] |
Al-Aridi R, El Sibai K, Fu P, et al. Clinical and biochemical characteristic features of metastatic cancer to the sella turcica:an analytical review[J]. Pituitary, 2014, 17(6): 575-587. DOI:10.1007/s11102-013-0542-9 |
| [7] |
Branch CL Jr. , Laws ER Jr.Metastatic tumors of the sella turcica masquerading as primary pituitary tumors[J]. J Clin Endocrinol Metab, 1987, 65(3): 469-474. DOI:10.1210/jcem-65-3-469 |
| [8] |
Ariel D, Sung H, Coghlan N, et al. Clinical characteristics and pituitary dysfunction in patients with metastatic cancer to the sella[J]. Endocr Pract, 2013, 19(6): 914-919. DOI:10.4158/EP12407.OR |
| [9] |
He W, Chen F, Dalm B, et al. Metastatic involvement of the pituitary gland:a systematic review with pooled individual patient data analysis[J]. Pituitary, 2015, 18(1): 159-168. DOI:10.1007/s11102-014-0552-2 |
| [10] |
Teears RJ, Silverman EM. Clinicopathologic review of 88 cases of carcinoma metastatic to the putuitary gland. Cancer, 1975, 36(1): 216-220.
|
| [11] |
Habu M, Tokimura H, Hirano H, et al. Pituitary metastases:current practice in Japan[J]. J Neurosurgery, 2015, 123(4): 998-1007. DOI:10.3171/2014.12.JNS14870 |
| [12] |
肖瑾. 侵袭性垂体腺瘤的诊断和经蝶手术治疗进展[J]. 国际神经病学神经外科学杂志, 2016, 43(4): 367-370. |
| [13] |
Kano H, Niranjan A, Kondziolka D, et al. Stereotactic radiosurgery for pituitary metastases[J]. Surg Neurol, 2009, 72(3): 248-256. DOI:10.1016/j.surneu.2008.06.003 |
| [14] |
Fassett DR, Couldwell WT. Metastases to the pituitary gland[J]. Neurosurg focus, 2004, 16(4): E8. |
| [15] |
Gilard V, Alexandru C, Proust F, et al. Pituitary metastasis:is there still a place for neurosurgical treatment?[J]. J Neuro-oncol, 2016, 126(2): 219-224. DOI:10.1007/s11060-015-1967-y |
| [16] |
Burkhardt T, Henze M, Kluth LA, et al. Surgical management of pituitary metastases[J]. Pituitary, 2016, 19(1): 11-18. DOI:10.1007/s11102-015-0676-z |
| [17] |
Mori Y, Kobayashi T, Shibamoto Y. Stereotactic radiosurgery for metastatic tumors in the pituitary gland and the cavernous sinus[J]. J Neurosurgery, 2006, 105(Suppl): 37-42. |
| [18] |
Iwai Y, Yamanaka K, Honda Y, et al. Radiosurgery for pituitary metastases[J]. Neurol Med Chir (Tokyo), 2004, 44(3): 112-117. DOI:10.2176/nmc.44.112 |
 2017, Vol. 44
2017, Vol. 44




