扩展功能
文章信息
- 阿库布千, 李祥龙, 罗鑫, 冯杰, 周江, 李昊, 刘亮, 陈礼刚, 夏祥国
- AKU BuQian, LI Xiang-Long, LUO Xin, FENG Jie, ZHOU Jiang, LI Hao, LIU Liang, CHEN Li-Gang, XIA Xiang-Guo
- microRNA-195在脑膜瘤中的表达及其功能研究
- Expression and function of microRNA-195 in meningioma
- 国际神经病学神经外科学杂志, 2017, 44(6): 638-641
- Journal of International Neurology and Neurosurgery, 2017, 44(6): 638-641
-
文章历史
收稿日期: 2017-08-29
修回日期: 2017-11-06
microRNAs是一类非编码小分子RNA,通过调节靶基因的表达水平而发挥生物学功能,参与细胞分化、增殖、凋亡等生理过程。越来越多的microRNAs被报道在多种肿瘤组织中表达异常,且与肿瘤的级别、患者预后密切相关[1-3],其功能的研究对肿瘤的诊疗具有重要意义。近期研究表明,miR-195在多种肿瘤组织中表达降低,如结直肠癌、乳腺癌、肝癌、胃癌等[4-6]。MiR-195在脑膜瘤中的表达和功能尚未报道,因此,我们检测了脑膜瘤患者组织中miR-195的表达情况,并在脑膜瘤细胞株IOMM-Lee中研究了miR-195的生物学功能及其作用机制。
1 材料和方法 1.1 主要试剂本研究使用的胎牛血清购自杭州四季青公司,RPMI1640培养基和胰蛋白酶购自Gibco、转染试剂LipofectaminTM RNAiMAX、RNA提取Trizol试剂购自赛默飞世尔科技,CCK-8试剂盒购自日本同仁化学,miR-195、U6引物、SYBR PrimeScript miRNA RT-PCR检测试剂盒购自TaKaRa宝生物工程有限公司,原位杂交试剂盒购自武汉博士德生物工程有限公司,地高辛标记的anti-miR-195探针购自EXIQON公司,双荧光素酶报告系统检测试剂盒购自progema公司。
1.2 临床标本收集2010年11月至2014年5月我院神经外科手术脑膜瘤患者标本54例,其中,高于54岁的患者28例, 低于54岁的患者26例;16例男性和38例女性;良性脑膜瘤(Ⅰ期)37名,非典型性脑膜瘤(Ⅱ期)12名,恶性脑膜瘤(Ⅲ期)7名,患者或家属均知情同意。
1.3 细胞培养和转染人脑膜瘤细胞株IOMM-Lee购自ATCC,采用含10%胎牛血清的RPMI-1640培养基培养,37℃、5% CO2恒温箱中培养。MiR-195 mimic转染IOMM-Lee细胞采用LipofectaminTM,对照为mimic NC(negative control)。
1.3 细胞周期收集细胞后采用预冷的PBS洗细胞两次,加入预冷的70%乙醇重悬细胞,于4℃固定过夜,第二天离心收集细胞,以1mL的PBS洗细胞一次,再加入500uL 50ug/mL溴化乙锭(含100ug/mL RNase A,2% Triton X-100),混匀后4℃避光孵育30分钟。采用BD流式细胞仪检测,计数2~3万个细胞,结果用ModFit软件分析。
1.4 原位杂交组织石蜡切片常规脱蜡后按博士德敏感性加强型原位杂交检测试剂盒I(过氧化物酶)试剂盒进行切片处理,采用地高辛标记的microRNA-195探针进行原位杂交,37℃杂交过夜,采用DAB显色后由两人分别判读染色强度。
1.5 细胞活力检测人脑膜瘤细胞株IOMM-Lee接种于96孔板,每孔1×104个细胞,分别转染阴性对照mimic和miR-195 mimic以后24 h、48 h和72 h检测细胞活力,避光加入CCK-8工作液,每孔10μl,尽量避免产生气泡,在37℃孵育1 h后用酶标仪在450 nm波长处测定各孔的吸光度(A450值),每组设5个重复孔,另设对照孔调零。
1.6 双荧光素酶报告基因将c-myb 3’ UTR克隆至PGL3萤火虫荧光素酶载体,酶切位点为XbaI和FseI,与海参荧光素酶质粒pRL-SV40、miR-195 mimic或mimic control转染至IOMM-Lee细胞后48小时,采用promega试剂盒分别检测萤火虫荧光素梅活性和海肾荧光素酶活性,PGL3-c-myb 3’ UTR与pRL-SV40转染比例为10比1,以pRL-SV40荧光素梅活性为内参计算c-myb转录活性。
1.7 Realtime PCR常规Trizol法提取IOMM-Lee细胞总RNA,每个样品1×106个细胞,设三个复孔,1mL Trizol裂解细胞后加入200μL氯仿,剧烈震荡15 s,静置2 min后4℃低温1200g离心15min,吸取上清与等体积异丙醇混合,静置30 min后4℃低温1200g离心15min,弃上清,70%乙醇洗涤两次后烘干,每个样品溶于20μL DEPC水中。检测c-myb的mRNA水平时,使用Tarara公司逆转录试剂盒去除基因组DNA并进行逆转录,c-myb realtime PCR上游引物:GAAAGCGTCACTTGGGGAAA,下游引物:TGTTCGATTCGGGAGATAATTGGβ-actin上游引物:GTCTGCCTTGGTAGTGGATAATG,下游引物:TCGAGGACGCCCTATCATGG。c-myb的mRNA水平采用2-ΔΔCt法进行计算,以β-actin表达量作为内参。
1.8 统计学分析本研究计量资料以均数±标准差表示,采用SPSS软件进分析,组间比较采用单因素方差分析(one-way ANOVA),P < 0.05认为差异具有统计学意义。
2 结果 2.1 miR-195在脑膜瘤中的表达miR-195在脑膜瘤中表达(见图 1),54例患者中有20例低表达或不表达,与患者的性别和年龄不存在相关性,与患者的肿瘤分级呈负相关(见表 1),肿瘤级别越高,miR-195表达越低(P=0.011)。
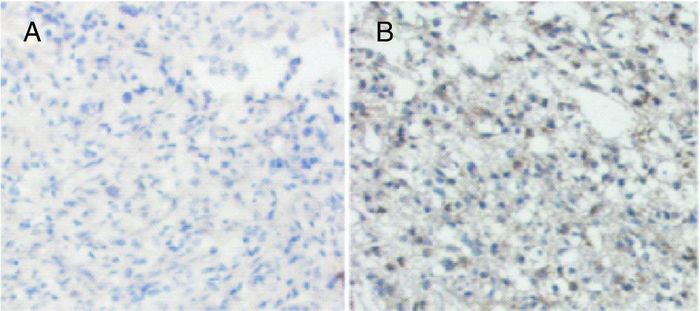
|
| 图 1 miR-195在脑膜瘤中的表达(×200) (A)低表达代表性图片;(B)高表达代表性图片 |
| Total | miR-195 expression | P | ||
| High | Low | |||
| Age | P=0.560 | |||
| ≥54 | 28 | 19 | 9 | |
| < 54 | 26 | 15 | 11 | |
| Gender | P=0.517 | |||
| Male | 16 | 9 | 7 | |
| Female | 38 | 25 | 13 | |
| WHO Grade | P=0.011 | |||
| Ⅰ | 37 | 27 | 10 | |
| Ⅱ | 12 | 6 | 6 | |
| Ⅲ | 5 | 1 | 4 | |
CCK8结果显示,在人脑膜瘤细胞IOMM-Lee中转染miR-195 mimic 24h、48h和72h后细胞活力显著低于对照组(见图 2),该结果提示micorRNA-195能够抑制脑膜瘤细胞的生长。
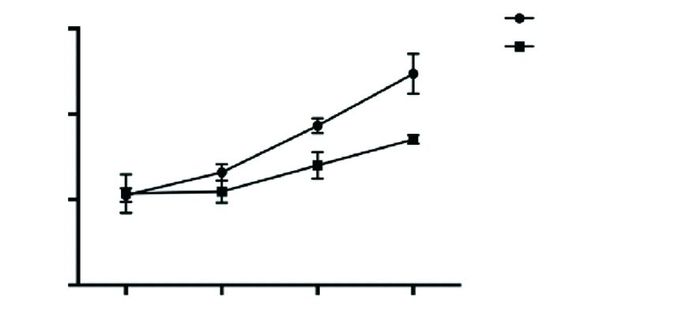
|
| 图 2 micorRNA-195对脑膜瘤细胞活力的影响 |
进一步我们采用PI染色后分析miR-195对脑膜瘤细胞细胞周期的影响。结果显示,与对照组相比,miR-195过表达的细胞G1期比例明显升高,S期比例显著降低,而G2期细胞比例无显著差异(见图 3),表明miR-195可引起脑膜瘤细胞G1期阻滞。
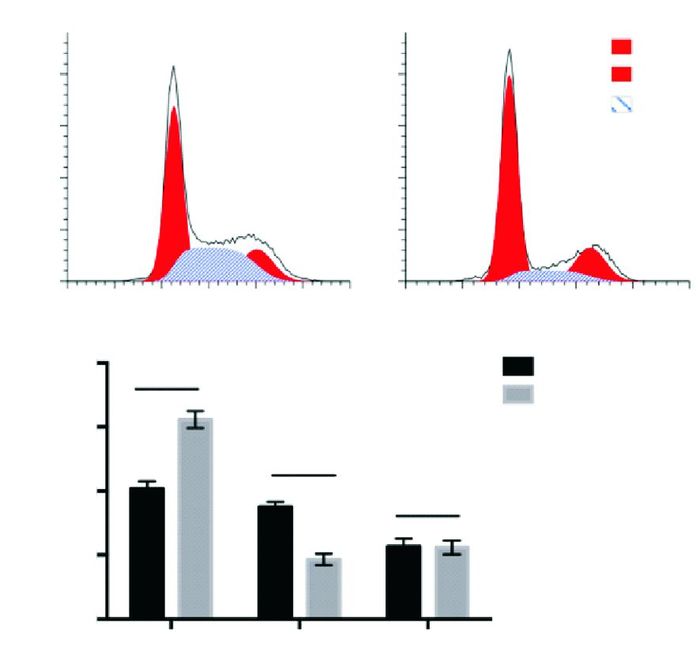
|
| 图 3 micorRNA-195对脑膜瘤细胞细胞周期的影响 (A)PI染色细胞周期分析;(B)两组细胞G1、S、G2期比例统计 |
microRNAs主要通过调节靶基因的表达发挥生物学功能,因此,我们通过microrna.org靶基因预测发现c-myb可能是miR-195的靶基因(图 4A),我们通过荧光素梅报告基因实验验证,结果显示,miR-195确实可以显著降低c-myb的转录活性(图 4B),并抑制c-myb的表达水平(图 4C)。
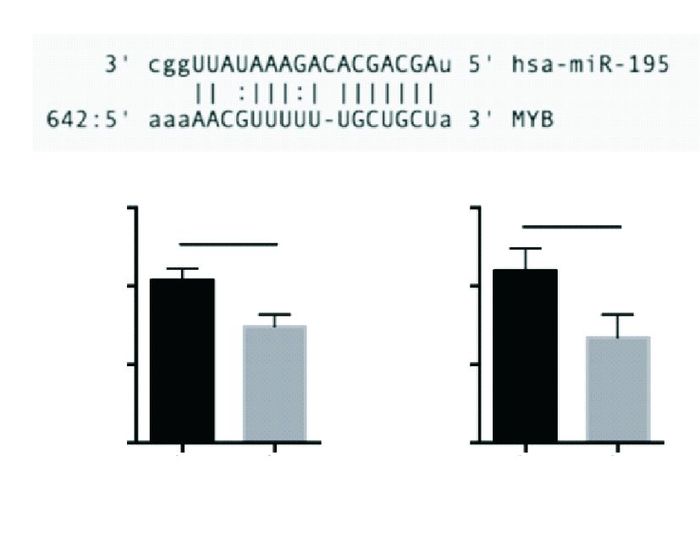
|
| 图 4 miR-195直接靶向调节c-myb的表达 (A)miR-195与c-myb 3’UTR序列比对;(B)双荧光素酶报告系统显示miR-195降低c-myb转录活性;(C)在脑膜瘤细胞中过表达miR-195降低c-myb的表达 |
随着近年来分子生物学的发展,研究发现[7]多个microRNA在脑膜瘤中异常表达,并影响肿瘤细胞的生长和迁移。Kliese等[8]报道miR-145在脑膜瘤中的抗迁移和抗增殖功能,与良性脑膜瘤相比,miR-145的表达在非典型和间变性肿瘤中降低,过表达miR-145的IOMM-Lee脑膜瘤细胞增值能力、侵袭能力均显著下降。
miR-195位于染色体17p13.1,是miR15/16/195/497家族中的重要成员,该家族microRNAs的表达与肿瘤的发生发展关系密切。我们的研究结果显示miR-195在脑膜瘤中呈低表达状态,且其表达水平与WHO分级呈负相关,miR-195在高级别脑膜瘤中的表达水平显著低于良性脑膜瘤。这种低表达可能与基因的杂合性缺失及表观遗传学修饰有关。有研究显示[9],染色体的17pl3.1位于在多种癌症中基因缺失和突变的高发区,而且miR-195启动子区域存在甲基化位点CpG岛,所以启动子区甲基化可能是miR-195表达下调的另一原因。因此认为基因突变和启动子甲基化一起参与miR-195在脑膜瘤中的下调,而基因突变和启动子甲基化与肿瘤的恶性程度有关[9]。为了明确miR-195在脑膜瘤肿瘤细胞中的生物学功能,我们将miR-195转染至IOMM-Lee细胞中,结果显示,与对照组相比,高表达miR-195的脑膜瘤细胞活力显著降低(P < 0.05),细胞周期G1期细胞比例显著增加(P < 0.05),该结果提示,miR-195可引起脑膜瘤细胞周期G1/S期阻滞。我们的研究结果与其他学者[10, 11]在肝癌细胞、宫颈癌细胞、脑胶质瘤细胞中的结果具有一致性。我们通过microrna.org靶基因预测c-myb可能是miR-195的靶基因,并采用荧光素酶报告系统进行了靶点验证。我们realtime PCR结果也显示,miR-195能够在脑膜瘤细胞中靶向抑制c-myb的表达。c-myb是一种在癌细胞中高表达的原癌基因,在细胞增殖、分化和恶性肿瘤的发生、发展中发挥重要作用[12]。miR-195对c-myb的调控作用在肺癌细胞中也曾被报道[13],表明miR-195在不同肿瘤细胞中可能通过类似的作用机制发挥抑癌功能。
综上所述,本研究首次发现miR-195在脑膜瘤中异常表达,且其表达量与肿瘤WHO分级相关,能够通过靶向调节癌基因c-myb的表达,从而引起脑膜瘤细胞周期G1/S期阻滞,抑制肿瘤细胞的生长。
| [1] |
Bagnoli M, Canevari S, Califano D, et al. Development and validation of a microRNA-based signature (MiROvaR) to predict early relapse or progression of epithelial ovarian cancer:a cohort study[J]. Lancet Oncol, 2016, 17(8): 1137-1146. DOI:10.1016/S1470-2045(16)30108-5 |
| [2] |
Liu R, Gu J, Jiang P, et al. DNMT1-microRNA126 epigenetic circuit contributes to esophageal squamous cell carcinoma growth via ADAM9-EGFR-AKT signaling[J]. Clin Cancer Res, 2015, 21(4): 854-863. DOI:10.1158/1078-0432.CCR-14-1740 |
| [3] |
Frampton AE, Castellano L, Colombo T, et al. Integrated molecular analysis to investigate the role of microRNAs in pancreatic tumour growth and progression[J]. Lancet, 2015, 385(Suppl 1): S37. |
| [4] |
Zhang X, Xu J, Jiang T, et al. MicroRNA-195 suppresses colorectal cancer cells proliferation via targeting FGF2 and regulating Wnt/beta-catenin pathway[J]. Am J Cancer Res, 2016, 6(11): 2631-2640. |
| [5] |
Yang B, Tan Z, Song Y. Study on the molecular regulatory mechanism of MicroRNA-195 in the invasion and metastasis of colorectal carcinoma[J]. Int J Clinical Exp Med, 2015, 8(3): 3793-3800. |
| [6] |
Luo Q, Wei C, Li X, et al. MicroRNA-195-5p is a potential diagnostic and therapeutic target for breast cancer[J]. Oncol Rep, 2014, 31(3): 1096-1102. DOI:10.3892/or.2014.2971 |
| [7] |
Kishida Y, Natsume A, Kondo Y, et al. Epigenetic subclassification of meningiomas based on genome-wide DNA methylation analyses[J]. Carcinogenesis, 2012, 33(2): 436-441. DOI:10.1093/carcin/bgr260 |
| [8] |
Kliese N, Gobrecht P, Pachow D, et al. miRNA-145 is downregulated in atypical and anaplastic meningiomas and negatively regulates motility and proliferation of meningioma cells[J]. Oncogene, 2013, 32(39): 4712-4720. DOI:10.1038/onc.2012.468 |
| [9] |
Li D, Zhao Y, Liu C, et al. Analysis of MiR-195 and MiR-497 expression, regulation and role in breast cancer[J]. Clin Cancer Res, 2011, 17(7): 1722-1730. DOI:10.1158/1078-0432.CCR-10-1800 |
| [10] |
Xu T, Zhu Y, Xiong Y, et al. MicroRNA-195 suppresses tumorigenicity and regulates G1/S transition of human hepatocellular carcinoma cells[J]. Hepatology, 2009, 50(1): 113-121. DOI:10.1002/hep.22919 |
| [11] |
Wang N, Wei H, Yin D, et al. MicroRNA-195 inhibits proliferation of cervical cancer cells by targeting cyclin D1a[J]. Tumour Biol, 2016, 37(4): 4711-4720. DOI:10.1007/s13277-015-4292-3 |
| [12] |
Frau M, Ladu S, Calvisi DF, et al. Pascale. Mybl2 expression is under genetic control and contributes to determine a hepatocellular carcinoma susceptible phenotype[J]. J Hepatol, 2011, 55(1): 111-119. DOI:10.1016/j.jhep.2010.10.031 |
| [13] |
Yongchun Z, Linwei T, Xicai W, et al. MicroRNA-195 inhibits non-small cell lung cancer cell proliferation, migration and invasion by targeting MYB[J]. Cancer lett, 2014, 347(1): 65-74. DOI:10.1016/j.canlet.2014.01.019 |
 2017, Vol. 44
2017, Vol. 44




