扩展功能
文章信息
- 李泽, 张志银, 刘志刚, 袁兴, 叶玉勤
- LI Ze, ZHANG Zhi-Yin, LIU Zhi-Gang, YUAN Xin, YE Yu-Qin
- 运动诱发电位对脑动脉瘤蛛网膜下腔出血后迟发性脑血管痉挛的诊断性意义分析
- Value of motor evoked potential in diagnosis of late-onset cerebral vasospasm after aneurysmal subarachnoid hemorrhage
- 国际神经病学神经外科学杂志, 2017, 44(6): 611-615
- Journal of International Neurology and Neurosurgery, 2017, 44(6): 611-615
-
文章历史
收稿日期: 2017-07-12
修回日期: 2017-09-20
2. 第四军医大学西京医院神经外科, 陕西 西安 710032
2. Department of Neurosurgery, Xijing Hospital of Fourth Military Medical University, Xi'an Shaanxi 710032
脑动脉瘤蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage, aSAH)后脑血管痉挛(vasospasm, VS)的发病率和死亡率较高,早期诊断对于尽快启动相关治疗并预防脑梗死和永久性神经功能缺损具有重要意义[1]。目前常用的诊断脑血管痉挛(vasospasm, VS)的方法包括数字减影血管造影(digital subtraction angiography, DSA)、CT血管造影(computed tomography angiography, CTA)和经颅多普勒(transcranial doppler, TCD)等[2-5]。相关文献报道运动诱发电位(motor evoked potential)MEP检查是一种在脑动脉瘤手术中实时和微侵袭性诊断脑缺血和VS的可靠方法[7-12]。有研究发现兔aSAH后VS模型的MEP潜伏期明显增加了,并据此推论MEP对VS的诊断具有重要价值[13]。目前还没有研究对MEP诊断aSAH后迟发性VS的准确性和可靠性进行分析,本研究将对这一问题进行初步探讨。
1 方法 1.1 纳入患者纳入2015年5月~2017年5月在陕西省第四人民医院和第四军医大学西京医院神经外科ICU住院治疗的高分级(Hunt-Hess分级Ⅲ-Ⅴ级)的伴有或不伴有迟发性VS的aSAH患者35例。纳入标准:(1)aSAH患者Hunt-Hess分级Ⅲ-Ⅴ级;(2)脑血管造影证实存在颅内动脉瘤;(3)在对患者进行基线MEP阈值测定时经造影证实无VS;(4)从开始记录MEP阈值到进行脑血管造影之间的时间间隔≤5小时;(5)在进行控制性MEP阈值测定时需要经造影检查证实有无VS;(6)年龄≥20岁。排除标准:(1)意识清醒;(2)颅内压≥20 mmHg;(3)因其他病情而不能进行MEP检查;(4)神经外科医生和放射科医生分析造影结果得出不同结论;(5)需要巴比妥类药物进行麻醉。所纳入患者的临床资料见表 1。陕西省第四人民医院和第四军医大学西京医院伦理委员会批准进行此项研究,所有纳入患者或家属在实施研究前都签署了知情同意书。
| 变量 | 数值 | 数值 |
| 性别(男/女) (n, %) | 20/15 | 57.1/42.9 |
| 年龄(范围, 中位数) (岁) | 20-57 | 37 |
| DSA证实存在颅内动脉瘤(n, %) | 35 | 100 |
| Hunt & Hess分级Ⅲ-Ⅴ级(n, %) | 35 | 100 |
| DSA检查有/无迟发型VS(n, %) | 13/22 | 37.1/62.9 |
| 注:aSAH,动脉瘤蛛网膜下腔出血;DSA,数字减影血管造影;VS血管痉挛。 | ||
MEP的检测和记录是由两名经过专业神经电生理检查培训和具有丰富临床经验的神经外科医师完成的。基线MEP阈值的检测在患者入院和动脉瘤破裂当天进行,并在同一天通过DSA检查排除VS。根据DSA的检查结果,患者在入院后48小时内接受血管内介入栓塞或开颅动脉瘤夹闭治疗。控制性MEP阈值的检测在第一次DSA检查1~19天后的第二次DSA检查前5小时内进行。第二次DSA检查的适应症为经过前述治疗后TCD监测怀疑有VS。
在MEP记录过程中,因患者病情需要而使用的镇静类药物包括异丙酚、芬太尼、咪达唑仑和氯胺酮。记录电极即针刺电极经过皮下插入目标肌肉并和术中神经电生理监测仪的放大器相连接;刺激电极即盘状电极放置于根据国际10-20系统确定的头皮刺激点并与刺激装置相连接。表 2列举出了具体的刺激和记录参数。然后将生物信号窗设定为人工调节模式,通过调整针刺电极的位置来改善记录情况或在有电磁干扰的情况下重置设备参数。起始刺激强度为20mA,然后以每次增加5 mA的方法逐渐提高刺激强度直到在双侧上下肢肌肉都可以记录到稳定的MEP或者直到最大刺激强度达到200 mA。所谓刺激阈值是指在200μV检测敏感性条件下引出目标肌肉清晰可辨和可以重复的MEP所需要的最小刺激强度。首先将1个刺激电极置于C3作为阳极,另一个刺激电极置于C4作为阴极;然后切换刺激电极的极性即将C4作为阳极和C3作为阴极重复刺激一次。如果将刺激电极置于以上两种位置均不能检测到MEP,可以将阳性刺激电极置于Cz和阴性刺激电极置于Fz后重复以上刺激过程。
| 参数 | 数值 |
| 刺激位点 | C3/4; C4/3; Cz/Fz |
| 刺激强度 | 20-200 mA |
| 刺激频率 | 0.5 Hz |
| 刺激间隔 | 5 ms |
| 刺激时长 | 400 μs |
| 显示敏感性 | 200 μV |
| 记录肌肉 | 双侧指伸肌、拇短展肌、胫骨前肌、拇展肌 |
| 注:MEP,运动诱发电位。 | |
患者至少进行两次DSA检查,第一次是在记录基线MEP阈值时,第二次是在记录控制性MEP阈值时(图 1)。第一次DSA检查是为了对患者进行最初的诊断性评价,第二次DSA检查是为了在开颅夹闭或介入栓塞治疗动脉瘤后TCD监测提示存在VS时对是否存在确定性迟发性VS进行判断。血管造影术后迟发性VS是指二维DSA检查提示血管主干直径狭窄30%以上和痉挛部分血管有明显的显影延迟。DSA检查结果以数码的形式存储以便进行后续的分析,然后由不知道MEP记录结果的神经影像医生和血管神经外科医生来独立评估是否存在VS。如果DSA检查结果显示有VS,即可认定该患者有VS。如果神经影像医生和血管神经外科医生根据DSA检查结果得出相矛盾结论,则患者将会被从本研究中剔除。
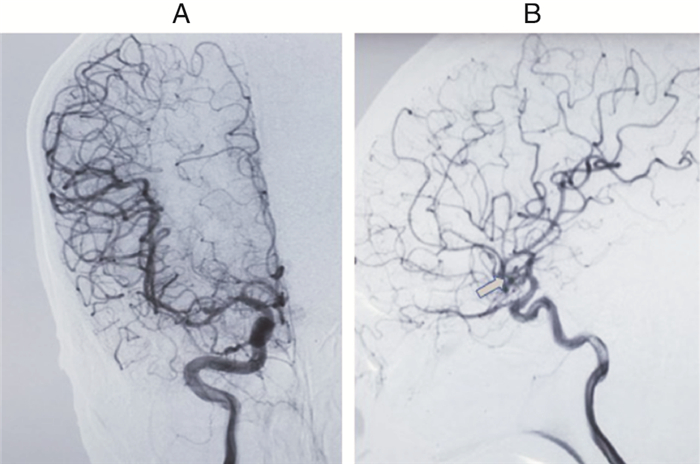
|
| 图 1 动脉瘤患者术前(A)和术后出现VS(B)的DSA影像图。(注:箭头代表VS部位) |
术中MEP研究显示,当大脑运动皮质供血动脉痉挛或出现缺血改变时,将会在其支配肌肉检测到明显增加的MEP阈值或不能检测到MEP 。因此可以预期的结果是:大脑中动脉VS将导致对侧上肢肌肉MEP阈值的增加,而大脑前动脉VS将导致对侧下肢肌肉MEP阈值的增加;供应脑干血流的椎动脉或基底动脉VS将导致对侧下肢和/或上肢肌肉MEP阈值的增加,而供应大脑非运动区域血流的大脑后动脉VS将不会出现任何MEP阈值增加。为了制定适当的诊断标准来判定是否存在VS,本研究计算和比较了大脑运动皮质供血动脉有VS和无VS时其所支配肌肉MEP刺激阈值的平均值和标准差。运用这些结果对有诊断意义的阈值增加值进行界定,并通过计算敏感性、特异性、阳性和阴性预测值来检测MEP诊断VS的准确性。
1.4 统计学分析将患者临床资料和各项检测结果录入Microsoft 2013 Excel建立数据库,采用SPSS 19.0软件对数据进行统计学分析,计量资料以M±SD的形式表示,两组间的比较采用t检验,P<0.05表示有统计学意义。
2 结果 2.1 13例出现和22例未出现迟发型VS的aSAH患者MEP阈值变化比较35例患者的基线MEP阈值和控制性MEP阈值分别在患者入院时未出现VS和完成血管造影检查和治疗后出现VS时进行测定。有无血管造影或治疗后VS即迟发型VS是依据DSA检查结果进行判定的。13例患者在aSAH后5~19天出现了血管造影术性VS,MEP阈值最少增加了45 mA,平均增加了61.55 mA。22例患者在aSAH后1~19天内未出现血管造影术性VS,MEP阈值最多增加了25 mA,平均增加了12.59 mA。两组患者的基线MEP阈值无明显差异(P>0.05),控制性MEP阈值和MEP阈值增加值均有明显差异(P<0.05)。(表 3)
| 记录肌肉 | 基线MEP阈值 | 控制MEP阈值 | MEP阈值增加值 |
| 左侧指伸肌,有VS | 67.6±16.7 | 125.4±18.5 | 57.8±17.2 |
| 左侧指伸肌,无VS | 65.3±15.6 | 74.5±16.2 | 9.2±3.4 |
| P值 | 0.336 | <0.001 | 0.007 |
| 左侧拇短展肌,有VS | 69. 2±15.4 | 129.8±17.9 | 60.6±16.5 |
| 左侧拇短展肌,无VS | 68. 1±14.7 | 81.9±16.1 | 13.8±4.4 |
| P值 | 0.564 | 0.003 | 0.002 |
| 左侧胫骨前肌,有VS | 103.0±19.8 | 166.1±20.7 | 63.1±20.3 |
| 左侧胫骨前肌,无VS | 104.2±17.6 | 117.1±18.5 | 12.9±3.9 |
| P值 | 0.670 | 0.011 | 0.009 |
| 左侧拇展肌,有VS | 110.8±21.4 | 172.8±19.6 | 62.0±20.4 |
| 左侧拇展肌,无VS | 107.3±19.6 | 118.8±19.6 | 11.5±4.1 |
| P值 | 0.276 | 0.002 | <0.001 |
| 右侧指伸肌,有VS | 70.2±17.5 | 134.4±19.6 | 64.2±18.4 |
| 右侧指伸肌,无VS | 72.3±17.7 | 85.1±15.5 | 12.8±4.2 |
| P值 | 0.421 | 0.022 | 0.017 |
| 右侧拇短展肌,有VS | 68.5±18.1 | 134.1±16.2 | 65.6±17.7 |
| 右侧拇短展肌,无VS | 70.3±16.8 | 87.7±15.8 | 17.4±5.1 |
| P值 | 0.257 | 0.005 | 0.004 |
| 右侧胫骨前肌,有VS | 100.4±22.4 | 159.9±21.6 | 59.5±20.8 |
| 右侧胫骨前肌,无VS | 103.6±21.1 | 114.8±17.8 | 11.2±3.8 |
| P值 | 0.410 | <0.001 | 0.003 |
| 右侧拇展肌,有VS | 105.9±20.5 | 165.5±22.8 | 59.6±21.4 |
| 右侧拇展肌,无VS | 102.3±19.2 | 114.2±19.5 | 11.9±4.0 |
| P值 | 0.612 | 0.002 | 0.012 |
| 注:aSAH,动脉瘤蛛网膜下腔出血;VS,血管痉挛;MEP,运动诱发电位。表中数据以平均值±标准差(M±SD)的形式表示,P<0.05代表差异有统计学意义。 | |||
根据前述分析结果,可以认为MEP阈值从基线值到控制值增加45 mA或以上提示存在VS,因此可以通过比较每例患者从基线值到控制值最大增加值并结合DSA检查结果的方法来检测MEP诊断的准确性。35例患者中,11例真阳性,19例真阴性,2例假阳性,3例假阴性。2个假阳性结果出现在由于后交通动脉被夹闭而导致在术后早期出现了脑梗塞的患者,这2个患者的上肢和下肢肌肉均出现了有意义的阈值增加,但因为是由于手术夹闭动脉而不是VS导致的有意义的阈值增加,所以被认为是假阳性。3个假阴性结果出现在局限于右侧或左侧大脑后动脉的VS患者,这3个患者MEP阈值增加的最大值只有20 mA、25 mA和30 mA,所以被认为是假阴性。通过计算MEP阈值从基线值到控制值增加45 mA或以上并结合DSA结果而得出的MEP诊断VS的敏感性为0.85、特异性为0.86、阳性预测值为0.85、阴性预测值为0.86。
3 讨论一些检查方法包括TCD、CTA和DSA等在神经外科临床实践中被很好的运用但各有利弊[2-4, 6, 14-16]。
诊断VS的理想检查方法应该是微创、能床旁操作、费用廉价,且需要有较高的准确性、可以在任何时间重复进行和能尽早提供信息来帮助医生及时开始相关治疗从而预防脑梗塞的出现。已有研究对MEP检查在脑动脉瘤手术中的应用进行了报道[1, 8, 11, 12, 17]。手术过程中的许多因素包括VS、临时夹闭、切开和血管闭塞等都可能干扰病灶部位的血液循环,需要一种敏感性和特异性较高的检查方法在手术中及时提醒手术医师,因此经颅磁刺激或皮层直接刺激主要运动皮质的方法被用来在脑动脉瘤手术过程中产生可在其支配肌肉记录的去极化动作电位[7]。因而评价MEP检查在诊断aSAH后迟发型VS的准确性是非常有意义的。本研究对脑动脉瘤手术过程中MEP监测仪的参数稍作调整后用于检测MEP的刺激阈值。为了将肢体活动程度降至最低从而减少干扰,本研究使用了阈值刺激技巧,即从20mA的刺激强度开始,以每次增加5mA的方式逐渐提高刺激强度。应用这种技术可以检测出引出每个目标肌肉MEP值所需要的的最小刺激强度,即刺激阈值。刺激阈值包括基线MEP阈值和控制性MEP阈值,基线MEP阈值是指在患者刚入院进行DSA检查前未出现VS时检测的刺激阈值,控制性MEP阈值是指在第一次DSA检查后的1~19天TCD监测提示有VS时进行第二次DSA,检查前检测的刺激阈值。DSA是评判有无确定性aSAH后迟发型VS的金标准。通过检测有迟发型VS和无迟发型VS患者的基线MEP阈值和控制性MEP阈值并计算二者差值的方法来检测MEP阈值的增加值。然后将MEP阈值的增加值结果与DSA检查结果相比较,计算出MEP诊断aSAH后迟发型VS的敏感性、特异性、阳性预测值和阴性预测值。有研究报道TCD诊断VS的敏感性为0.77、特异性为0.44[6],MEP比TCD在诊断VS上有更高的敏感性(0.85)和特异性(0.86),但MEP诊断VS的敏感性和特异性都要比DSA低。因MEP和TCD都有各自的局限性,二者的相互结合也许可以有效的降低假阴性结果的比率。本研究对患者进行MEP检查和记录的时间为13~35分钟,这比其他需要搬移患者进行检查的方法要省时得多。MEP诊断VS也存在局限性,首先,MEP检查只对供应大脑运动皮质区域动脉的VS有诊断价值,尽管大脑皮质最重要的区域都可以被MEP检查检测到;其次,MEP检查只能在处于麻醉状态的患者应用,因为清醒患者不能够耐受针刺电极和高强度的电刺激带来的刺痛感。
总之,本研究结果显示MEP检查在诊断aSAH后VS上有较高的准确性,可以作为一种可靠的实时监测VS方法,对现有的诊断VS方法是一种有效的补充,这对于减少VS所致的脑缺血发生具有积极意义。
| [1] |
Steiner T, Juvela S, Unterberg A, et al. European stroke organization guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage[J]. Cerebrovasc Dis, 2013, 35(2): 93-112. DOI:10.1159/000346087 |
| [2] |
Lad SP, Guzman R, Kelly ME, et al. Cerebral perfusion imaging in vasospasm[J]. Neurosurg Focus, 2006, 21(3): E7. |
| [3] |
Bathala L, Mehndiratta MM, Sharma VK. Transcranial doppler:technique and common findings (Part 1)[J]. Ann Indian Acad Neurol, 2013, 16(2): 174-179. DOI:10.4103/0972-2327.112460 |
| [4] |
Mills JN, Mehta V, Russin J, et al. Advanced imaging modalities in the detection of cerebral vasospasm[J]. Neurol Res Int, 2013, 2013: 415960. |
| [5] |
Gollwitzer S, Groemer T, Rampp S, et al. Early prediction of delayed cerebral ischemia in subarachnoid hemorrhage based on quantitative EEG:a prospective study in adults[J]. Clin Neurophysiol, 2015, 126(8): 1514-1523. DOI:10.1016/j.clinph.2014.10.215 |
| [6] |
Kunze E, Pham M, Raslan F, et al. Value of perfusion CT, transcranial Doppler sonography, and neurological examination to detect delayed vasospasm after aneurysmal subarachnoid hemorrhage[J]. Radiol Res Pract, 2012, 2012: 231206. |
| [7] |
Yue Q, Zhu W, Gu Y, et al. Motor evoked potential monitoring during surgery of middle cerebral artery aneurysms:a cohort study[J]. World Neurosurg, 2014, 82(6): 1091-1099. DOI:10.1016/j.wneu.2014.09.004 |
| [8] |
Suzuki K, Mikami T, Sugino T, et al. Discrepancy between voluntary movement and motor-evoked potentials in evaluation of motor function during clipping of anterior circulation aneurysms[J]. World Neurosurg, 2014, 82(6): e739-e745. DOI:10.1016/j.wneu.2013.08.034 |
| [9] |
Kang D, Yao P, Wu Z, et al. Ischemia changes and tolerance ratio of evoked potential monitoring in intracranial aneurysm surgery[J]. Clin Neurol Neurosurg, 2013, 115(5): 552-556. DOI:10.1016/j.clineuro.2012.06.029 |
| [10] |
Shi C, Zhou Q, Zhang M, et al. Assessment of intraoperative motor-evoked potentials for predicting postoperative motor function during the surgical clipping of intracranial aneurysms[in Chinese][J]. Zhong Nan Da Xue Xue Bao Yi Xue Ban, 2012, 37(3): 244-249. |
| [11] |
Szelenyi A, Langer D, Kothbauer K, et al. Monitoring of muscle motor evoked potentials during cerebral aneurysm surgery:intraoperative changes and postoperative outcome[J]. J Neurosurg, 2006, 105(5): 675-681. DOI:10.3171/jns.2006.105.5.675 |
| [12] |
Neuloh G, Schramm J. Monitoring of motor evoked potentials compared with somatosensory evoked potentials and microvascular Doppler ultrasonography in cerebral aneurysm surgery[J]. J Neurosurg, 2004, 100(3): 389-399. DOI:10.3171/jns.2004.100.3.0389 |
| [13] |
Goksel HM, Akgun M, Topalkara K, et al. Evaluation of cerebral vasospasm with transcranial magnetic stimulation:an experimental study[J]. Clin Exp Med, 2001, 1(1): 43-49. DOI:10.1007/s10238-001-8009-0 |
| [14] |
Lee Y, Zuckerman SL, Mocco J. Current controversies in the prediction, diagnosis, and management of cerebral vasospasm:where do we stand?[J]. Neurol Res Int, 2013, 2013: 373458. |
| [15] |
Yao GE, Li Q, Jiang XJ, et al. Vasospasm after subarachnoid hemorrhage:a 3D rotational angiography study[J]. Acta Neurochir Suppl, 2011, 110(pt 2): 221-225. |
| [16] |
Chaudhary SR, K oN, Dillon WP, et al. Prospective evaluation of multidetectorrow CT angiography for the diagnosis of vasospasm following subarachnoid hemorrhage:a comparison with digital subtraction angiography[J]. Cerebrovasc Dis, 2008, 25(1-2): 144-150. DOI:10.1159/000112325 |
| [17] |
Horiuchi K, Suzuki K, Sasaki T, et al. Intraoperative monitoring of blood flow insufficiency during surgery of middle cerebral artery aneurysms[J]. J Neurosurg, 2005, 103(2): 275-283. DOI:10.3171/jns.2005.103.2.0275 |
 2017, Vol. 44
2017, Vol. 44




