扩展功能
文章信息
- 朱葛敏, 闫俊, 赵瑞, 欧阳汤鹏
- ZHU Ge-Min, YAN Jun, ZHAO Rui, YANG Tang-Peng
- 阿米洛利对复杂型热性惊厥的影响
- Effect of amiloride on complex febrile seizures
- 国际神经病学神经外科学杂志, 2017, 44(6): 601-606
- Journal of International Neurology and Neurosurgery, 2017, 44(6): 601-606
-
文章历史
收稿日期: 2017-06-23
修回日期: 2017-11-28
2. 西安市第五医院, 陕西省西安市 710082;
3. 陕西省人民医院神经内一科, 陕西省西安市 710068;
4. 空军青岛航空医学鉴定训练中心, 山东省青岛市 266000
热性惊厥是婴幼儿期最常见的一种抽搐,分为简单型和复杂型两种[1]。其中复杂型热性惊厥对儿童的损伤较大,易反复发作且预后不好,不仅给患儿带来了严重的躯体损害,也常常导致脑内海马局部回路兴奋性增高,以及不同程度的认知功能障碍[2]。因此探索复杂型热性惊厥的防治成为医学领域亟需解决的重要课题。阿米洛利是酸敏感离子通道和钠﹣氢交换体1的非特异性拮抗剂,在戊四氮和匹鲁卡品模型[3, 4]中已证实阿米洛利具有抗癫痫发作的作用,阿米洛利在热性惊厥方面作用尚无报道。本课题拟通过建立热性惊厥模型,探讨阿米洛利对热性惊厥的作用及其可能机制。
1 材料与方法 1.1 实验试剂阿米洛利(Sigma-Aldrich);中性树胶(西安化学试剂厂);胎牛血清(宝信试剂公司);鼠抗神经胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)(Sigma-Aldrich);羊抗鼠Biotin IgG(Abcam);二甲苯(上海山浦化工);TritonX-100(Abcam)。
1.2 实验器材肛温探测仪(FHC);吹风机(Philip);Sony SRW-5800;冰冻切片机(Leica);LeicaDRM显微镜(DM4000B-LED);日本NIKON显微数码图像采集系统;低温高速离心机(eppendorf, 5417R, 5408R);反转录仪器(MJ RESEARCH PTC-200);CFX96TM荧光定量PCR检测系统。
1.3 实验动物与分组SD孕鼠(第四军医大学动物实验中心提供),模型使用出生后10 d(postnatal day 10 P10)雄性SD幼鼠,体重20~24 g,10只一窝,由母鼠喂养。出生后21 d(P21),把仔鼠与母鼠分开,三只仔鼠放入一笼喂养。遵循随机化原则,将40只幼鼠分为4组,具体为正常对照组、热性惊厥组和阿米洛利两种剂量预处理组(即1.3 mg/kg和10 mg/kg)[3, 4]。
1.4 方法 1.4.1 模型的建立参照文献方法[5],造模前皮下注射0.9%生理盐水,实验开始前测量仔鼠中心温度,将仔鼠放置在3升的玻璃容器中,高50厘米处放置一可调节风速的吹风机,热空气保持在41~48℃,中心温度>39.5℃开始记录时间,高热期间中心温度控制在41.5~42℃之间。实验过程中,2 min测一次肛温,抽搐发作30 min后将动物移至温度较低表面,直至其体温完全恢复到基础体温后放回窝内,母鼠喂养。
一般体温在41℃左右仔鼠会出现行为学变化,且其变化大致相同,即到达一高热临界值时在容器中快速移动(高温诱导的运动机能亢进),接着会出现伴有下颌肌阵挛的移动休息期,另一种表现为单/双侧后肢阵挛,最终出现全身强直性抽搐(热性惊厥标准)。实验的观察重点为热性惊厥发作过程中各组仔鼠的表现,具体测量指标为中心体温升高到39.5℃的时间,热性惊厥全身强直发作开始的时间和体温阈值,以及从39.5℃到强直发作的时间间隔。建模前给予对照组腹腔及皮下注射等量生理盐水。
1.4.2 免疫组织化学检测建模3 d后4组动物中各取3只进行灌注取材,制作冰冻切片备用。将切片从冻存液取出后0.01 mol/l(M)磷酸缓冲盐溶液(phosphate buffer saline, PBS)洗涤3次,每次10 min;入80%甲醇:双氧水=100: 1,30 min;入0.01 MPBS 3次,各10 min;抗体稀释液中浸泡30 min;漂片入一抗含小鼠抗GFAP的抗体稀释液中,使用自制湿盒,外用保鲜膜包裹,4℃冰箱过夜。从4℃冰箱中取出脑片,入0.01 MPBS 3次,每次10 min;入二抗生物素化的羊抗小鼠IgG中,室温孵育2 h;入0.01MPBS 3次,每次10 min;入三抗生物素﹣卵白素-HRP复合物,室温孵育2 h。入0.01 MPBS 3次,每次10 min;入DAB染液,如5 min后着色较浅,双氧水加量,并适当延长着色时间;入0.01 MPBS浸泡,用多聚赖氨酸处理过的载玻片裱片;晾干后浸入95%酒精2 min,100%酒精2次,各10 min;二甲苯3次,各10 min,中性树胶封片。
1.4.3 实时荧光定量PCR检测选择建模后第1、3、7天的仔鼠,取出新鲜组织提取mRNA,反转录为cDNA。选用10 μl的荧光反应体系,将各组cDNA加入反应体系中,每组重复3次;使用八连管专用离心机轻微旋转后,将装有荧光反应体系的八连管依次放入实时荧光定量PCR仪中反应2 h,选用相关软件进行数据分析。
1.5 统计学方法计量资料结果均采用均数±标准差(x±s)表示,数据经SPSS 18.0统计软件处理。若仅两组进行比较,采用两样本t检验;若多组间比较,应用One-way ANOVA和Newman-Keuls检验。P<0.05即差异具有统计学意义。
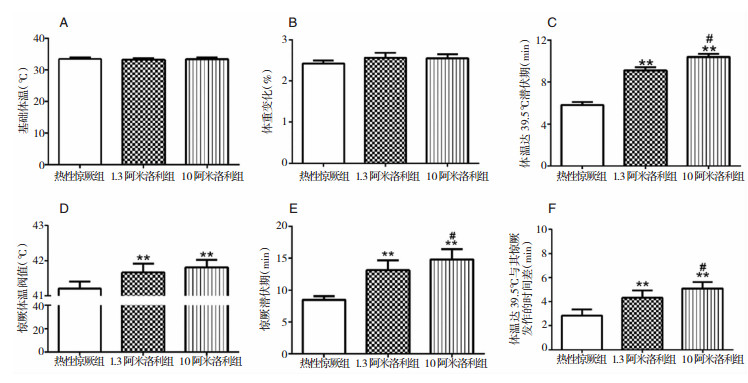
2 结果 2.1 阿米洛利预处理可延迟体温升高及热性惊厥发作的潜伏期在模型建立前1 h给予阿米洛利(1.3 mg/kg和10 mg/kg)腹腔注射。复杂型热性惊厥模型建立过程中各组SD仔鼠均达到全身强直发作,无一只死亡。模型建立前各组仔鼠体温无显著性差异,同时各组仔鼠实验前后体重差的百分比均小于3%,组间无明显差异(P>0.05)。
记录各组SD仔鼠体温达到39.5℃的时间,其中热性惊厥组于4.3~6.8 min体温达到39.5℃,1.3阿米洛利组和10阿米洛利组分别于8.3~10 min和9.3~11.6 min达到39.5℃,后两者体温至39.5℃的时间明显晚于热性惊厥组(P<0.01),且1.3阿米洛利组和10阿米洛利组间有显著性差异(P<0.05)。
在比较全身强直发作时,1.3阿米洛利组发作潜伏期为10.67~14.50 min,体温阈值为41.3~42.1℃,10阿米洛利组潜伏期为12.33~16.60 min,体温阈值为41.4~42.1℃,而热性惊厥组潜伏期为7.67~9.50 min,体温阈值为41.0~41.7℃,1.3和10阿米洛利两组潜伏期较热性惊厥组明显延长,并且全身强直发作的体温阈值明显高于热性惊厥组(P<0.01),阿米洛利高低剂量组间有明显差异(P<0.05)。
各组从达到39.5℃至全身强直发作的时间间隔比较,1.3阿米洛利组为3.67~5.50 min,10阿米洛利组为4.33~5.83 min,而热性惊厥组则为2.17~3.67 min,阿米洛利不同剂量预处理组的时间间隔较热性惊厥组的明显延长(P<0.01),阿米洛利两剂量组间也有显著性差异(P<0.05)。见图 1。
|
| 图 1 SD大鼠体温升高及热性惊厥发作过程中的各项指标 注:* *为与热性惊厥组相比,P<0.01;#为与1.3阿米洛利组相比,P<0.05。 |
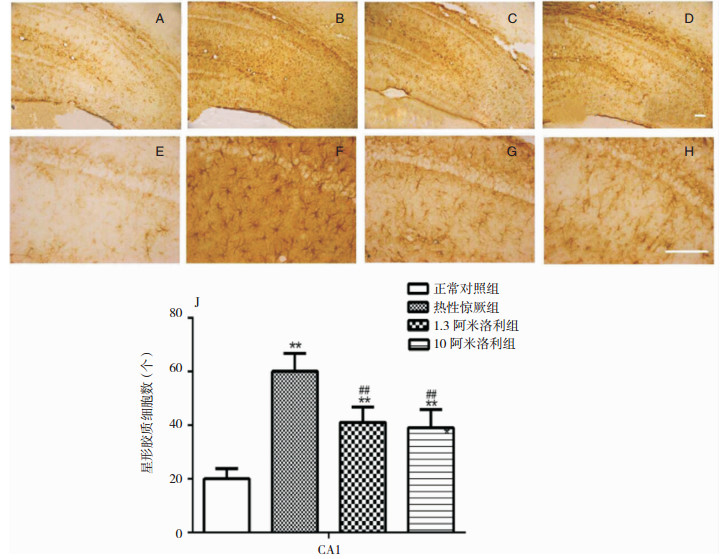
我们使用DAB法标记GFAP,观察热性惊厥后各组动物海马CA1区星形胶质细胞的激活情况。正常对照组中GFAP阳性的星形胶质细胞胞体小、突起细长,热性惊厥组GFAP阳性的细胞数目较之明显增多,突起明显增多、增粗,阿米洛利预处理组GFAP阳性的细胞较正常组增多,而较热性惊厥组明显减少。见图 2。
|
| 图 2 脑片DAB染色(抗GFAP) 注:A-D为海马(10×);E-H为CA1区(40×);I为CA1区星形胶质细胞数量统计图。A、E为正常对照组;B、F为热性惊厥组;C、G为1.3阿米洛利组;D、H组为10阿米洛利组;J为星形胶质细胞计数。* *为与正常对照组相比,P<0.01;##为与热性惊厥组相比,P<0.01。标尺=100 μm。 |
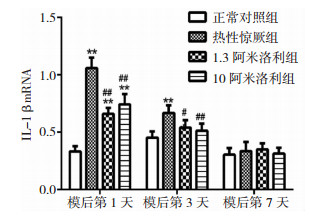
定量PCR显示造模后各处理组IL-1β mRNA含量总体趋势是下降的,其中第1天热性惊厥组IL-1β mRNA含量明显增加,第3天含量虽有所减少,仍明显高于正常对照组,第7天与正常对照组无明显差异。1.3阿米洛利组的IL-1β mRNA含量第1天明显少于热性惊厥组,仍高于对照组,第3天低于热性惊厥组,而与对照组无差别。10阿米洛利组第1天含量明显高于少于热性惊厥组,仍高于对照组,第3天低于热性惊厥组,而与对照组无差别。阿米洛利预处理组间无明显差异。见图 3。
|
| 图 3 热性惊厥后各组IL-1β mRNA含量对比 注:* *为与正常对照组相比,P<0.01;#为与热性惊厥组相比,P<0.01;##为与热性惊厥组相比,P<0.01。 |
婴幼儿热性惊厥是儿科常见疾病之一,可分为简单型和复杂型两种[1],简单型热性惊厥的特点为发作时程短(<10 min),并且24 h内或同次发热疾病中不再发作,没有局灶特征。流行病学研究证实简单型热性惊厥与癫痫发生无相关性[6]。而复杂型热性惊厥是发作时间>10 min的长时程热性惊厥发作(prolonged febrile seizure, PFS),可伴局灶症状,或首次发作后24 h内重复发作。在复杂型热性惊厥儿童中,约有5%~9%的发作长于30 min,达到癫痫持续状态(status epilepticus, SE),占儿童期SE的25%,且其复发率较高,对神经系统造成不同程度的损伤[7]。伴有中央颞叶硬化的癫痫患者中高达40%~60%的有PFS病史[8]。有研究[9]发现复杂型热性惊厥显著特点为适度且重要的轴突重塑,无神经元缺失或神经发生,其中胶质细胞和炎性因子发挥重要作用。
发热导致脑内温度升高,进而通过一些机制影响锥体细胞[7]和中间神经元[10]。研究发现特定离子通道参与其中,如瞬时受体电位香草酸通道亚型1和4受脑内温度调控,与热性惊厥发作有关[11],环核苷酸门控通道[12]和Cav1.2钙通道[13]也与热性惊厥相关。有研究[14]发现代表星形胶质细胞的GFAP和S100β表达量明显增多,提示星形胶质细胞在热性惊厥中发挥作用。临床研究[15, 16]证实炎症是导致热性惊厥发作的一重要因素。对于热性惊厥而言,发热不仅升高脑内温度,还释放大脑内炎症介质,特别是细胞因子IL-1β。IL-1β能增强谷氨酸受体的钙通透性,以及促癫痫发作的激酶活性[17]。已在热性惊厥儿童脑脊液和/或血浆中检测到较高水平的IL-1β[7]。
复杂型热性惊厥常常导致其脑内海马局部回路兴奋性增高[18, 19],以及不同程度的认知功能障碍[20]。因此,探索复杂型热性惊厥的防治成为医学领域亟需解决的重要课题。在以前的戊四氮/匹鲁卡品模型[3, 4]中已证实阿米洛利具有抗癫痫发作的作用,并且提出抗癫痫发作的作用可能与酸敏感离子通道有关。已有研究[21]发现低氧诱导脑缺血模型中阿米洛利的作用优于金刚胺和唑泊来德。阿米洛利在热性惊厥方面的效果如何尚不得而知。
P10-P11仔鼠的海马体相当于人类婴儿期的,模型选用P10-P11仔鼠建超热状况,依赖于热气,升高核心和脑内温度,最终导致癫痫发作。本部分实验采用气浴诱发SD幼鼠热性惊厥,模拟人类儿童复杂型热性惊厥,并造模前给予阿米洛利,观察其是否具有抗热性惊厥作用,同时探索阿米洛利抗热性惊厥作用的机制。
本实验首次研究阿米洛利在热性惊厥中可能起到的作用。研究发现阿米洛利明显减缓体温升高、延长发作潜伏期,并且全身强直发作的体温阈值明显升高,具有显著的抗热性惊厥作用,其中阿米洛利高剂量组较低剂量组明显减缓体温升高,延长强直发作潜伏期,但强直性发作的体温阈值两组间无显著性差异,提示阿米洛利抗热性惊厥的作用与剂量之间有一定的正相关性。通过免疫染色和RT-PCR证实热性惊厥后GFAP和IL-1β表达量明显增加,而阿米洛利预处理后各表达量明显减少,提示阿米洛利具有抑制星形胶质细胞激活,改善炎性水平的作用。
结合已有的文献报道[21],我们推断在复杂型热性惊厥中阿米洛利所表现出来的抗热性惊厥作用可能是通过抑制星型胶质细胞激活,减少炎性因子释放从而发挥作用。但其相关的作用机制还需进一步探讨。
| [1] |
Nelson KB, Ellenberg JH. Predictors of epilepsy in children who have experienced febrile seizures[J]. New Engl J Med, 1976, 295(19): 1029-1033. DOI:10.1056/NEJM197611042951901 |
| [2] |
Martinos MM, Yoong M, Patil S, et al. Recognition memory is impaired in children after prolonged febrile seizures[J]. Brain, 2012, 35(Pt 10): 3153-3164. |
| [3] |
N'Gouemo P. Amiloride delays the onset of pilocarpine-induced seizures in rats[J]. Brain Res, 2008, 1222: 230-232. DOI:10.1016/j.brainres.2008.05.010 |
| [4] |
Ali A, Ahmad FJ, Pillai KK, et al. Amiloride protects against pentylenetetrazole-induced kindling in mice[J]. British J Pharmacol, 2005, 145(7): 880-884. |
| [5] |
Baram TZ, Gerth A, Schultz L. Febrile seizures:an appropriate-aged model suitable for long-term studies[J]. Brain Res Dev Brain Res, 1997, 98: 265-270. DOI:10.1016/S0165-3806(96)00190-3 |
| [6] |
Berg AT, Shinnar S. Unprovoked seizures in children with febrile seizures:short-term outcome[J]. Neurology, 1996, 47(2): 562-568. DOI:10.1212/WNL.47.2.562 |
| [7] |
Shinnar S, Pellock JM, Moshe SL, et al. In whom does status epilepticus occur:age-related differences in children[J]. Epilepsia, 1997, 38(8): 907-914. DOI:10.1111/epi.1997.38.issue-8 |
| [8] |
Theodore WH, Bhatia S, Hatta J, et al. Hippocampal atrophy, epilepsy duration, and febrile seizures in patients with partial seizures[J]. Neurology, 1999, 52(1): 132-136. DOI:10.1212/WNL.52.1.132 |
| [9] |
Chang YC, Huang AM, Kuo YM, et al. Febrile seizures impair memory and cAMP response-element binding protein activation[J]. Ann Neurol, 2003, 54(6): 706-718. DOI:10.1002/(ISSN)1531-8249 |
| [10] |
Kim JA, Connors BW. High temperatures alter physiological properties of pyramidal cells and inhibitory interneurons in hippocampus[J]. Front Cell Neurosci, 2012, 6: 27. |
| [11] |
Hunt RF, Hortopan GA, Gillespie A, et al. A novel zebrafish model of hyperthermia-induced seizures reveals a role for TRPV4 channels and NMDA-type glutamate receptors[J]. Exp Neurol, 2012, 237(1): 199-206. DOI:10.1016/j.expneurol.2012.06.013 |
| [12] |
Nakamura Y, Shi X, Numata T, et al. Novel HCN2 mutation contributes to febrile seizures by shifting the channel's kinetics in a temperature-dependent manner[J]. PloS One, 2013, 8(12): e80376. DOI:10.1371/journal.pone.0080376 |
| [13] |
Radzicki D, Yau HJ, Pollema-Mays SL, et al. Temperature-sensitive Cav1.2 calcium channels support intrinsic firing of pyramidal neurons and provide a target for the treatment of febrile seizures[J]. J Neurosci, 2013, 33(24): 9920-9931. DOI:10.1523/JNEUROSCI.5482-12.2013 |
| [14] |
Yang L, Li F, Zhang H, et al. Astrocyte activation and memory impairment in the repetitive febrile seizures model[J]. Epilepsy Res, 2009, 86(2-3): 209-220. DOI:10.1016/j.eplepsyres.2009.07.001 |
| [15] |
Virta M, Hurme M, Helminen M. Increased plasma levels of pro-and anti-inflammatory cytokines in patients with febrile seizures[J]. Epilepsia, 2002, 43(8): 920-923. DOI:10.1046/j.1528-1157.2002.02002.x |
| [16] |
Zerr DM, Meier AS, Selke SS, et al. A population-based study of primary human herpesvirus 6 infection[J]. New Engl J Med, 2005, 352(8): 768-776. DOI:10.1056/NEJMoa042207 |
| [17] |
Vezzani A, French J, Bartfai T, et al. The role of inflammation in epilepsy[J]. Nat Rev Neurol, 2011, 7(1): 31-40. DOI:10.1038/nrneurol.2010.178 |
| [18] |
Jansen JF, Lemmens EM, Strijkers GJ, et al. Short-and long-term limbic abnormalities after experimental febrile seizures[J]. Neurobiol Dis, 2008, 32(2): 293-301. DOI:10.1016/j.nbd.2008.07.010 |
| [19] |
Toth Z, Yan XX, Haftoglou S, et al. Seizure-induced neuronal injury:vulnerability to febrile seizures in an immature rat model[J]. J Neurosci, 1998, 18(11): 4285-4294. |
| [20] |
周戬平, 王帆, 李瑞林, 等. 热性惊厥对大鼠行为运动及空间学习记忆的影响[J]. 中华儿科杂志, 2004, 42(1): 49-53. |
| [21] |
Tai KK, Truong DD. Amiloride but not memantine reduces neurodegeneration, seizures and myoclonic jerks in rats with cardiac arrest-induced global cerebral hypoxia and reperfusion[J]. PloS One, 2013, 8(4): e60309. DOI:10.1371/journal.pone.0060309 |
 2017, Vol. 44
2017, Vol. 44




