扩展功能
文章信息
- 朱琳, 常履华, 吴倩
- 核分布因子同源蛋白E在神经系统疾病中的作用机制
- 国际神经病学神经外科学杂志, 2017, 44(5): 564-568
-
文章历史
收稿日期: 2017-03-31
修回日期: 2017-09-16
目前,全世界约有五千万癫痫患者,其中30%~40%为难治性癫痫。海马门区中间神经元和CA1和CA3区细胞层锥体细胞坏死和凋亡是癫痫持续状态的特征性病理改变。近年来的研究表明,核分布因子同源蛋白E(nuclear distribution element-like 1, NDEL1)对海马区神经元的弥散迁移、细胞间联系有重要的调控作用。NDEL1是一个由345个氨基酸残基构成的蛋白。NDEL1通过调节染色体排布、纺锤体形成、物质运输以及轴突生长从而参与调控神经元增殖、生长发育、分化及迁移的过程。既往研究表明NDEL1基因突变或缺陷将导致神经元发育以及迁移障碍,诱发无脑回畸形。近年来的研究发现NDEL1还有可能在癫痫、神经退行性疾病中发挥重要调控作用。因此,本文对近年来的相关研究进行回顾,简要阐述NDEL1的功能及其在神经系统疾病中的作用机制。
1 NDEL1的简介NDEL1有两个动力蛋白(dynein)结合区域,分别与动力蛋白中间链(intermediate chain, IC)和重链结合,从而对动力蛋白的功能进行调节。NDEL1在动力蛋白及驱动蛋白的介导下能够延微管运输物质。此外,NDEL1对神经丝轻亚基(neurofilament light subunit, NF-L)[1]和α-微管蛋白[2]和波形蛋白(vimentin)都有重要的调节作用。它促进新形成的微管从中心体释放并投射到神经突,从而对神经突的延伸进行调控[3]。NDEL1还能与桩蛋白(paxillin)结合,增强并稳定新生细胞的黏附性,对细胞迁移进程产生影响。在祖细胞群中,NDEL1聚集在中心体,调节纺锤体的形成、极化以及有丝分裂进程。当NDEL1的羧基端缺乏动力蛋白结合位点时,纺锤体形成及染色体配对出现障碍,从而使细胞有丝分裂停滞。此外,NDEL1的羧基端还能与核纤层蛋白B3(lamin B)结合,与动力蛋白一起调节核纤层蛋白B在微管上的组装,使其定位于纺锤体,稳定纺锤体的形成,并对错误的有丝分裂进程进行修正。NDEL1经Aurora-A和细胞周期蛋白依赖性激酶(cyclin dependent kinase, CDK)中的CDK1、CDK4和CDK5等蛋白修饰成为磷酸化的NDEL1(p-NDEL1),并受到GSK3β(glycogen synthase kinase 3β)和14-3-3ε的调节,从而在神经系统中发挥其相应功能。
2 NDEL1的磷酸化修饰Glover等[4]发现Aurora-A参与有丝分裂中纺锤体形成的调控。NDEL1中位于251位点的丝氨酸能够被Aurora-A磷酸化激活,二者结合形成的Aurora-A/NDEL1复合物参与调节微管的重组,从而调控神经元的增殖和迁移,若通过RNA干扰技术降低Aurora-A的活性或抑制Aurora-A对NDEL1的磷酸化,均会导致神经元的增殖和(或)迁移障碍。在去血清培养的RPE1细胞中,NDEL1能够促进母代细胞中心粒与多毛蛋白结合,从而减少母代细胞中心粒相关的纤毛蛋白经CRL3KCTD17途径被降解。在有丝分裂G1期,稳定的多毛蛋白与Aurora-A结合后刺激Aurora-A自身磷酸化[5],Aurora-A被激活,纤毛轴的微管失去稳定性,发生再折叠,抑制增殖的子代细胞中原纤毛的形成[6], 有丝分裂进程被抑制在G1期,从而影响神经元增殖。
NDEL1的磷酸化还受到CDK5(cyclin dependent kinase 5)的调控,在NDEL1上有5个CDK5的磷酸化位点,P35和P25同为CDK5的调节亚基,CDK5和P35结合形成的二聚体复合物在神经元的发育和迁移中起到重要作用。Pandey等学者认为CDK5促进了轴突中LIS1/NDEL1/Dynein介导的溶酶体的双向运输。在生理状态下,P35激活CDK5后使NDEL1磷酸化,从而促进LIS1/NDEL1/Dynein复合物的形成,该三聚体使动力蛋白与微管不容易分离并延着微管有序地运输溶酶体、线粒体等物质;在应激状态下,CDK5被P25异常激活,经LIS1/NDEL1/Dynein途径延轴突的物质运输被破坏,线粒体、溶酶体等在局部堆积,不能运输到目的位置发挥作用,导致细胞功能障碍[7]。另有研究表明NDEL1能被CDK1和CDK5不同程度地磷酸化,当NDEL1被CDK1和CDK5双重磷酸化时,通过免疫共沉淀可以检测到LIS1/NDEL1复合物与动力蛋白的结合减少,提示NDEL1的磷酸化能促进其与LIS1蛋白的结合,形成LIS1/NDEL1复合物,还能使LIS1/NDEL1复合物从动力蛋白上释放[8]。
编码14-3-3ε的YWHAE基因是精神分裂症的易感基因之一,在脑中广泛表达。相关证据表明14-3-3ε与突触功能及神经系统的功能如学习、记忆等有关。14-3-3ε与NDEL1的羧基端以及DISC1结合从而发挥作用。同时,14-3-3ε与p-NDEL1结合后还能保护p-NDEL1不被PP2A磷酸酶去磷酸化。还有研究报道14-3-3ε与LIS1、DCX、NDEL1经同一条途径调节细胞内动力蛋白的定位和功能,但其具体作用机制尚待研究。
GSK3β能够调节驱动蛋白依赖的轴突运输。研究结果表明,在哺乳动物细胞中,GSK3β对动力蛋白有直接调节作用[9]。动力蛋白是微管参与细胞物质运输的马达蛋白(motor protein)之一,磷酸化动力蛋白中间链,能降低其与NDEL1的结合能力。动力蛋白中间链有不同的亚型,其中,IC-1B亚型的S-87、T-88位点和IC-2C亚型的S-88、T-89位点都是GSK3β结合的靶位点,这些位点包含了NDEL1的结合位点,GSK3β作用于这些区域时,使得动力蛋白与NDEL1的结合减少,从而影响哺乳动物轴突的逆向运输和非神经元细胞中的物质运输。
综上所述,正因p-NDEL1在细胞有丝分裂和物质运输中具有重要的调控作用,所以NDEL1及其磷酸化很可能与无脑回畸形、癫痫和神经退行性疾病等中枢神经系统疾病的发病机制有关。
3 NDEL1相关的中枢神经系统疾病 3.1 无脑回畸形无脑回畸形是神经元迁移缺陷引起的以大脑表面平滑、皮质增厚、侧脑室扩大为特征,以智力受损、继发癫痫等临床表现为特点的一类神经系统疾病。Lissencephaly 1(lis1)基因是无脑回畸形的致病基因[10],杂合子突变或者lis1缺陷都会导致神经元迁移缺陷从而诱发无脑回畸形。NDEL1通过氨基端卷曲螺旋域的LIS1结合区域与LIS1结合并发生相互作用:①NDEL1不仅能够调控LIS1/Dynein复合物的结合,调控轴突中线粒体的逆向运输,还能激活LIS1/Dynein复合物,促使LIS1在中心体周围积累, 募集着丝粒而促进有丝分裂后期染色体的分离;②LIS1能够增强动力蛋白与微管的亲和力,促进LIS1/NDEL1/Dynein复合物与微管的结合,增强星体微管正末端的动力,在细胞有丝分裂中激活动力蛋白从而促进纺锤体的正确定位[11]。因而,最终确保有丝分裂的完成,生物遗传信息的完整传递。
通过基因打靶技术或RNA干扰技术在小鼠胚胎期使lis1或ndel1基因缺陷或沉默,会导致小鼠在出生早期出现神经元迁移功能障碍;而ndel1的过表达能够在一定程度上逆转lis1基因缺陷导致的神经元迁移缺陷[12]。近年来NDEL1在无脑回畸形中的作用机制引起了学者的关注,上调NDEL1蛋白或者稳定LIS1蛋白的表达很可能为治疗无脑回畸形提供新思路。
3.2 癫痫癫痫是由于脑部神经元高度异常同步放电引起的一组综合征,海马门区(hilus)中间神经元和CA1、CA3区细胞层锥体细胞的坏死和凋亡是癫痫持续状态(status epilepticus, SE)的特征性病理改变;SE还会导致颗粒层细胞突触的重建以及颗粒层细胞的弥散迁移。沉默或敲除ndel1基因不仅会抑制CA2、CA3、齿状回区(dentate gyrus, DG)锥体神经元以及颗粒细胞的弥散迁移,还抑制了CA1区树突的分支以及生长,破坏细胞间的联系[13-15]。因此,NDEL1很有可能在癫痫疾病过程中发挥重要调控作用。Wu等[16]研究者发现在匹罗卡品诱导的自发性痫性发作的C57BL/6小鼠模型中,NDEL1和DISC1蛋白在小鼠海马的整体表达水平上调,磷酸化ERK的表达水平也上调,提示NDEL1可能通过与DISC1结合后激活ERK信号通路从而在自发性痫性发作中发挥保护作用。另外,Choi等[17]发现,匹罗卡品诱导的痫性发作致使CREB(cAMP-response element binding protein, CREB)磷酸化,促进CRE(cAMP-response element, CRE)介导的基因表达,经CREB/CRE转录途径调节,NDEL1蛋白在海马的总体表达水平上调并且在修复重塑时期仍然持续高水平表达。上述研究均认为,NDEL1在癫痫的发生发展中有重要的调控作用。然而,前者的研究发现癫痫导致NDEL1在CA3区及DG区表达下降,而在门区增生血管中表达上调,认为NDEL1不仅与癫痫后海马各层神经元的生长发育相关,还与海马区血管新生有关;而后者的研究发现,在癫痫病程中,NDEL1在海马全层均有持续性高表达,研究结果的不同可能由多种因素引起。此外,还有研究发现,在失神癫痫大鼠模型(Wistar albino glaxo/rij)中,丘脑NDEL1蛋白的表达明显升高,可能通过mTOR信号通路参与到癫痫发病的过程之中[18]。
3.3 神经退行性疾病神经退行性疾病是一类由神经细胞和(或)组织变性、丢失,功能异常所致的疾病。NDEL1参与了细胞骨架相关蛋白、细胞周期、神经元生长发育以及物质运输过程的调节,因此成为了神经退行性疾病研究中潜在的靶蛋白,出生后NDEL1缺陷的小鼠可出现神经退行性变[1]。在成熟的神经系统中,NDEL1与神经丝(neurofilament, NF)结合,促进神经丝的聚集,NF参与细胞骨架的构成,为细胞提供机械强度支持,参与细胞内信息传递以及物质运输。在退行性变小鼠模型中,NDEL1水平发生改变,并出现NF-L聚合缺陷,并且这些改变与疾病的进展相关,提示NDEL1可能通过调节NF的聚合参与神经退行性疾病的发生发展。在小鼠肌萎缩性脊髓侧索硬化症(amyotrophic lateral sclerosis, ALS)模型中,中枢神经系统的NDEL1水平降低,并出现物质运输障碍、运动神经元退化及麻痹。同时,在小鼠ALS模型中还观察到CDK5的异常活化[19],P25激活CDK5,破坏NDEL1/LIS1/Dynein途径延轴突的物质运输,使得细胞胞体及邻近轴突中的线粒体、溶酶体等物质堆积[7, 20]。因此,NDEL1与NF-L的相互作用以及CDK5对NDEL1的磷酸化调节均可能与神经退行性疾病的发生发展有关。在上述研究的基础上,Nicholas等[3]学者提出NDEL1还可能与阿尔兹海默病(Alzheimer disease, AD)、颞叶痴呆(frontotemporal dementia)、腓骨肌萎缩症(Charcot-Marie-Tooth, CMT)等疾病的发病机制有关。
3.4 酒精暴露研究表明,孕期酒精暴露使得子代大脑发育过程中树突分支缺陷,从而影响大脑正常功能。目前仅有一篇文献报道了NDEL1在发育期酒精暴露中的作用。在C57BL/6小鼠发育过程中,酒精暴露导致小鼠NDEL1的巯基﹣亚硝基化水平降低,使得树突分支减少,导致神经系统功能缺陷。与杂合子C57BL/6小鼠相比,前额叶皮质ndel1条件敲除的C57BL/6小鼠的神经系统发育过程中树突分支明显减少。经RNA干扰技术使ndel1沉默表达,C57BL/6小鼠树突分支明显减少,而导入杂合子ndel1或C-203位点被色氨酸取代的ndel1则能改善这一现象。在C57BL/6小鼠出生后第四天到第七天腹腔注射酒精,在血液中维持一定水平的酒精浓度,检测其前额叶皮质NDEL1的巯基亚硝基化水平,发现NDEL1巯基-亚硝基化水平上调的小鼠发育期酒精暴露后树突分支并无明显减少,提示NDEL1的巯基-亚硝基化水平降低可能是神经系统发育过程中酒精暴露致病的潜在病理机制[21]。
4 小结综上所述,NDEL1经磷酸化以及巯基-亚硝基化途径被激活,对细胞有丝分裂、细胞骨架蛋白、细胞内物质运输进行调节,从而在神经元发生、增殖、分化、迁移、定位等过程中发挥功能,参与调控无脑回畸形、癫痫、神经退行性疾病等神经系统疾病的病程发展。然而,其具体的分子生物学及病理生理学机制仍有待进一步的探究。
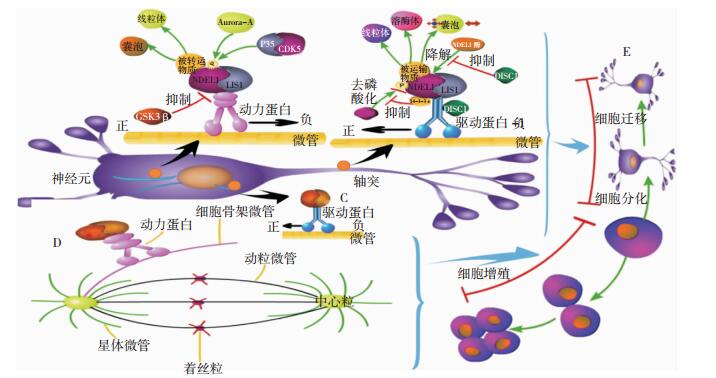
|
| 图 1 NDEL1示意图 注:A:在动力蛋白依赖的运输中,CDK5与Aurora-A磷酸化NDEL1,p-NDEL1与LIS1形成复合物,经动力蛋白延微管运输,将线粒体、囊泡等物质运输到细胞核,GSK3-β可以抑制NDEL1与动力蛋白的结合,从而与CDK5、Aurora-A共同调节NDEL1/LIS1与动力蛋白的结合。B:在轴突中,NDEL1/LIS1在驱动蛋白介导下延微管向轴突远端运输线粒体、溶酶体等物质;14-3-3ε能保护p-NDEL1不被PP2A去磷酸化;DISC1保护NDEL1不被NDEL1酶降解,同时还能与驱动蛋白重链结合,促进NDEL1/LIS1/14-3-3ε经驱动蛋白介导的运输,这对轴突的形成及生长有重要意义。C:与线粒体、囊泡分离后的LIS1/Dynein经驱动蛋白运输至胞质,参与到下一次的物质运输中。D:NDEL1/LIS1经动力蛋白延细胞骨架微管运输到中心体,使得LIS1在中心体周围聚集,增强星体微管动力,促进纺锤体的正确定位,并能够通过募集着丝粒以确保有丝分裂后母代遗传信息均匀完整地分配到子代。E:ABCD均是神经元增殖、分化及迁移过程中重要进程。 |
| [1] |
Nguyen MD, Shu T, Sanada K, et al. A NUDEL-dependent mechanism of neurofilament assembly regulates the integrity of CNS neurons[J]. Nat Cell Biol, 2004, 6(7): 595-608. DOI:10.1038/ncb1139 |
| [2] |
Blizzard CA, King AE, Vickers J, et al. Cortical murine neurons lacking the neurofilament light chain protein have an attenuated response to injury in vitro[J]. J Neurotrauma, 2013, 30(22): 1908-1918. DOI:10.1089/neu.2013.2850 |
| [3] |
Bradshaw NJ, Hayashi MA. NDE1 and NDEL1 from genes to (mal) functions:parallel but distinct roles impacting on neurodevelopmental disorders and psychiatric illness[J]. Cell Mol Life Sci, 2017, 74(7): 1191-1210. DOI:10.1007/s00018-016-2395-7 |
| [4] |
Takitoh T, Kumamoto K, Wang CC, et al. Activation of Aurora-A is essential for neuronal migration via modulation of microtubule organization[J]. J Neurosci, 2012, 32(32): 11050-11066. DOI:10.1523/JNEUROSCI.5664-11.2012 |
| [5] |
Inoko A, Matsuyama M, Goto H, et al. Trichoplein and Aurora A block aberrant primary cilia assembly in proliferating cells[J]. J Cell Biol, 2012, 197(3): 391-405. DOI:10.1083/jcb.201106101 |
| [6] |
Inaba H, Goto H, Kasahara K, et al. Ndel1 suppresses ciliogenesis in proliferating cells by regulating the trichoplein-Aurora A pathway[J]. J Cell Biol, 2016, 212(4): 409-423. DOI:10.1083/jcb.201507046 |
| [7] |
Klinman E, Holzbaur EL. Stress-Induced CDK5 Activation Disrupts Axonal Transport via Lis1/Ndel1/Dynein[J]. Cell Rep, 2015, 12(3): 462-473. DOI:10.1016/j.celrep.2015.06.032 |
| [8] |
Hebbar S, Mesngon MT, Guillotte AM, et al. Lis1 and Ndel1 influence the timing of nuclear envelope breakdown in neural stem cells[J]. J Cell Biol, 2008, 182(6): 1063-1071. DOI:10.1083/jcb.200803071 |
| [9] |
Gao FJ, Hebbar S, Gao XA, et al. GSK-3beta Phosphorylation of Cytoplasmic Dynein Reduces Ndel1 Binding to Intermediate Chains and Alters Dynein Motility[J]. Traffic, 2015, 16(9): 941-961. DOI:10.1111/tra.2015.16.issue-9 |
| [10] |
Reiner O, Carrozzo R, Shen Y, et al. Isolation of a Miller-Dieker lissencephaly gene containing G protein beta-subunit-like repeats[J]. Nature, 1993, 364(6439): 717-721. DOI:10.1038/364717a0 |
| [11] |
Moon HM, Youn YH, Pemble H, et al. LIS1 controls mitosis and mitotic spindle organization via the LIS1-NDEL1-dynein complex[J]. Hum Mol Genet, 2014, 23(2): 449-466. DOI:10.1093/hmg/ddt436 |
| [12] |
Shu T, Ayala R, Nguyen MD, et al. Ndel1 operates in a common pathway with LIS1 and cytoplasmic dynein to regulate cortical neuronal positioning[J]. Neuron, 2004, 44(2): 263-277. DOI:10.1016/j.neuron.2004.09.030 |
| [13] |
Hippenmeyer S, Youn YH, Moon HM, et al. Genetic mosaic dissection of Lis1 and Ndel1 in neuronal migration[J]. Neuron, 2010, 68(4): 695-709. DOI:10.1016/j.neuron.2010.09.027 |
| [14] |
Youn YH, Pramparo T, Hirotsune S, et al. Distinct dose-dependent cortical neuronal migration and neurite extension defects in Lis1 and Ndel1 mutant mice[J]. J Neurosci, 2009, 29(49): 15520-15530. DOI:10.1523/JNEUROSCI.4630-09.2009 |
| [15] |
Jiang Y, Gavrilovici C, Chansard M, et al. Ndel1 and Reelin Maintain Postnatal CA1 Hippocampus Integrity[J]. J Neurosci, 2016, 36(24): 6538-6552. DOI:10.1523/JNEUROSCI.2869-15.2016 |
| [16] |
Wu Q, Li Y, Shu Y, et al. NDEL1 was decreased in the CA3 region but increased in the hippocampal blood vessel network during the spontaneous seizure period after pilocarpine-induced status epilepticus[J]. Neuroscience, 2014, 268(30): 276-283. |
| [17] |
Choi YS, Lee B, Hansen KF, et al. Status epilepticus stimulates NDEL1 expression via the CREB/CRE pathway in the adult mouse brain[J]. Neuroscience, 2016, 331(7): 1-12. |
| [18] |
Gurol G, Demiralp DO, Yilmaz AK, et al. Comparative proteomic approach in rat model of absence epilepsy[J]. J Mol Neurosci, 2015, 55(3): 632-643. DOI:10.1007/s12031-014-0402-8 |
| [19] |
Cozzolino M, Pesaresi MG, Gerbino V, et al. Amyotrophic lateral sclerosis:new insights into underlying molecular mechanisms and opportunities for therapeutic intervention[J]. Antioxid Redox Signal, 2012, 17(9): 1277-1330. DOI:10.1089/ars.2011.4328 |
| [20] |
Pandey JP, Smith DS. A Cdk5-dependent switch regulates Lis1/Ndel1/dynein-driven organelle transport in adult axons[J]. J Neurosci, 2011, 31(47): 17207-17219. DOI:10.1523/JNEUROSCI.4108-11.2011 |
| [21] |
Saito A, Taniguchi Y, Kim SH, et al. Developmental Alcohol Exposure Impairs Activity-Dependent S-Nitrosylation of NDEL1 for Neuronal Maturation[J]. Cereb Cortex, 2017, 27(8): 3918-3929. |
 2017, Vol. 44
2017, Vol. 44




