扩展功能
文章信息
- 娄安辉, 叶钦勇
- 酪蛋白线粒体基质缩氨酸酶蛋白水解亚基与神经变性疾病关系的研究进展
- 国际神经病学神经外科学杂志, 2017, 44(5): 554-558
-
文章历史
收稿日期: 2017-05-22
修回日期: 2017-09-20
2. 福建医科大学附属协和医院神经内科/福建医科大学脑血管病研究室/福建医科大学分子神经 病学重点实验室, 福建省福州市 350001
在线粒体功能发生障碍,尤其是在线粒体蛋白质稳态失衡的情况下,线粒体蛋白酶对保护蛋白质和对受损伤的蛋白质的清除至关重要[1]。线粒体生物学最新进展显示,调控线粒体功能的蛋白酶具有多样性和复杂性,除了有非特异性降解功能,其还对蛋白水解反应进行高度调节,这在线粒体的功能、完整性以及稳态中起重要作用[2, 3]。目前,根据其所在位置对线粒体蛋白酶进行分类,主要位于线粒体基质、外膜、内膜和膜间隙。而在线粒体基质中,起主要作用的蛋白酶是酪蛋白线粒体基质缩氨酸酶蛋白水解亚基(caseinolytic mitochondrial matrix peptidase proteolytic subunit, ClpP)和线粒体离子肽酶1(lon peptidase 1-mitochondrial, LON, LONP1)。ClpP一般活性较低,需与ATP酶亚基(ClpA/ClpX等)结合成Clp复合物才能有效地发挥功能。线粒体蛋白酶受损或功能失调和神经变性疾病、代谢综合征以及癌症等疾病有关[4-6]。本文主要从Clp复合物、ClpP的结构和功能以及ClpP在神经变性疾病所起的作用等方面进行总结。
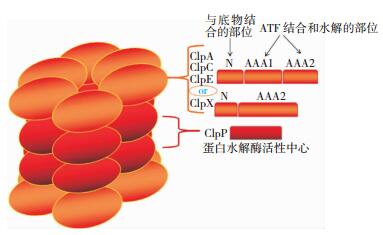
1 Clp蛋白酶结构和功能区 1.1 Clp蛋白酶的结构简介线粒体基质中的酪蛋白酶(caseinolytic protease, Clp)由酪蛋白水解蛋白酶家族成员组成,包含ClpAP、ClpCP、ClpEP、ClpXP和ClpYQ,其存在于原核、真核细胞、藻类和植物细胞叶绿体中。他们以包含两个功能性元素的复合体形式活跃,该复合物形式为:一个蛋白质水解亚基(ClpP或ClpQ)被夹在两个活化的ATP酶的分子伴侣环之间(ClpA、ClpC、ClpE、ClpX或ClpY),一般取决于物种[7]。ClpP能与任何伴侣分子(ClpA、ClpC、ClpE和ClpX)相互作用,但ClpQ仅能与ClpY组装在一起形成ClpYQ复合物,又称HslUV[8]。
1.2 Clp蛋白酶的功能区该蛋白酶的核心由两个堆积的ClpP或两个堆积的ClpQ七聚体组成,ClpP蛋白含有丝氨酸蛋白酶活性位点;ClpQ蛋白酶含有苏氨酸蛋白酶活性位点。在联结为双环之前,单个的ClpP环先形成。其分子伴侣亚基组成有两种类型:Ⅰ类是ClpA、ClpC和ClpE,其包含含有负责ATP的结合与分解的两个连续的AAA模型的单体。Ⅱ类(ClpX和ClpY)仅含有一个AAA模型。所有的伴侣分子有一个N端结构域用于与底物结合。分子伴侣是环形的六聚体,其被组装在中心孔周围[9]。
ClpX几乎存在于所有细菌中,而ClpA存在于革兰阴性菌中,ClpC存在于革兰阳性菌、蓝藻菌中,ClpYQ和ClpAP活性形式存在于大部分细菌以及某些革兰阳性菌中。ClpAP、ClpXP和ClpYQ共存于大肠杆菌中。而只有ClpXP复合体存在于人类。
多数Ⅰ类Clp分子伴侣需要存在于核苷酸中以保持低聚态,在它与蛋白水解亚基结合之前需要维持六聚体结构。根据蛋白酶(七聚体的ClpP和ClpQ)的不同,该结构也不同。
蛋白酶底物被分子伴侣亚基识别和展开,然后通过其中心孔转移到蛋白酶室,由蛋白酶将底物水解为5~10个氨基酸形式的长肽。ClpX和ClpA以环状形式定位在底物蛋白的中央通道,识别它们的终端序列或标签。然后,由特殊的Clp ATP酶结构操作展开的过程:环状的窄口参与亚基的结合,而底物在一个无明显序列亲和性的中央通道被展开并被转移到蛋白酶球面被降解。
蛋白水解的核心ClpP或ClpQ包含疏水槽,该区域结合候选的蛋白以备降解并容纳起催化作用的天冬氨酸﹣组氨酸﹣丝氨酸三联体。这种进行性降解的机制导致产生肽类,其长度在蛋白酶亚基的控制中,至少在ClpP亚基中。
ClpP蛋白酶,由ClpP基因编码,其属于蛋白酶家族S14,并且在ATP和镁的存在下,能水解无效蛋白为小肽。这种蛋白被运输到线粒体基质中,且与线粒体内膜相关。Clp复合物家族在物种进化过程中是高度保守的,从细菌基质到人类线粒体中都能检测到该蛋白酶的同源类似物。该复合物主要由两部分构成,即由ClpP蛋白酶亚基和Clp ATP酶亚基构成。ClpP蛋白酶是细胞内一种重要的热休克蛋白(heat-shock protein),在体内主要发挥蛋白水解酶作用,降解异常蛋白或短寿期蛋白。ClpP作为蛋白酶亚基常与ATP酶亚基(ClpA/ClpX等)结合成Clp复合物,共同行使蛋白酶的功能[10]。
目前,ClpP的功能尚不明确。研究发现ClpP类似于LON蛋白酶,被认为是一种应激蛋白,在真核生物和原核生物中,应激诱导其表达[11]。在细胞受损的情况下,线粒体中异常聚集的蛋白质刺激线粒体产生应激,触发线粒体未折叠蛋白反应(mitochondrial unfolded protein response, UPRmt),该反应通过线粒体至核的信号通路来实现,并导致基因编码的线粒体分子伴侣和蛋白酶被激活[12]。而ClpP作为UPRmt的重要参与者,在所有已知的蛋白质中,这种蛋白在质量控制活动中更重要[13]。Gispert等[11]研究发现,在秀丽隐杆线虫研究中,UPRmt被激活情况下,ClpP将线粒体中错误折叠的蛋白质降解为肽类,这些肽类被运输至细胞质,再激活线粒体蛋白质量控制体系组件的表达,如ClpP、LON的表达。Fischer等[14]研究发现敲除蕨麻中编码ClpP的基因,能延长其寿命,而这种效应能被人类ClpP基因的过表达逆转。
3 ClpP与神经变性疾病 3.1 ClpP与帕金森病线粒体功能障碍与许多帕金森病(Parkinson’s disease, PD)基因的突变有关,这在散发性PD中已有报道,这也表明线粒体动态平衡和PD之间有关联。例如,在散发性PD患者脑内表现出线粒体复合体Ⅱ的活性有选择性的缺失(通过某一不明确的机制),主要是线粒体/细胞的氧化损伤过程中启动相应的代偿机制[15]。pink1-parkin的功能是通过自噬协同降解受损的或去极化的线粒体。而普遍认为,持续受损的线粒体自噬引起的PD,会产生有毒的活性氧聚集在线粒体,逐步驱动神经变性疾病[16]。为了代偿修复线粒体损伤,机体启动UPRmt,通过线粒体分子伴侣和线粒体蛋白酶来纠正蛋白质稳态的失衡,使细胞尽可能恢复正常功能。Pryde等[17]通过在SH-SY5Y细胞模型中进行实验,发现受损的线粒体不能持续的产生高的活性氧,因为线粒体内存在LON-ClpP蛋白水解质量控制轴在受损的线粒体或其他细胞上,通过降解产生活性氧的复合体Ⅱ来清除活性氧。
近些年,国内外相关文献[18, 19]中,用秀丽隐杆线虫(caenorhabditis Elegans, C. Elegans)建立神经变性疾病的模型进行相关研究,如PD模型和AD模型等。在线虫的PD模型中,通过使α-突触核蛋白过表达,来揭示PD重要的机制。且在线虫中,发现了多个与疾病有关的修饰基因以及小分子,这些结果成功地从蠕虫模型转变到啮齿类动物模型,以及人类的全基因关联研究和来源于PD病人的诱导性多功能干细胞中[19, 20]。线虫的线粒体表达两种ClpX ATP酶的同源基因,分别是ClpX1和ClpX2,都与蛋白水解亚基ClpP结合形成完整的ClpXP蛋白酶复合物,这对于线粒体中受损蛋白的清除是必要的[21]。在以后的PD研究中,可在其线虫模型中,通过使ClpP表达受抑制,来验证ClpP与PD之间关系的密切性。
3.2 ClpP与阿尔茨海默病线粒体功能障碍在阿尔茨海默病(Alzheimer disease, AD)等神经变性疾病的发生发展中有重要作用,其可能的原因之一是线粒体蛋白稳态的失衡[22, 23]。在线粒体蛋白稳态失衡情况下,研究表明,特异性的UPRmt被线粒体基质中受损的或未折叠的蛋白质的异常聚集激活,从而导致与线粒体稳态相关的关键基因被上调表达。为了检测在AD病人中,是否存在UPRmt的激活,Beck[24]等研究人员对死后额叶皮质标本采用实时定量聚合酶链式反应(polymerase chain reaction, PCR)技术,标本分为散发性AD与早老素-1突变有关的家族性AD以及人的正常对照组。与对照组相比,散发性AD患者中,显示UPRmt标志物的表达水平增加,包括线粒体分子伴侣(热休克蛋白家族HSP40成员A3(DnaJ heat shock protein family HSP40 member A3, DnajA3)、热休克蛋白60(heat shock protein 60, HSP60)、热休克蛋白10(heat shock protein 10, HSP10))和线粒体蛋白酶(ClpP、Yme1样ATP酶(Yme1 like 1 ATPase, Yme1L1))。而且,与对照组相比,家族性AD中UPRmt有关的基因ClpP、LON等表达水平显著升高70%~90%,且ClpP的基因表达水平明显高于散发性AD。这些数据证实散发性和家族性AD以UPRmt基因的激活为特征。理解UPRmt这一反应的生理学过程,在AD的进程中,也许能为神经元选择性易损性或内源性代偿机制提供亚细胞机制线索。
3.3 ClpP与遗传性痉挛性截瘫遗传性痉挛性截瘫(hereditary spastic paraplegia, HSP)(携带痉挛性截瘫基因13(spastic paraplegia 13, SPG13))是一种迟发的神经变性疾病,与这类疾病相关的HSP60第98位氨基酸缬氨酸,由第292位的G变成A后的HSP60基因编码,从而减少了分子伴侣的活性,但如何影响线粒体的功能还不清楚。研究发现,与携带有野生型SPG13的HSP患者的细胞比较,第292位的G变成A后转录生成的RNA和相应的HSP60(第98位缬氨酸)蛋白相当。与对照组相比,在细胞活力以及氧化应激的敏感性等方面,没有统计学意义;然而,线粒体蛋白质量控制体系的ClpP和LON的蛋白以及相应的mRNA表达水平均下降,这已经在HSP(SPG13)患者细胞中证实[26]。Hansen等[25]推测,LON和ClpP蛋白允许HSP60底物蛋白在未被降解前尽力折叠,以便在HSP60分子伴侣活性降低的情况下,支持有效的折叠。ClpP蛋白酶不仅已经成为了线粒体未折叠蛋白反应的一部分,而且,ClpP直接参与应激感应机制,负责线粒体未折叠蛋白反应的触发(在秀丽隐杆线虫中)[26]。
3.4 ClpP与Friedreich共济失调Friedreich共济失调(Friedreich ataxia, FRDA)的发展过程与线粒体功能障碍有关,线粒体蛋白质量控制体系中的几种重要蛋白酶(如ClpP和LON)在疾病进程中有重要作用。其中较为重要的蛋白酶,如ClpP,其与ClpX形成复合物,降解底物﹣铁硫聚集蛋白[27]。在FRDA肌肉肌酸激酶突变的小鼠心脏模型的研究中证明了,较为重要的ATP依赖的线粒体蛋白酶ClpP和LON的蛋白表达水平逐步升高。这些蛋白酶被证实能降解线粒体基质中未折叠和受损的蛋白质。在疾病中期通过分离路径,触发ClpP的表达增加,并伴有蛋白水解活性的增加。且有研究证实,ClpP蛋白表达增加的同时伴有线粒体铁硫蛋白的显著减少,但ClpP的mRNA水平并无实质性的变化[28]。在疾病进程中,ClpP和LON蛋白酶表达上调对线粒体铁硫蛋白的影响表明,在FRDA中,铁硫蛋白是ClpP和LON蛋白酶的潜在靶点。
4 结语ClpP蛋白酶作为一种蛋白水解酶,对线粒体的功能、完整性以及稳态等都起着调控作用。在线粒体受损情况下,ClpP蛋白酶降解无效蛋白质的同时,通过清除受损的复合体Ⅰ,减少ROS的生成,从而降低对细胞的损害,恢复线粒体的正常功能。深入了解ClpP蛋白酶的结构动力学和功能多样性依然是一项艰巨的挑战。而且,目前针对于ClpP在神经系统的相关研究还较少,尚需进行更多的相关研究来明确其在神经系统中的功能与作用。
| [1] |
Ugarte N, Petropoulos I, Friguet B. Oxidized mitochondrial protein degradation and repair in aging and oxidative stress[J]. Antioxid Rredox Signal, 2010, 13(4): 539-549. DOI:10.1089/ars.2009.2998 |
| [2] |
Anand R, Langer T, Baker MJ. Proteolytic control of mitochondrial function and morphogenesis[J]. Biochim Biophys Acta, 2013, 1833(1): 195-204. DOI:10.1016/j.bbamcr.2012.06.025 |
| [3] |
Quirós PM, Langer T, López-Otín C. New roles for mitochondrial proteases in health, ageing and disease[J]. Nature Rev Mol Cell Biol, 2015, 16(6): 345-359. DOI:10.1038/nrm3984 |
| [4] |
Rugarli EI, Langer T. Mitochondrial quality control:a matter of life and death for neurons[J]. EMBO J, 2012, 31(6): 1336-1349. DOI:10.1038/emboj.2012.38 |
| [5] |
Goard CA, Schimmer AD. Mitochondrial matrix proteases as novel therapeutic targets in malignancy[J]. Oncogene, 2014, 33(21): 2690-2699. DOI:10.1038/onc.2013.228 |
| [6] |
Bulteau AL, Bayot A. Mitochondrial proteases and cancer[J]. Biochim Biophys Acta, 2011, 1807(6): 595-601. DOI:10.1016/j.bbabio.2010.12.011 |
| [7] |
Kress W, Maglica Ž, Weber-Ban E. Clp chaperone-proteases:structure and function[J]. Res Microbiol, 2009, 160(9): 618-628. DOI:10.1016/j.resmic.2009.08.006 |
| [8] |
Jennings LD, Lun DS, Médard M, et al. ClpP hydrolyzes a protein substrate processively in the absence of the ClpA ATPase:mechanistic studies of ATP-independent proteolysis[J]. Biochemistry, 2008, 47(44): 11536-11546. DOI:10.1021/bi801101p |
| [9] |
Hamon MP, Bulteau AL, Friguet B. Mitochondrial proteases and protein quality control in ageing and longevity[J]. Ageing Res Rev, 2015, 23(Pt A): 56-66. |
| [10] |
Russell R, Matouschek A. Chance, destiny, and the inner workings of ClpXP[J]. Cell, 2014, 158(3): 479-480. DOI:10.1016/j.cell.2014.07.009 |
| [11] |
Gispert S, Parganlija D, Klinkenberg M, et al. Loss of mitochondrial peptidase Clpp leads to infertility, hearing loss plus growth retardation via accumulation of CLPX, mtDNA and inflammatory factors[J]. Human Mol Gene, 2013, 22(24): 4871-4887. DOI:10.1093/hmg/ddt338 |
| [12] |
Pellegrino MW, Nargund AM, Haynes CM. Signaling the mitochondrial unfolded protein response[J]. Biochim Biophys Acta, 2013, 1833(2): 410-416. DOI:10.1016/j.bbamcr.2012.02.019 |
| [13] |
Haynes CM, Ron D. The mitochondrial UPR-protecting organelle protein homeostasis[J]. J Cell Sci, 2010, 123(22): 3849-3855. DOI:10.1242/jcs.075119 |
| [14] |
Fischer F, Weil A, Hamann A, et al. Human CLPP reverts the longevity phenotype of a fungal ClpP deletion strain[J]. Nat Commun, 2013, 4: 1397. DOI:10.1038/ncomms2397 |
| [15] |
Schapira AHV. Mitochondria in the aetiology and pathogenesis of Parkinson's disease[J]. Lancet Neurol, 2008, 7(1): 97-109. DOI:10.1016/S1474-4422(07)70327-7 |
| [16] |
Narendra DP, Jin SM, Tanaka A, et al. PINK1 is selectively stabilized on impaired mitochondria to activate Parkin[J]. PLoS Biol, 2010, 8(1): e1000298. DOI:10.1371/journal.pbio.1000298 |
| [17] |
Pryde KR, Taanman JW, Schapira AH. A LON-ClpP Proteolytic Axis Degrades Complex I to Extinguish ROS Production in Depolarized Mitochondria[J]. Cell Rep, 2016, 17(10): 2522-2531. DOI:10.1016/j.celrep.2016.11.027 |
| [18] |
宋洁, 吴德玲, 王桐生, 等. 神经退行性疾病的秀丽隐杆线虫模型研究进展[J]. 中华中医药杂志, 2016, 31(10): 4146-4150. |
| [19] |
Martinez BA, Caldwell KA, Caldwell GA. C. elegans as a model system to accelerate discovery for Parkinson disease[J]. Curr Opin Genet Dev, 2017, 44: 102-109. DOI:10.1016/j.gde.2017.02.011 |
| [20] |
Knight AL, Yan X, Hamamichi S, et al. The glycolytic enzyme, GPI, is a functionally conserved modifier of dopaminergic neurodegeneration in Parkinson's models[J]. Cell Metabol, 2014, 20(1): 145-157. DOI:10.1016/j.cmet.2014.04.017 |
| [21] |
Li J, Cai T, Wu P, et al. Proteomic analysis of mitochondria from Caenorhabditis elegans[J]. Proteomics, 2009, 9(19): 4539-4553. DOI:10.1002/pmic.v9:19 |
| [22] |
Houtkooper RH, Mouchiroud L, Ryu D, et al. Mitonuclear protein imbalance as a conserved longevity mechanism[J]. Nature, 2013, 497(7450): 451. DOI:10.1038/nature12188 |
| [23] |
Burté F, Carelli V, Chinnery PF, et al. Disturbed mitochondrial dynamics and neurodegenerative disorders[J]. Nature Rev Neurol, 2015, 11(1): 11-24. |
| [24] |
Beck SJ, Mufson JE, Counts ES. Evidence for Mitochondrial UPR Gene Activation in Familial and Sporadic Alzheimer's Disease[J]. Curr Alzheimer Res, 2016, 13(6): 610-614. DOI:10.2174/1567205013666151221145445 |
| [25] |
Hansen J, Corydon TJ, Palmfeldt J, et al. Decreased expression of the mitochondrial matrix proteases Lon and ClpP in cells from a patient with hereditary spastic paraplegia (SPG13)[J]. Neuroscience, 2008, 153(2): 474-482. DOI:10.1016/j.neuroscience.2008.01.070 |
| [26] |
Haynes CM, Petrova K, Benedetti C, et al. ClpP mediates activation of a mitochondrial unfolded protein response in C. elegans[J]. Dev Cell, 2007, 13(4): 467-480. DOI:10.1016/j.devcel.2007.07.016 |
| [27] |
Koppen M, Langer T. Protein degradation within mitochondria:versatile activities of AAA proteases and other peptidases[J]. Crit Rev Biochem Mol Biol, 2007, 42(3): 221-242. DOI:10.1080/10409230701380452 |
| [28] |
Guillon B, Bulteau AL, Wattenhofer-Donzé M, et al. Frataxin deficiency causes upregulation of mitochondrial Lon and ClpP proteases and severe loss of mitochondrial Fe-S proteins[J]. FEBS J, 2009, 276(4): 1036-1047. DOI:10.1111/j.1742-4658.2008.06847.x |
 2017, Vol. 44
2017, Vol. 44