扩展功能
文章信息
- 杨俊杰, 陈玉军, 于亮, 李志刚
- YANG Jun-Jie, CHEN Yu-Jun, YU Liang, LI Zhi-Gang
- 右美托咪啶对创伤性脑损伤大鼠模型的神经保护作用实验研究
- Neuroprotective effect of dexmedetomidine in a rat model of traumatic brain injury:an experimental study
- 国际神经病学神经外科学杂志, 2017, 44(5): 523-526
- Journal of International Neurology and Neurosurgery, 2017, 44(5): 523-526
-
文章历史
收稿日期: 2017-07-07
修回日期: 2017-09-11
2. 齐齐哈尔医学院附属第一医院儿科, 黑龙江省齐齐哈尔市 161041;
3. 齐齐哈尔医学院附属第一医院康复科, 黑龙江省齐齐哈尔市 161041
创伤性脑损伤后伴随的过度炎症反应和细胞凋亡是继发神经细胞损伤的主要原因,目前临床上缺乏相应的预防与治疗手段[1, 2]。如能抑制创伤性脑损伤部位炎症反应及细胞凋亡则有助于减少其围手术期并发症产生,从而起到神经保护的作用。右美托咪啶是一种高选择性的α2受体激动剂,具有中枢性抗焦虑和抗交感作用,在临床上已经广泛用于手术麻醉或者重病监护治疗插管初始和呼吸机患者镇静[3]。研究表明,右美托咪啶具有显著的抗炎症反应作用[4],但利用右美托咪啶抗炎作用来进行进一步地保护创伤性脑损伤部位神经细胞的相关研究甚少。本研究拟建立创伤性脑损伤大鼠模型,腹腔内注射右美托咪啶干预,观察治疗3 d和7 d后创伤性脑损伤部位炎症反应及细胞凋亡情况,为右美托咪啶对创伤性脑损伤大鼠模型的神经保护作用提供实验依据。
1 材料与方法 1.1 实验动物与试剂雄性SD大鼠48只,清洁级,体质量150~200 g,购自南方医科大学实验动物中心,随机分为实验组(右美托咪啶腹腔注射)和对照组(生理盐水腹腔注射),每组24只大鼠。
右美托咪啶,商品名:艾贝宁,购自江苏新晨医药有限公司;大鼠TNF-α和IL-1β ELISA检测试剂盒,购自南京凯基生物科技有限公司;TUNEL检测试剂盒,购自德国Boehringer Mannheim公司。
1.2 创伤性脑损伤大鼠模型制作及处理参照Liu等[5]报道创伤性脑损伤大鼠模型制作方法,大鼠麻醉满意后,常规消毒铺巾,逐层切开分离头顶部皮肤、皮下组织及骨膜1.5 cm,钻开头骨,显露硬脑膜,调整20g颅脑损伤撞击锤高度至3~5 cm,让撞击锤垂直下落撞击硬脑膜,造成急性创伤性脑损伤,依层次缝合切口。设置实验组和对照组,其中实验组予以右美托咪啶6 μg/kg腹腔注射干预,对照组予以等量生理盐水腹腔注射,每天1次。
1.3 ELISA检测脑损伤组织内TNF-α和IL-1β表达水平分别在连续给药3 d和7 d后,处死动物,每组6只,分离两组脑损伤部位组织并匀浆,参照试剂盒操作说明,把待测样品、稀释液和标准品分别加入酶标板中,每孔0.1 mL。37 ℃反应2 h,加入0.1 mL生物素抗大鼠肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和白介素-1β(interleukin-1β, IL-1β)抗体工作液,37 ℃培养箱中反应1 h。加入亲和素过氧化物酶复合物的工作液0.1 mL,37 ℃反应30 min,依次加入TMB显色液,37℃避光反应30 min,加入0.1 mL终止液,酶联免疫监测仪于450 nm波长测定吸光度(A值)。
1.4 Western-bolt检测凋亡信号通路关键蛋白caspase-3表达分别在连续给药3 d和7 d后,切取两组大鼠脑损伤组织,蛋白提取试剂盒收集细胞蛋白,BCA法测定样品中总蛋白浓度,取样品蛋白对靶蛋白caspase-3表达水平进行检测。120 V恒流电源下利用10% SDS-PAGE分离胶分离样品蛋白质1 h,转膜80 V 2 h,1% BSA封闭l h,剪膜,加入1 :300稀释兔抗大鼠caspase-3多克隆抗体4℃过夜孵育,加入1 :000稀释HRP标记羊抗兔Ig G抗体室温孵育45 min,在ECL显色系统中显色定影,分析杂交条带。
1.5 脑损伤组织细胞凋亡测定分别连续给药3 d和7 d后,处死动物,将两组脑损伤部位组织取出,4%多聚甲醛固定,包埋,石蜡切片脱蜡,含0.2% Triton X-100的PBS缓冲液破膜10 min,生理盐水清洗3次,加入45 μL TUNEL检测液,室温避光孵育1 h,PBS清洗3次,荧光显微镜下观察,利用IPP软件测定各组积分光密度(integral optical density, IOD),以空白组为对照计算相对IOD值。
1.6 统计学方法采用SPSS 19.0统计软件,计量数据以均数±标准差(x±s)表示,两组均数间比较用t检验分析,以P < 0.05为差异有统计学意义。
2 结果 2.1 脑损伤组织内炎性因子水平变化ELISA检测脑损伤组织内炎性细胞因子TNF-α和IL-1β浓度变化,结果显示,连续给药3 d和7 d后,实验组TNF-α和IL-1β水平较对照组均显著降低。其中给药3 d后,实验组和对照组TNF-α浓度分别为132.9±12.7 pg/g和186.1±35.7 pg/g(P < 0.05);给药7 d后,实验组和对照组TNF-α浓度分别为76.1±12.9 pg/g和129.5±17.9 pg/g,(P < 0.05)。给药3 d后,实验组和对照组IL-1β浓度分别为196.8±21.8 pg/g和301.8±51.8 pg/g(P < 0.05);给药7 d后,实验组和对照组IL-1β浓度分别为127.3±26.1 pg/g和265.8±48.6 pg/g(P < 0.05)。见图 1。
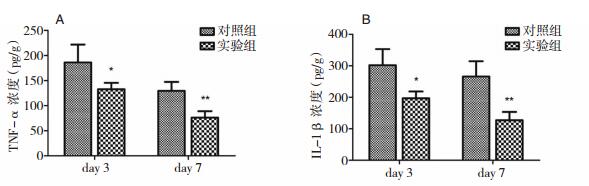
|
| 图 1 脑损伤组织内炎性细胞因子浓度(pg/g) 注:A:TNF-α浓度;B:IL-1β浓度;*和**均为实验组和对照组比较,P < 0.05。 |
右美托咪啶干预3 d和7 d后,实验组凋亡信号通路关键蛋白caspase-3蛋白表达均显著降低,其中右美托咪啶干预3 d,测定实验组与对照组相对蛋白比值分别为0.86±0.201和0.34±0.153(P < 0.05);干预7 d,测度实验组与对照组相对蛋白比值分别为0.77±0.101和0.31±0.080(P < 0.05)。见图 2。
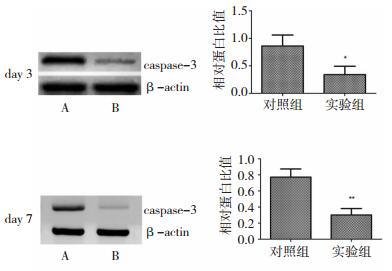
|
| 图 2 两组caspase-3蛋白表达 注:A:对照组;B:实验组;*和**均为实验组和对照组比较,P < 0.05。 |
荧光显微镜下观察,蓝色荧光代表细胞核,绿色荧光代表细胞凋亡现象。TUNEL染色结果证实,连续给药3 d和7 d后,实验组随机视野平均TUNEL染色阳性数目均显著低于对照组,其细胞凋亡散在分布,两组差异具有显著统计学意义(P < 0.05)。见图 3。

|
| 图 3 脑神经细胞凋亡观察 注:A:实验组连续给药3 d;B:实验组连续给药7 d;C:对照组连续给药3 d;D:对照组连续给药7 d。 |
急性脑损伤病理机制主要是由损伤后引发严重的局部及全身炎症反应,最终引起细胞凋亡和坏死灶形成[6]。
右美托咪啶是一种高选择性的肾上腺素α2受体激动剂,其受体选择性高于可乐定,可广泛作用于哺乳动物的大脑,产生镇静、减少麻醉药用量、镇痛和抗交感作用,进而改善远期中枢神经功能。不同于一般的麻醉剂和镇静剂,右美托咪啶具有抗细胞凋亡和抗炎症反应特征[7, 8]。研究表明,右美托咪啶抗炎症效应可能与抑制Toll样受体﹣核转录因子(NF-κB)通路相关[9, 10]。另外,右美托咪啶抗炎症效应存在剂量依赖性,过高剂量或者过低剂量均可使其抗炎效应降低,且过高药物浓度常常伴随更严重毒副作用,当右美托咪啶浓度在4~6 μg/kg时,其抗炎作用较为适宜[11]。因此,参考既往文献报道,本实验选用6 μg/kg浓度作为药物注射剂量用于体内实验。
本研究首先制备大鼠创伤性脑损伤模型,急性脑损伤后即给予右美托咪啶腹腔注射,观察右美托咪啶干预3 d后脑损伤组织内炎症及细胞凋亡情况。炎症反应和细胞凋亡是脑损伤后引起神经功能障碍的病理损害基础。脑损伤组织局部可检测到相关炎性细胞因子大幅升高,如TNF-α、IL-1β、IL-6等[12, 13]。TNF-α是一种由单核细胞和巨噬细胞产生的标志性促炎细胞因子,急性组织损伤后,TNF-α显著升高,并可诱导细胞凋亡[14]。IL-1β属于白细胞介素亚型,广泛参与发热反应和炎症反应,尤其脑损伤后血清中IL-1β水平极显著升高[15]。为进一步探究右美托咪啶的脑损伤后神经保护作用,本实验检测脑损伤用药后组织内局部炎性细胞因子浓度。结果证实,实验组脑损伤组织内炎性因子浓度较对照组明显降低,表明右美托咪啶具有抑制炎症反应作用。另外,caspase蛋白酶在死亡受体介导的细胞凋亡中起着中心的作用,其中caspase-3被认为是细胞凋亡过程中最主要的终末剪切酶,也是CTL细胞杀伤机制的重要组成部分[16]。本实验检测脑损伤组织内凋亡信号通路关键蛋白caspase-3表达及对比两组神经细胞凋亡情况,实验组caspase-3表达显著降低,脑神经细胞凋亡明显减少。因此,右美托咪啶抗炎症反应和抗细胞凋亡作用可能是急性脊髓损伤后神经保护作用的关键因素。
综上,右美托咪啶具有明显神经保护作用,其机制可能与减轻脑损伤组织炎性反应和抑制神经细胞凋亡有关。
| [1] |
Yu SC, Kuo JR, Shiue YL, et al. One-year mortality of chronic kidney disease patients following traumatic brain injury:A 14-year population-based study[J]. World Neurosurg, 2017, 105: 462-469. DOI:10.1016/j.wneu.2017.06.009 |
| [2] |
罗鹏, 费舟. 开放性颅脑损伤的救治[J]. 国际神经病学神经外科学杂志, 2016, 43(4): 379-382. |
| [3] |
Davoudi A, Movahedian Attar B, Shadmehr E. Risks and benefits of pre-operative dexmedetomidine in oral and maxillofacial surgeries:A systematic review[J]. Exp Opin Drug Safety, 2017, 16(6): 711-720. DOI:10.1080/14740338.2017.1323865 |
| [4] |
Rong H, Zhao Z, Feng J, et al. The effects of dexmedetomidine pretreatment on the pro-and anti-inflammation systems after traumatic brain injury in rats[J]. Brain Behav Immun, 2017, 64: 195-207. DOI:10.1016/j.bbi.2017.03.006 |
| [5] |
Liu NK, Zhang YP, Zou J, et al. A semicircular controlled cortical impact produces long-term motor and cognitive dysfunction that correlates well with damage to both the sensorimotor cortex and hippocampus[J]. Brain Res, 2014, 1576(1): 18-26. |
| [6] |
Eldahan KC, Rabchevsky AG. Autonomic dysreflexia after traumatic brain injury:Systemic pathophysiology and methods of management[J]. Auton Neurosci, 2017. |
| [7] |
Sanders RD, Sun P, Patel S, et al. Dexmedetomidine provides cortical neuroprotection:impact on anaesthetic-induced neuroapoptosis in the rat developing brain[J]. Acta Anaesthesiol Scan, 2010, 54(6): 710-716. |
| [8] |
Ma J, Zhang XL, Wang CY, et al. Dexmedetomidine alleviates the spinal cord ischemia-reperfusion injury through blocking mast cell degranulation[J]. Int J Clin Exp Med, 2015, 8(9): 14741-14749. |
| [9] |
Yao H, Chi X, Jin Y, et al. Dexmedetomidine inhibits TLR4/NF-κB activation and reduces acute kidney injury after orthotropic antilogous liver transplantation in rats[J]. Sci Rep, 2015, 5: 16849. DOI:10.1038/srep16849 |
| [10] |
Chi X, Wei X, Gao W, et al. Dexmedetomidine ameliorates acute lung injury following orthotopic autologous liver transplantation in rats probably by inhibiting Toll-like receptor 4-nuclear factor kappa B signaling[J]. J Translat Med, 2015, 13(1): 190. DOI:10.1186/s12967-015-0554-5 |
| [11] |
Blaudszun G, Lysakowski C, Elia N, et al. Effect of Perioperative Systemic α2 Agonists on Postoperative Morphine Consumption and Pain IntensitySystematic Review and Meta-analysis of Randomized Controlled Trials[J]. Anesthesiology, 2012, 116(6): 1312-1322. DOI:10.1097/ALN.0b013e31825681cb |
| [12] |
Shukla V, Shakya AK, Perez-Pinzon MA, et al. Cerebral ischemic damage in diabetes:an inflammatory perspective[J]. J Neuroinflamm, 2017, 14(1): 21. DOI:10.1186/s12974-016-0774-5 |
| [13] |
安模, 苗露, 黄春云, 等. 急性颅脑损伤患者血清及脑脊液中炎性因子的变化及临床意义[J]. 国际神经病学神经外科学杂志, 2013, 40(5): 408-411. |
| [14] |
Be'carevi'c M. TNF-alpha and annexin A2:inflammation in thrombotic primary antiphospholipid syndrome[J]. Rheumatol Int, 2016, 36(12): 1649-1656. DOI:10.1007/s00296-016-3569-1 |
| [15] |
Jordan SC, Choi J, Kim I, et al. Interleukin-6, A Cytokine Critical to Mediation of Inflammation, Autoimmunity and Allograft Rejection:Therapeutic Implications of IL-6 Receptor Blockade[J]. Transplantation, 2017, 101(1): 32-44. DOI:10.1097/TP.0000000000001452 |
| [16] |
Mirzayans R, Andrais B, Kumar P, et al. The Growing Complexity of Cancer Cell Response to DNA-Damaging Agents:Caspase 3 Mediates Cell Death or Survival?[J]. Intl J Mol Sci, 2016, 17(5). |
 2017, Vol. 44
2017, Vol. 44




