扩展功能
文章信息
- 潘宏旭, 方亮娟
- PAN Hong-Xu, FANG Liang-Juan
- 全反式维甲酸通过增强调节性T细胞的抑炎效应发挥对多巴胺能神经元的保护作用
- All-trans retinoic acid exerts a protective effect on dopaminergic neurons by enhancing the anti-inflammatory effect of regulatory T cells
- 国际神经病学神经外科学杂志, 2017, 44(5): 518-522
- Journal of International Neurology and Neurosurgery, 2017, 44(5): 518-522
-
文章历史
收稿日期: 2017-06-22
修回日期: 2017-10-12
帕金森病(Parkinson’ s disease, PD)的主要病理学特征为黑质致密部多巴胺能神经元的变性死亡以及α-突触核蛋白(alpha-synuclein, α-syn)的错误折叠和异常聚集;主要生化改变为纹状体区多巴胺递质降低,也是临床症状的根源所在[1]。PD发病机制复杂,目前认为与环境因素(如1-甲基-4-苯基-1, 2, 3, 6-四氢吡啶,MPTP)和遗传因素相关,但尚不能完全阐明。
越来越多的研究表明炎症反应参与PD的发生和发展[2, 3]。在神经系统疾病中,调节性T细胞(regulatory T cells, Tregs)可以直接抑制活化的小胶质细胞,诱导其凋亡;还可以分泌多种免疫抑制因子如TGF-α和IL-10,下调小胶质细胞表面MHC Ⅰ/Ⅱ分子的表达,从而减少炎症反应,间接发挥神经元保护作用[4]。PDL1-PD1配体受体通路以及一些环境因素,如芳烃受体激动剂和全反式维甲酸(all-trans retinoic acid, ATRA)等,能够诱导CD4+T细胞分化为Tregs,此外,ATRA还能稳固Tregs表型[5]。
脉络丛是血脑屏障(blood brain barrier, BBB)的重要组成部分,当脑组织损伤时,BBB通透性增高,外周血免疫细胞浸润至CNS,发生免疫反应,促进脑组织修复,但过度的免疫反应反而会加重脑组织损伤[6]。
综上,本研究通过探索ATRA在MPTP诱导的PD小鼠模型中的抑炎作用及其机制,期望为PD发病机制及治疗方法的研究提供新的线索。
1 材料和方法 1.1 动物和试剂健康雄性C57BL6小鼠,8周龄,体重22~25 g,购自湖南斯莱克景达实验动物公司。在中南大学医学遗传学实验室动物实验中心适应性饲养1周后进行实验。实验方案获得中南大学实验动物伦理委员会批准。抗小鼠CD3(FITC,553061)、CD4(Pacific Blue,558107)、CD8(PE-Cy7,552877)、CD25(PerCP-Cy5.5,551071)、Foxp3(PE,560408)、PD1(PE,551892)抗体和红细胞裂解液(555899)购自美国BD公司;MPTP粉末(M0896)、ATRA粉末(R2625)购自美国Sigma公司;cDNA试剂盒和SYBR Green qPCR Mix购自美国Selleck公司;Icam-1、Vcam-1、TNF-α、IFN-γ、IL-6、β-actin和GAPDH等引物由上海生工生物工程公司合成。序列如下表所示:
| 基因 | 序列 | |
| Icam-1 | forward | 5’-AGATCACATTCACGGTGCTGGCTA-3’ |
| reverse | 5’-AGCTTTGGGATGGTAGCTGGAAGA-3’ | |
| Vcam-1 | forward | 5’-TGTGAAGGGATTAACGAGGCTGGA-3’ |
| reverse | 5’-CCATGTTTCGGGCACATTTCCACA-3’ | |
| TNF-α | forward | 5’-GCCTCTTCTCATTCCTGCTT-3’ |
| reverse | 5’-CTCCTCCACTTGGTGGTTTG-3’ | |
| IFN-γ | forward | 5’-AGCGGCTGACTGAACTCAGATTGTAG-3’ |
| reverse | 5’-GTCACAGTTTTCAGCTGTATAGGG-3’ | |
| IL-6 | forward | 5’-CAAAGCCAGAGTCCTTCAGA-3’ |
| reverse | 5’-GATGGTCTTGGTCCTTAGCC-3’ | |
| β-actin | forward | 5’-CACGATGGAGGGGCCGGACTCATC-3’ |
| reverse | 5’-TAAAGACCTCTATGCCAACACAGT-3’ | |
| GAPDH | forward | 5’-GGTGAAGGTCGGTGTGAACG-3’ |
| reverse | 5’-CTCGCTCCTGGAAGATGGTG-3’ |
流程如图 1所示,ATRA溶于DMSO后以8 mg/kg进行腹腔注射,隔日注射1次,连续4次,对照组等量注射DMSO;MPTP溶于生理盐水后进行腹腔注射(20 mg/kg),每日注射1次,共注射5 d,对照组等量注射生理盐水。注射完成后继续饲养21 d。
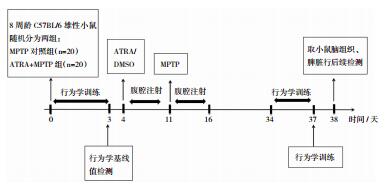
|
| 图 1 实验方案 |
转棒实验借助小鼠转棒仪(意大利UGO公司),前3天训练,第4天检测,以20 rpm的速度起始运动,记录小鼠在转棒仪上停留的时间;旷场实验采用开口的黑色木盒和Animal Video Tracking Analysis Software等设备记录小鼠移动总距离、跨越方格总数和周边时间。
1.2.3 外周血免疫细胞检测分离小鼠脾脏,制成单细胞悬液。分两管,每管取1×106个细胞。第一管加入抗小鼠CD3、CD4、CD8和CD25荧光抗体,第二管加入抗小鼠CD3、CD4、CD8和PD1荧光抗体,避光静置1 h,在PBS中洗涤两次。第一管加入破膜液,4℃过夜后加入抗小鼠Foxp3荧光抗体,避光静置1 h,在PBS中洗涤两次。洗涤完成后上流式细胞仪(FACS Canto II,美国BD公司)进行检测。全部数据采用FlowJo 10.0软件进行分析。
1.2.4 实时定量PCR(real time quantitative polymerase chain reaction, RT-qPCR)MPTP注射完成21 d后,取小鼠脑组织,分离黑质以及脉络丛,按照试剂盒说明书提取总RNA,逆转录生成cDNA后行PCR扩增与荧光检测。RT-qPCR反应程序为:95℃ 5 min,94℃ 20 s,60℃ 20 s,72℃ 20 s,循环40次。
1.2.5 小鼠脑组织病理切片检测具体方法参考郭彦杰等的研究[7]。所使用一抗包括:兔抗鼠GFAP(ab53554, Abcam)、兔抗鼠Iba-1(ab178847, Abcam)和鸡抗鼠TH(ab76442, Abcam);二抗包括:山羊抗兔荧光抗体(Alexa Fluor® 488, ab150077, Abcam)和山羊抗鸡荧光抗体(Alexa Fluor® 647, ab150175, Abcam)。采用荧光共聚焦显微镜(E800, Nikon)显微分析染色结果。
1.3 统计学方法本实验相关结果均应用Prism 5软件进行数据分析,以均数±标准差(x±s)表示,各组之间比较采用单因素方差分析,并用t检验进行两两比较,以P < 0.05为差异有统计学意义。
2 结果 2.1 ATRA对PD小鼠行为学的影响在给予MPTP后,小鼠出现震颤、竖毛、行动缓慢和活动减少等PD典型症状。ATRA+MPTP组小鼠在转动棒上停留平均时间为(157.50±24.46)s,较MPTP对照组(120.88±30.43)s显著延长;与转棒实验结果相似,ATRA+MPTP组小鼠平均移动距离为(42.58±2.96)m,优于MPTP对照组小鼠(37.76±2.79)m,差异均具有统计学意义(P < 0.05)。以上行为学结果表明ATRA可以改善PD小鼠的活动度,但仍未恢复至基线水平。见表 2。
| 分组 | 停留时间/s | 移动距离/m | |
| MPTP对照组 | 基线值 | 257.50±17.70 | 52.97±2.57 |
| 最终值 | 120.88±30.43* | 37.76±2.79* | |
| ATRA+MPTP组 | 基线值 | 256.38±16.44 | 52.79±2.29 |
| 最终值 | 157.50±24.46* | 42.58±2.96* | |
| P值 | < 0.05 | < 0.05 | |
| 注:*表示最终值与基线值之间差异存在统计学意义,P < 0.05。 | |||
流式细胞学结果分析表明,ATRA预处理的PD小鼠脾脏Tregs(CD4+CD25+Foxp3+)百分比均值为2.31±0.21,较MPTP对照组的1.19±0.05增多(P < 0.05)。我们还发现,经ATRA预处理后,脾脏CD4+和CD8+T淋巴细胞相对数目均减少,百分比分别为17.40±0.48、10.88±0.50,而未经ATRA处理组分别为21.08±1.33、13.14±0.76,提示ATRA可能通过某种途径抑制CD4+/CD8+T细胞的增殖和活化。进一步研究表明,有抑制T细胞增殖活化及分泌炎性介质作用的负向调控因子PD1在ATRA预处理的PD小鼠中表达上调,分别为(4.65±0.61)%(CD4+)、(3.50±0.31)%(CD8+)(P < 0.05),提示ATRA处理组小鼠免疫功能处于抑制状态。见表 3。
| 分组 | Tregs | CD4+ | CD8+ | CD4+PD1+ | CD8+PD1+ |
| MPTP对照组 | 1.19±0.05 | 21.08±1.33 | 13.14±0.76 | 2.70±0.20 | 2.44±0.13 |
| ATRA+MPTP组 | 2.31±0.21 | 17.40±0.48 | 10.88±0.50 | 4.65±0.61 | 3.50±0.31 |
| P值 | < 0.05 | < 0.05 | < 0.05 | < 0.05 | < 0.05 |
促炎因子IL-6和TNF-α对神经元均有毒害作用。RT-qPCR结果显示ATRA+MPTP组小鼠脑黑质IL-6和TNF-α的mRNA相对表达量分别为0.16±0.05和0.29±0.12,与MPTP对照组的1.04±0.20和1.02±0.13相比,显著下调(P < 0.05),表明ATRA可通过下调促炎因子的表达减少PD小鼠脑内炎症反应。见表 4。
| 分组 | IL-6 | TNF-α | Icam-1 | Vcam-1 | IFN-γ |
| MPTP对照组 | 1.04±0.20 | 1.02±0.13 | 1.04±0.20 | 1.01±0.09 | 1.01±0.09 |
| ATRA+MPTP组 | 0.16±0.05 | 0.29±0.12 | 0.37±0.13 | 0.32±0.06 | 0.77±0.08 |
| P值 | < 0.05 | < 0.05 | < 0.05 | < 0.05 | NS |
| 注:NS为差异无统计学意义。 | |||||
表达于BBB的Icam-1和Vcam-1是促进外周白细胞中枢迁移的重要黏附分子。RT-qPCR结果分析如表 4显示,MPTP对照组Icam-1和Vcam-1相对表达量分别为1.04±0.20和1.01±0.09,而ATRA+MPTP组相对表达量下降至0.37±0.13他0.32±0.06(P < 0.05)。IFN-γ为促进Icam-1和Vcam-1表达的关键上游分子,本研究发现IFN-γ在ATRA+MPTP组小鼠脉络丛中的相对表达量为0.77±0.08,低于MPTP对照组1.01±0.09,未发现差异存在统计学意义,其原因可能是由于上游分子IFN-γ的表达在检测时已出现下调,提示我们后续需设立多个时间点进一步研究。因此,ATRA预处理小鼠BBB的黏附分子表达下调,外周淋巴细胞中枢迁移受限。
2.5 PD小鼠黑质多巴胺能神经元存活及胶质细胞活化情况免疫荧光结果显示,ATRA预处理的PD小鼠黑质区GFAP与Iba-1表达量降低,提示活化的星形胶质细胞和小胶质细胞数目较少;与之相反,ATRA预处理的PD小鼠TH+神经元数量较多,未经ATRA预处理的PD小鼠多巴胺能神经元死亡率高(图 2)。上述结果表明,ATRA起着保护多巴胺能神经元的作用。
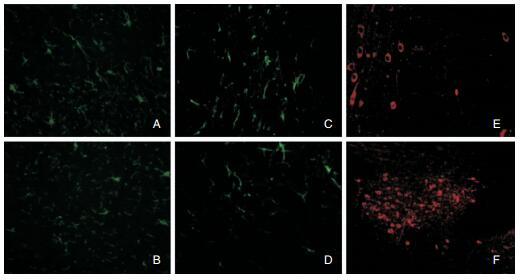
|
| 图 2 PD小鼠脑组织黑质内胶质细胞活化情况及多巴胺能神经元存活情况 注:A:MPTP对照组活化的星形胶质细胞,标记物为GFAP;B:ATRA+MPTP组活化的星形胶质细胞,标记物为GFAP;C:MPTP对照组活化的小胶质细胞,标记物为Iba-1;D:ATRA+MPTP组活化的小胶质细胞,标记物为Iba-1;E:MPTP对照组多巴胺能神经元,标记物为TH;F:ATRA+MPTP组多巴胺能神经元,标记物为TH。 |
对PD患者尸检发现,疾病早期即出现小胶质细胞增殖与活化,随着疾病的进展,多巴胺能神经元变性死亡程度与促炎因子表达水平息息相关[8]。由此可见,减少中枢神经系统持续慢性炎症反应,是延缓甚至阻止多巴胺能神经元进行性死亡的策略之一。
ATRA是维生素A的中间代谢产物,具有很强的诱导细胞分化及免疫调节作用,目前在治疗急性早幼粒细胞白血病和骨髓异常增生等血液系统恶性疾病中有较好的临床应用[9]。ATRA能够诱导Tregs分化并稳定其表型[10],同样,本研究也表明ATRA能够促进PD小鼠外周Tregs的增殖分化,进而抑制CD4+及CD8+T细胞的活化。PD1及其配体PDL1属于协同刺激分子,PD1激活后招募酪氨酸磷酸化酶SHP2和SHP1到PD1的胞内区,抑制TCR信号传导,负向调节细胞活化[11]。本研究发现,经ATRA预处理的PD小鼠,外周PD1表达上调,小鼠处于免疫功能抑制状态。
脉络丛是白细胞浸润至中枢的通道,由白细胞归巢和转运因子介导,包括Icam-1、Vcam-1、cxcl-10和ccl-2等[12],并受IFN-γ信号通路调控[13]。在本研究中,经ATRA预处理的PD小鼠脉络丛Icam-1和Vcam-1表达下调,可能与Tregs数量增多,进而抑制脉络丛IFN-γ信号通路有关。但是,实验组和对照组IFN-γ表达差异无统计学意义,其可能的原因是IFN-γ信号通路的作用具有时效性,当其下游信号即Icam-1和Vcam-1表达出现改变时,上游信号分子IFN-γ表达的改变已不明显,因此,提示研究者进行进一步深入研究时应设置时间对照组,比较ATRA作用不同时间点时IFN-γ的表达情况。
小胶质细胞是CNS主要固有免疫细胞,其在黑质部最为密集[14]。在PD中,慢性刺激导致小胶质细胞持续激活,产生大量氧自由基和多种促炎因子如IL-6、TNF-α和IL-1β等,并进一步激活小胶质细胞形成恶性循环,加速多巴胺能神经元死亡[15]。星形胶质细胞在一定条件下也具有免疫细胞的特征,如表达模式识别受体(Toll样受体和清道夫受体等)、激活后分泌细胞因子和趋化因子(IL-6、TNF-α和CCL2等)、通过NF-κB信号通路生成氧自由基诱导神经元死亡[16-18]。与上述研究结果一致,我们的研究发现ATRA处理的PD小鼠黑质区活化的小胶质细胞和星形胶质细胞数量减少,存留的TH+神经元数量较多;黑质区促炎因子IL-6,TNF-α的表达下调;功能学检测显示ATRA处理PD小鼠协调运动能力与自主活动度均得到改善。
综上所述,ATRA可能通过增强Tregs抑炎效应,间接发挥多巴胺能神经元的保护作用,有望成为延缓PD进展甚至治疗PD的潜在药物之一。
| [1] |
Samii A, Nutt JG, Ransom BR. Parkinson's disease[J]. Lancet, 2004, 363(9423): 1783-1793. DOI:10.1016/S0140-6736(04)16305-8 |
| [2] |
Ransohoff RM. How neuroinflammation contributes to neurodegeneration[J]. Science, 2016, 353(6301): 777-783. DOI:10.1126/science.aag2590 |
| [3] |
Mckenzie JA, Spielman LJ, Pointer CB, et al. Neuroinflammation as a Common Mechanism Associated with the Modifiable Risk Factors for Alzheimer's and Parkinson`s Diseases[J]. Curr Aging Sci, 2017, 10(3): 158-176. |
| [4] |
Wang S, Zhang H, Xu Y. Crosstalk between microglia and T cells contributes to brain damage and recovery after ischemic stroke[J]. Neurol Res, 2016, 38(6): 495-503. DOI:10.1080/01616412.2016.1188473 |
| [5] |
Zhou K, Zhong Q, Wang Y C, et al. Regulatory T cells ameliorate intracerebral hemorrhage-induced inflammatory injury by modulating microglia/macrophage polarization through the IL-10/GSK3beta/PTEN axis[J]. J Cereb Blood Flow Metab, 2017, 37(3): 967-979. DOI:10.1177/0271678X16648712 |
| [6] |
刘超, 李明昌, 陈谦学. 血脑屏障结构与功能及其在缺血性脑血管病中的研究进展[J]. 国际神经病学神经外科学杂志, 2016, 43(6): 564-568. |
| [7] |
郭彦杰, 董素艳, 赵文娟, 等. 白藜芦醇通过SIRT1/AMPK信号通路减轻MPTP诱导的小鼠多巴胺能神经元丢失[J]. 国际神经病学神经外科学杂志, 2016, 43(2): 97-102. |
| [8] |
Moehle MS, West AB. M1 and M2 immune activation in Parkinson's Disease:Foe and ally?[J]. Neuroscience, 2015, 30(2): 59-73. |
| [9] |
Stevison F, Jing J, Tripathy S, et al. Role of Retinoic Acid-Metabolizing Cytochrome P450s, CYP26, in Inflammation and Cancer[J]. Adv Pharmacol, 2015, 7(4): 373-412. |
| [10] |
Zhou X, Kong N, Wang J, et al. Cutting edge:all-trans retinoic acid sustains the stability and function of natural regulatory T cells in an inflammatory milieu[J]. J Immunol, 2010, 185(5): 2675-2679. DOI:10.4049/jimmunol.1000598 |
| [11] |
Hui E, Cheung J, Zhu J, et al. T cell costimulatory receptor CD28 is a primary target for PD-1-mediated inhibition[J]. Science, 2017, 355(6332): 1428-1433. DOI:10.1126/science.aaf1292 |
| [12] |
Baruch K, Kertser A, Porat Z, et al. Cerebral nitric oxide represses choroid plexus NFkappaB-dependent gateway activity for leukocyte trafficking[J]. EMBO J, 2015, 34(13): 1816-1828. DOI:10.15252/embj.201591468 |
| [13] |
Shechter R, Miller O, Yovel G, et al. Recruitment of beneficial M2 macrophages to injured spinal cord is orchestrated by remote brain choroid plexus[J]. Immunity, 2013, 38(3): 555-569. DOI:10.1016/j.immuni.2013.02.012 |
| [14] |
Yan J, Fu Q, Cheng L, et al. Inflammatory response in Parkinson's disease (Review)[J]. Mol Med Rep, 2014, 10(5): 2223-2233. DOI:10.3892/mmr.2014.2563 |
| [15] |
Catorce MN, Gevorkian G. LPS-induced Murine Neuroinflammation Model:Main Features and Suitability for Pre-clinical Assessment of Nutraceuticals[J]. Curr Neuropharmacol, 2016, 14(2): 155-164. DOI:10.2174/1570159X14666151204122017 |
| [16] |
Farina C, Aloisi F, Meinl E. Astrocytes are active players in cerebral innate immunity[J]. Trends Immunol, 2007, 28(3): 138-145. DOI:10.1016/j.it.2007.01.005 |
| [17] |
Mckimmie CS, Graham GJ. Astrocytes modulate the chemokine network in a pathogen-specific manner[J]. Biochem Biophys Res Commun, 2010, 394(4): 1006-1011. DOI:10.1016/j.bbrc.2010.03.111 |
| [18] |
Restrepo L, Stafford P, Johnston SA. Feasibility of an early Alzheimer's disease immunosignature diagnostic test[J]. J Neuroimmunol, 2013, 254(1-2): 154-160. DOI:10.1016/j.jneuroim.2012.09.014 |
 2017, Vol. 44
2017, Vol. 44




