扩展功能
文章信息
- 张菲菲, 程艳伟, 于敏敏, 石向群
- ZHANG Fei-Fei, CHENG Yan-Wei, YU Min-Min, SHI Xiang-Qun
- 大鼠癫痫持续状态后认知功能变化模式及海马脑红蛋白表达水平的实验研究
- Experimental study on the changes of cognitive function and the correlation with neuroglobin expression in rats after status epilepticus
- 国际神经病学神经外科学杂志, 2017, 44(5): 501-506
- Journal of International Neurology and Neurosurgery, 2017, 44(5): 501-506
-
文章历史
收稿日期: 2017-04-27
修回日期: 2017-09-17
癫痫持续状态(status epilepticus, SE)是癫痫发作中“三高”急症:高发病率、高死亡率、高致残率。传统定义上,SE指单一的临床痫性发作持续时间超过30 min或反复痫性发作之间意识尚未完全恢复。然而,出于实际原因考虑,传统定义被修饰,指癫痫活动持续时间超过5 min则应考虑SE[1]。SE可导致大量神经元损伤坏死,导致认知功能障碍。目前, 估计有1/4的癫痫儿童[2]和65%成人癫痫患者伴随认知障碍[3]。脑红蛋白(neuroglobin, NGB)是一种新型携氧球蛋白,高度特异性表达于脊椎动物神经组织,脑组织缺血缺氧后NGB表达上调,发挥内源性神经保护作用[4],若抑制NGB表达,则神经元凋亡裂解产物表达显著增多[5]。但目前对于SE后不同时相下NGB表达动态变化情况和认知功能变化轨迹研究甚少,本实验采用氯化锂-匹罗卡品(Lithium-pilocarpine, Li-Pilo)建立SE大鼠模型,RMT-100迷宫实验观察大鼠SE前后认知功能改变情况,探讨癫痫发作对认知功能的可能影响机制及NGB在癫痫发作中的作用。
1 材料与方法 1.1 动物与分组健康雄性SD大鼠40只,体重(221±30)g。随机分为对照组(5只)、模型组(35只),模型组再根据观察时间分为:0 h、1 h、3 h、12 h、24 h和10 d、30 d。同时随机选取同期相同品系SD大鼠40只,体重(218±26)g,在造模前及造模后第5 d、10 d、15 d、25 d、35 d进行迷宫实验。所有动物实验过程获得兰州军区总医院动物伦理委员会批准。
1.2 模型制备腹腔注射Li-Pilo(127~220 mg/kg,美国Sigma公司),间隔16~18 h,注射Li-Plio前30 min注射甲溴东莨菪碱1 mg/kg,以减少外周胆碱能反应。实验动物癫痫发作分级按照Racine评定标准[6]。实验大鼠痫性发作≥Ⅳ级且持续时间≥30 min为造模成功。
对照组:生理盐水代替Plio,其余处理同模型组。
1.3 石蜡切片制备10%水合氯醛(300mg/kg, i.p.)麻醉大鼠,快速心脏灌注,0.9%生理盐水150~200 ml,待右心耳流出清亮液体、肝脏变灰白后,灌注4%多聚甲醛溶液200~250 ml,先快后慢,待大鼠四肢僵硬后断头取脑,根据Paxinos和Watson的大鼠脑地图集[7]进行定位,取前囟-2.56~-4.52 mm脑组织制备石蜡切片,片厚4 μm。
1.4 尼氏染色石蜡切片脱蜡至水,滴加焦油紫染色液(焦油紫0.1 g,蒸馏水99 ml,1%冰醋酸1 ml),37℃孵育30 min。流水冲洗。脱水,透明,封片。采用日本Olympus BX51显微摄像系统观察海马组织各区神经元损伤缺失情况。
1.5 免疫组织化学检测石蜡切片脱蜡至水。热抗原修复。3%H2O2灭活内源性过氧化物酶。滴加5% BSA封闭液,室温20 min。滴加一抗NGB(1: 100,英国Abcam公司),37℃孵育2 h。滴加二抗(生物素化山羊抗兔IgG,博士德生物公司),37℃孵育20 min。滴加链酶亲和素-生物素-过氧化物酶复合物(SABC),37℃孵育20 min。DAB显色,5 min。蒸馏水冲涤。脱水,透明,封片。免疫组化阳性结果依据13点评分法:阳性细胞的百分率与阳性细胞染色强度的乘积评分[8]。
1.6 八臂迷宫实验 1.6.1 八臂迷宫实验过程① 采用RMT-100大鼠八臂迷宫系统(泰盟科技公司),首先适应环境1d。②预训练:随机选择1、3、4和7四个臂作为喂食臂。连续5次工作记忆错误(working memory error, WME)=0和参考记忆错误(reference memory error, RME)≤1时为训练成功,不成功的大鼠予以剔除。③迷宫实验:对训练成功的大鼠腹腔注射Li-Plio制备SE模型。于造模后第5d、10d、15d、25d和35d分别进行实验。
1.6.2 观察记录指标工作记忆错误、参考记忆错误、总的测试时间、总的入臂次数和平均探究时间。
1.7 统计学分析实验数据用均数±标准差(x±s)表示,使用SPSS 19.0统计软件进行完全随机设计单因素方差分析(ANOVA),组间两两比较采用LSD-t检验。对于迷宫数据符合正态分布的采用配对样本t检验。检验水准α=0.05,P < 0.05为差异有统计学意义。
2 结果 2.1 癫痫大鼠行为学表现注射Li-Pilo后平均(8.00±2.50)min出现单侧前肢阵挛及双前肢交替阵挛等症状,平均(25.76±8.35)min出现癫痫Ⅳ级及以上发作,如双侧前肢阵挛、后肢站立、倾倒失平衡等症状。其中癫痫模型组有2只大鼠在造模过程中抽搐致死,3只未达到癫痫发作级别,1只未达到实验终点死亡。对照组在实验过程中始终无任何发作迹象及抽搐表现。
2.2 海马神经元损伤情况对照组大鼠海马组织各区神经元排列整体,有一定方向,神经元胞体呈圆形或椭圆形,胞质淡紫色。SE后,海马各区均可见神经元细胞排列紊乱,失方向,尤其CA1区,胞体形态不规则,胞质皱缩呈暗紫色,随发作后时间进展,CA1和CA3区神经元存活数呈近直线下降趋势。其中CA1区(12 h、24 h、10 d和30 d)、CA3区(0 h、12 h、24 h、10 d和30 d)和DG区(12 h、24 h、10 d和30 d)神经元存活数均较对照组明显减少,差异有统计学意义(P < 0.05)。见图 1。
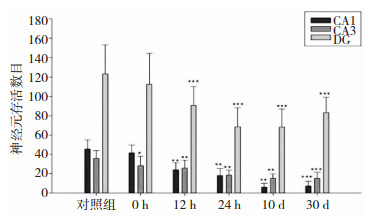
|
| 图 1 两组大鼠海马各区神经元存活数比较 注:与对照组同一部位神经元存活数比较,*P < 0.05;* *P < 0.01;* * *P < 0.001。 |
NGB免疫阳性物质主要定位于神经元胞质,神经突起也有表达。SE后海马各区NGB表达水平均有所上调,随着发作后时间进展,CA1和DG区NGB表达水平逐渐升高,均于SE后24 h达顶峰后轻度下降,但仍持续高于对照组,而CA3区NGB表达呈持续升高趋势。其中CA1区(24h、10d和30d)、CA3区(24h、10d和30d)和DG区(12h、24h、10d和30d)NGB表达水平均较对照组明显升高,差异有统计学意义(P < 0.05)。见图 2、图 3和图 4。
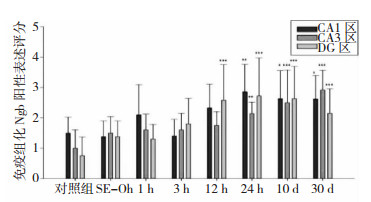
|
| 图 2 两组大鼠海马组织各区NGB表达情况比较 注:与对照组同一部位神经元存活数比较,*P < 0.05;* *P < 0.01;* * *P < 0.001。 |
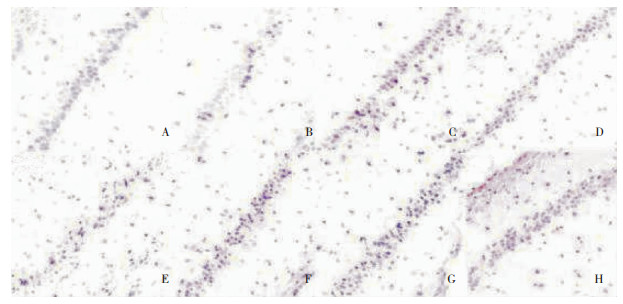
|
| 图 3 两组大鼠海马组织CA1区NGB表达情况(×200) 注:A:对照组;B:SE后0h;C:SE后1h;D:SE后3h;E:SE后12h;F:SE后24 h;G:SE后10d;H:SE后30d。 |
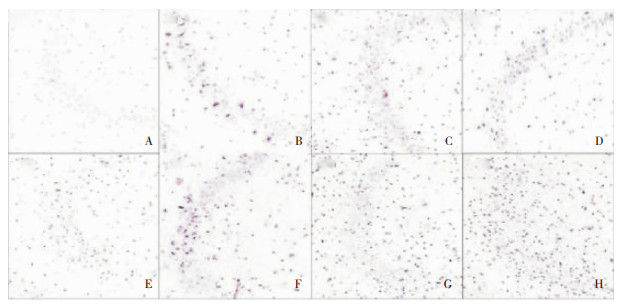
|
| 图 4 两组大鼠海马组织CA3区NGB表达情况(×200) 注:A:对照组;B:SE后0h;C:SE后1h;D:SE后3h;E:SE后12h;F:SE后24 h;G:SE后10d;H:SE后30d。 |
SE后,海马CA1和CA3区神经元存活数与NGB表达水平呈正相关(r=0.206, P=0.015; r=0.306, P=0.011),而DG区神经元存活数与NGB表达水平无相关性(r=0.061, P=0.678)。
2.4 八臂迷宫各记录指标值 2.4.1 SE前后RME和WME次数比较随SE后时间延长,RME次数呈近直线递增趋势,WME次数呈J型递增趋势。其中第10d、15d、25d和35d的RME次数均较SE前明显增多(P < 0.05),第15d、25d和35d的WME次数也较SE前明显增多(P < 0.05)。见图 5A和图 5B。
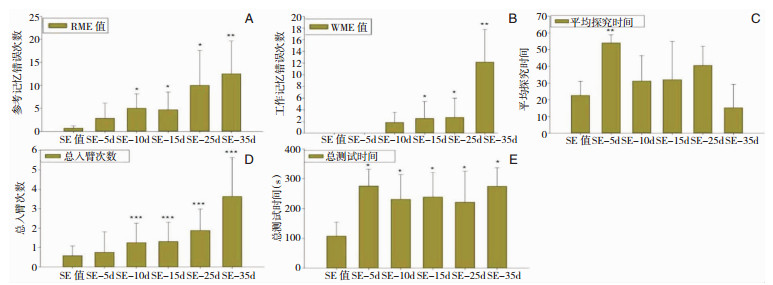
|
| 图 5 SE前后大鼠迷宫实验各记录指标比较 注:A:参考记忆错误;B:工作记忆错误;C:平均探究时间;D:总入臂次数;E:总测试时间。与SE前比较,*P < 0.05;* *P < 0.01;* * *P < 0.001。 |
随SE后时间延长,总入臂次数呈近直线递增趋势,其中第10d、15d、25d和35d总入臂次数均较SE前显著增多,差异有统计学意义(P < 0.001)。见图 5D。
2.4.3 实验总测试时间和平均探究时间比较随SE后时间延长,第5d、10d、15d、25d和35d迷宫总测试时间均较SE前延长,差异有统计学意义(P < 0.05)。SE后第5d、10d、15d、25d和35d大鼠平均探究时间均较SE前延长,其中第5d平均探究时间较SE前明显延长,差异有统计学意义(P < 0.01)。见图 5C和图 5E。
2.4.4 神经元存活数与认知水平相关性分析大鼠SE后,海马CA1区神经元存活数与RME和WME次数均呈负相关;CA3区神经元存活数也与RME和WME次数呈负相关;DG区神经元存活数与RME及WME次数无相关性。见表 1。
| CA1 区 | CA3 区 | DG 区 | ||||||
| r值 | P值 | r值 | P值 | r值 | P值 | |||
| RME 次数 | -0.579 | 0.000 | -0.454 | 0.002 | -0.130 | 0.493 | ||
| WME 次数 | -0.470 | 0.001 | -0.507 | 0.000 | 0.024 | 0.901 | ||
八臂迷宫实验是测试动物工作记忆和参考记忆的组合,通过观察动物寻找食物过程中所走的路程长度及典型错误次数评价动物空间学习记忆能力,较客观反映动物认知功能障碍程度。因此本实验采用RMT-100大鼠八臂迷宫实验评估大鼠SE前后认知功能改变情况。
先前研究证实SE后大鼠出现探索行为和空间记忆能力受损及定向行为消失[8],且癫痫发作持续时间与特定功能下降有关[9]。本实验结果显示,大鼠SE后出现明显的空间学习记忆功能受损,随发作后时程延长,RME和WME次数呈逐渐递增趋势,其中WME次数(第15d、25d和35d)、RME次数(第10d、15d、25d和35d)和(第10d、15d、25d和35d)总入臂次数均较SE前增多,SE后各时间点迷宫总测试时间和第5d平均探究时间均较SE前延长。这些数据提示SE可导致认知功能损害。另外,发现RME和WME次数在SE后第35d显著增加,对于是早期癫痫发作导致脑组织损伤逐渐进展的原因还是慢性期自发性痫性发作加剧脑损伤所致,目前仍不十分清楚,但不排除两者协同作用可能,无论是何种机制,癫痫的治疗都应越早越好。
目前关于癫痫发作伴随认知障碍的原因是癫痫本身还是合并症等仍存在争议。本实验证实,大鼠SE后,海马组织CA1区神经元存活数与RME、WME次数呈负相关性,CA3区神经元存活数与RME、WME次数也呈负相关,即癫痫发作后海马组织神经元存活数与大鼠认知功能损害程度呈负相关性,随着海马神经元存活数逐渐减少,认知障碍程度越严重。本实验大鼠SE后出现明显认知功能障碍,而随着发作后时间延长,海马各区神经元损伤坏死明显,其中CA1和CA3区神经元存活数呈近直线下降趋势,CA1区(12h、24h、10d、30d)、CA3区(0h、12h、24h、10d、30d)和DG区(12h、24h、10d、30d)神经元存活数均较对照组减少。这些数据均提示SE后发生的认知功能障碍可能与癫痫发作所致海马组织本身病理改变相关。
有研究发现,颞叶癫痫(TLE)解剖存在海马硬化迹象[10, 11]。大鼠SE后空间记忆能力快速下降与海马细胞密度降低相关[12]。另有研究也证实,人类中央TLE高频率癫痫发作与跨中央颞叶结构的灰白质脑萎缩相关[13],而此灰白质结构异常与认知下降存在关联[14]。fMRI证实这些认知损害均是异常的神经元网络覆盖了脑功能的广泛区域而不仅仅局限于癫痫病灶的结果[15]。总之,癫痫发作所致认知功能下降可能与癫痫本身所致海马组织及海马结构外病理改变相关。
NGB为17 kDa单体蛋白质,属于血红素类球蛋白,于2000年被德国学者Burmester等[16]首次发现,与血红蛋白和肌红蛋白功能相似,即促进氧向神经元线粒体扩散或作为NADH氧化酶促进ATP产生,维持神经元功能。有研究发现天门冬氨酸氨基转移酶(AST)也表达[17]。
癫痫发作时对氧需求大大增加,造成脑组织神经元细胞相对缺氧环境改变,而NGB作为氧载体,在缺氧情况下表达上调[4],其表达程度与组织缺氧耐受性呈正相关[18],与脑组织损伤程度呈负相关[16],抑制NGB表达,可明显降低缺氧后神经元细胞存活。本实验结果显示海马CA1区和CA3区神经元存活数与NGB表达水平呈正相关,即癫痫发作后NGB表达水平越高,海马神经元存活数目越多。提示NGB高表达可能对缓解局部脑组织缺氧及神经元的继发性损伤具有重要的神经保护作用。
结合本实验,SE后NGB表达上调,其中CA1区(24h、10d和30d)、CA3区(24h、10d和30d)和DG区(12、24h、10d和30d)NGB表达水平均较对照组明显升高,可见SE后NGB较长时间处于高表达状态,而已知NGB是神经系统特异性携氧球蛋白,推测癫痫发作加重局部神经元缺氧。其中CA1和DG区NGB表达于24 h达到顶峰后轻度下降,但持续处于高表达状态,CA3区呈持续升高趋势,表明NGB在癫痫发作后迅速产生,而随后的表达减少过程较产生过程相对缓慢许多,提示NGB的神经元保护作用具有持续性,但具体持续多久尚不清楚。另外,本实验发现SE后第10d和30d时NGB表达水平显著增加,但无法判断NGB表达增加是多次发作累积效应还是最后一次发作的急性表达。那么NGB表达后续轻度下降的原因是否与癫痫导致缺氧时间过长致神经元死亡裂解有关,用甲苯胺蓝染色证实其神经细胞密度与对照组一致,考虑为NGB本身表达下降所致,推测NGB对脑保护作用有一定极限。随着癫痫发作时程的进展,携氧球蛋白NGB表达呈递增趋势,可能是癫痫发作所致缺血缺氧的一种神经保护代偿机制。然而,有少数研究发现海马组织缺血后,神经元NGB表达水平出现相反变化[19, 20]。对于差异性研究结果考虑可能与实验所用缺血缺氧模型不同或者海马及皮质神经元对缺血缺氧反应性不同等相关。
总之,大鼠SE后出现明显的认知功能障碍,且与海马组织神经元存活数呈负相关,考虑癫痫所致认知功能损害可能与海马组织本身病理改变相关。此外,SE后NGB表达上调,且上调程度与海马神经元存活数呈正相关,提示NGB可能是癫痫发作所致缺血缺氧的一种神经保护代偿机制。然而,目前对于癫痫发作后认知功能改变具体机制研究矛盾不一,因此,仍需大量研究深入探讨。另外,对癫痫的治疗提出新的挑战,不能只局限于控制癫痫症状,也应考虑癫痫患者未来生活质量问题。
| [1] |
Knake S, Hamer HM, Rosenow F. Status epilepticus:A critical review[J]. Epilepsy Behav, 2009, 15: 10-14. DOI:10.1016/j.yebeh.2009.02.027 |
| [2] |
Van Bogaert P, Urbain C, Galer S, et al. Impact of focal interictal epileptiform discharges on behaviour and cognition in children[J]. Neurophysiol Clin, 2011, 42: 53-58. |
| [3] |
Rose FC. Chapter 39:an historical overview of British neurology[M]. In:Finger S, Boller F, Tyler KL, eds. Handbook of Clinical Neurology:History of Neurology. Edinburgh:Elsevier; 2010, 95:613-628.
|
| [4] |
Yu ZY, Liu N, Liu JX, et al. Neuroglobin, a novel target for endogenou neuroprotection against stroke and neurodegenerative disorders[J]. Int J Mol SCI, 2012, 13(7): 6995-7014. |
| [5] |
Sun YJ, Jin KL, Peel A, et al. Neuroglobin protects the brain from experimental stroke in vivo[J]. Proc Natl Acad Sci, 2003, 100(11): 3497-3500. |
| [6] |
Racine RJ, Gartner JG, Burnham WM. Epileptiform activity and neural plasticity in limbic structures[J]. Brain Res, 1972, 47: 262-268. DOI:10.1016/0006-8993(72)90268-5 |
| [7] |
Paxinos G, Watson CR, Emson PC. AChE-stained horizontal sections of the rat brain in stereotaxic coordinates[J]. J Neurosci Methods, 1980, 3(2): 129-149. DOI:10.1016/0165-0270(80)90021-7 |
| [8] |
Kalemenev SV, Zubareva OE, Sizov VV, et al. Memantine attenuates cognitive impairments after status epilepticus induced in a lithium-pilocarpine model[J]. Doklady Akademii Nauk, 2016, 470(6): 732-735. |
| [9] |
Marques CM, Caboclo LOSF, da Silva TI, et al. Cognitive decline in temporal lobe epilepsy due to unilateral hippocampal sclerosis[J]. Epilepsy Behav, 2007, 10: 477-485. DOI:10.1016/j.yebeh.2007.02.002 |
| [10] |
Abrahams S, Morris RG, Polkey CE, et al. Hippocampal involvement in spatial and working memory:a structural MRI analysis of patients with unilateral mesia temporal lobe sclerosis[J]. Brain Cognit, 1999, 41(1): 39-65. DOI:10.1006/brcg.1999.1095 |
| [11] |
Norwood BA, Bumanglag AV, Osculati F, et al. Classic hippocampal sclerosis and hippocampal-onset epilepsy produced by a single "cryptic" episode of focal hippocampal excitation in awake rats[J]. J Comp Neurol, 2010, 518(16): 3381-3407. DOI:10.1002/cne.v518:16 |
| [12] |
Edalatmanesh MA, Nikfarjam H, Vafaee F, et al. Increased hippocampal cell density and enhanced spatial memory in the valproic acid rat model of autism[J]. Brain Res, 2013, 1526(12): 15-25. |
| [13] |
Bernhardt BC, Worsley KJ, Kim H, et al. Longitudinal and cross-sectional analysis of atrophy in pharmacoresistant temporal lobe epilepsy[J]. Neurology, 2009, 72(20): 1747-1754. DOI:10.1212/01.wnl.0000345969.57574.f5 |
| [14] |
Vaessen MJ, Jansen JF, Vlooswijk MC, et al. White matter abnormalities are associated with cognitive decline in chronic epilepsy[J]. Cereb Cortex, 2012, 22(9): 2139. DOI:10.1093/cercor/bhr298 |
| [15] |
Shinnar S, Bello JA, Chan S, et al. MRI abnormalities following febrile status epilepticus in children:The FEBSTAT study[J]. Neurology, 2012, 79(9): 871-877. DOI:10.1212/WNL.0b013e318266fcc5 |
| [16] |
Burmester T, Weich B, Reinhardt S, et al. A vertebrate globin expressed in the brain[J]. Nature, 2000, 407(10): 520-523. |
| [17] |
Chen XM, Liu Y, Zhang L, et al. Long-term neuroglobin expression of human astrocytes following brain trauma[J]. Neurosci Letters, 2015, 606(4): 194-199. |
| [18] |
Li RC, Lee SK, Pouranfar F, et al. Hypoxia diferentially regulates the expression of neuroglobin and cytoglobin in rat brain[J]. Brain Res, 2006, 1096(1): 173-179. DOI:10.1016/j.brainres.2006.04.063 |
| [19] |
Li SQ, Li WB, Zhang M, et al. The role of neuroglobin in the neuroprotection of limb ischemic preconditioning in rats[J]. Mol Neurobiol, 2013, 47(2): 197-208. |
| [20] |
Shang A, Zhou D, Wang L, et al. Increased neuroglobin levels in the cerebral cortex and serum after ischemia-reperfusion insults[J]. Brain Res, 2006, 1078(10): 219-226. |
 2017, Vol. 44
2017, Vol. 44




