扩展功能
文章信息
- 张钱林, 孟兰芳, 赵丽娟, 袁丽品, 张杰文
- ZHANG Qian-Lin, MENG Lan-Fang, ZHAO Li-Juan, YUAN Li-Pin, ZHANG Jie-Wen
- 中老年初次脑梗死发作后血管性痴呆的相关影响因素分析
- Influencing factors for vascular dementia after the first brain infarction attack in middle-aged and elderly patients
- 国际神经病学神经外科学杂志, 2017, 44(5): 492-497
- Journal of International Neurology and Neurosurgery, 2017, 44(5): 492-497
-
文章历史
收稿日期: 2017-06-12
修回日期: 2017-09-14
2. 新疆生产建设兵团第十三师红星医院神经内科, 新疆哈密市 839000
血管性痴呆(vascular dementia, VD)是中老年脑梗死患者最常见的后遗症之一,主要表现为记忆、语言等认知功能异常、部分不良行为、睡眠障碍等[1],严重影响患者的身心健康甚至生命,也为家庭和社会带来了沉重负担。对于VD目前尚无效果理想的治疗方案,仍以预防为主,因此,探讨发病的影响因素是VD领域的研究重点之一[2]。VD发病原因一般是反复性脑卒中引起的脑组织损伤等[3],但初次脑梗死后发生VD的几率也不容忽视。目前关于初次脑梗死后出现VD的影响因素尚无详细报道。因此,本研究通过回顾性分析中老年脑梗死患者初次发病时的临床资料,探讨VD发生的危险因素,以期提高对该病的认识并制定更有效的预防控制措施。
1 资料和方法 1.1 病例收集收集2014年1月至2016年2月在河南省人民医院就诊的213例中老年脑梗死患者的资料作为研究数据。
病例纳入标准:①年龄在45~75岁之间。②主诉有神经功能缺损症状,经头颅CT或MRI检查证实有缺血性病灶,符合第四届全国脑血管病学术会议制定的脑梗死诊断标准。③无既往病史,为初次发病;④病历及检查资料完整。
排除标准:①发病3个月内死亡,或存在严重意识障碍、生命体征不稳等不能进行正常检测的病例。②有精神疾病史或脑外伤史。③合并有其他可能影响认知和智力的疾病(如帕金森病和脑梗死后抑郁症等。
1.2 病例分组将初次脑梗死发病3个月后出现血管性痴呆的患者作为VD组,未出现血管性痴呆者作为对照组。VD组病例均符合美国精神医学会《精神障碍诊断和统计手册》第Ⅴ版(Diagnostic and Statistical Manual of Ment-al Disorders, 5th edition, DSM-V)和Hachinski缺血指数量表(HIS)关于痴呆的诊断标准,并进行简易智力状态检查量表(MMSE)、蒙特利尔智能评估量表(MOCA)评分。
1.3 观察指标两组患者的病例资料包括以下部分:①一般资料,包括年龄、性别、受教育程度(分为受教育年限≤6年和 > 6年两类[4])、VD家族史、吸烟(一生累积吸烟超过100根视为吸烟,从不吸烟或有吸烟史但戒烟满1年以上视为不吸烟[5])、喝酒(平均每周酒精摄入量超过30 g视为喝酒,从不喝酒或戒酒满1年以上视为不喝酒[5])。②头颅CT或MRI:脑梗死部位和面积(DWI序列测量的病灶最大横截面积或多病灶截面积之和),其他脑部病变。③颈动脉彩超:颈动脉血管异常情况,包括血管内壁是否光滑、是否有明显的软硬斑块、血管硬化、严重狭窄闭塞等。④心电图检查。⑤血浆同型半胱氨酸(homocysteine, Hcy)浓度:酶循环法。⑥合并常见慢性病:对于无相关类病史者,测量血压 > 140/90 mm Hg补充为高血压患者;空腹/餐后血糖 > 7/11 mmol/L补充为糖尿病患者;总胆固醇 > 5.7 mmol/L,低密度脂蛋白 > 3.64 mmol/L,甘油三酯> 1.7 mmol/L补充为高脂血患者。⑦随访:调查患者就诊后的治疗措施以及出院后进行的后续治疗方案。
1.4 统计学分析所有数据采用SPSS 19.0进行分析处理,计量资料以均数±标准差(x±s)表示,采用独立样本t检验分析差异;计数资料采用χ2检验比较,均以P < 0.05为差异有统计学意义。采用单因素Logistic回归和多因素Logistic条件回归筛选出VD发病的影响因素,并将有意义的计量指标进行ROC曲线分析,利用尤登指数确定具体诊断标准。
2 结果 2.1 组间资料比较从表 1可以看出VD组患者认知能力明显低于对照组(P < 0.05)。从表 2可以看出,两组在年龄、吸烟、喝酒等因素上差异有统计学意义(P < 0.05)。图 1和图 2所示为不同组别患者脑梗死发病时的影像学检查结果差异。
| HIS评分 | MMSE评分 | MOCA评分 | |
| VD组 | 12.3±4.5 | 19.2±5.1 | 21.4±3.8 |
| 对照组 | 5.2±1.6* | 24.3±6.5* | 25.3±3.6* |
| t | 14.653 | 6.547 | 5.216 |
| P | < 0.001 | 0.002 | 0.008 |
| 检查项目 | 指标 | VD组(n=73) | 对照组(n=140) | t/χ2 | P |
| 临床基本资料调查 | 性别(男) | 46(63.0) | 87(62.1) | 0.016 | 0.901 |
| 年龄 | 64.2±10.1 | 58.6±9.4 | 2.738 | 0.006 | |
| 吸烟 | 37(50.7) | 47(33.6) | 5.884 | 0.015 | |
| 喝酒 | 47(64.4) | 65(46.4) | 4.142 | 0.045 | |
| 受教育程度( > 6年) | 26(35.6) | 75(53.6) | 8.703 | 0.004 | |
| 家族史 | 16(21.9) | 26(18.6) | 0.339 | 0.560 | |
| 头颅MRI | 脑部梗死面积(cm2) | 7.55±3.50 | 5.38±2.15 | 6.083 | < 0.001 |
| 脑萎缩 | 19(26.0) | 9(6.4) | 16.142 | < 0.001 | |
| 脑白质病变 | 16(21.9) | 55(39.3) | 6.513 | 0.014 | |
| 颈动脉彩超 | 血管软硬斑 | 11(15.1) | 25(17.8) | 0.266 | 0.072 |
| 血管内壁粗糙 | 3(4.1) | 10(7.1) | 0.770 | 0.549 | |
| 血管硬化 | 38(52.0) | 72(51.4) | 0.008 | 0.931 | |
| 血管狭窄闭塞 | 45(61.6) | 80(57.1) | 0.401 | 0.527 | |
| 心电图 | 早搏 | 8(10.9) | 17(12.1) | 0.065 | 0.799 |
| 房颤 | 10(13.7) | 21(15) | 0.065 | 0.798 | |
| 心梗/心肌缺血 | 36(49.3) | 48(34.3) | 4.538 | 0.033 | |
| 心律异常 | 5(6.8) | 5(3.6) | 1.152 | 0.283 | |
| 合并疾病 | 高血压 | 46(63.0) | 60(42.9) | 7.798 | 0.005 |
| 高血脂 | 46(63.0) | 79(56.4) | 0.858 | 0.354 | |
| 糖尿病 | 35(47.9) | 37(26.4) | 9.927 | 0.002 | |
| 冠心病 | 13(17.8) | 30(21.4) | 0.390 | 0.532 | |
| Hcy(μmol/L) | 22.34±3.16 | 15.31±2.84 | 16.321 | < 0.001 | |
| 治疗措施 | 血管内干预治疗 | 57(78.1) | 102(72.8) | 0.692 | 0.405 |
| 出院后药物治疗 | 64(87.7) | 115(82.1) | 1.093 | 0.296 | |
| 出院后康复治疗 | 49(67.1) | 112(80) | 4.311 | 0.038 |
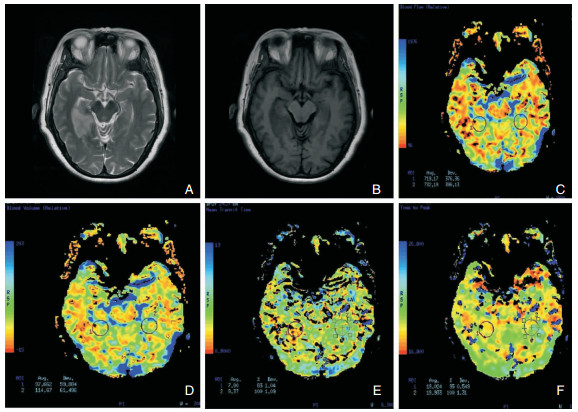
|
| 图 1 对照组非痴呆病例影像学检查结果 注:A:T2WI;B:T1WI;C:脑血容量(CBV);D:脑血流量(CBF);E:平均通过时间(MTT);F:达峰值时间(TTP)。诊断结果为右侧颞叶海马及海马旁回﹣扣带回胼胝体压部水平﹣胼胝体压部和右侧丘脑脑梗死。 |
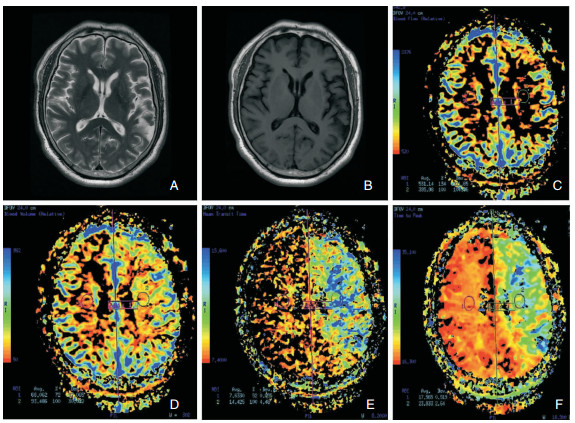
|
| 图 2 VD组病例影像学检查结果 注:A:T2WI;B:T1WI;C:脑血容量(CBV);D:脑血流量(CBF);E:平均通过时间(MTT);F:达峰值时间(TTP)。诊断结果为左侧额顶叶、侧脑室旁和半卵圆中心部位大面积脑梗死。 |
以分组变量为因变量,对两组间有差异的指标进行单因素Logistic回归分析,结果如表 3所示,年龄、吸烟、喝酒、脑梗死面积、脑萎缩、脑白质病变、心梗、高血压、糖尿病和Hcy是脑梗死后VD发病的危险因素,受教育程度和出院后康复治疗是保护因素。
| 指标 | B | P | OR | OR的95%CI | |
| 下限 | 上限 | ||||
| 年龄 | 1.589 | 0.000 | 4.900 | 2.646 | 9.075 |
| 吸烟 | 0.710 | 0.016 | 2.034 | 1.141 | 3.623 |
| 喝酒 | 0.735 | 0.013 | 2.086 | 1.164 | 3.736 |
| 受教育水平 | -0.954 | 0.002 | 0.385 | 0.209 | 0.711 |
| 梗死面积 | 0.289 | 0.000 | 1.335 | 1.188 | 1.5 |
| 脑萎缩 | 1.633 | 0.000 | 5.121 | 2.180 | 12.031 |
| 脑白质病变 | 0.835 | 0.032 | 1.434 | 1.201 | 4.022 |
| 心梗 | 0.623 | 0.034 | 1.865 | 1.048 | 3.319 |
| 高血压 | 0.820 | 0.006 | 2.272 | 1.270 | 4.062 |
| 糖尿病 | 0.942 | 0.002 | 2.564 | 1.417 | 4.641 |
| Hcy | 3.074 | 0.000 | 5.831 | 2.320 | 15.634 |
| 出院后康复治疗 | -0.673 | 0.040 | 0.510 | 0.269 | 0.968 |
纳入单因素回归分析结果中有意义的指标进行多因素Logistic回归分析,结果如表 4所示。结果显示,高龄、较大脑梗死面积、合并有脑萎缩、脑白质病变、高血压、糖尿病和高Hcy是VD发病的独立危险因素,受教育水平和出院后康复治疗是独立保护因素,而吸烟、喝酒和心梗被移除了,可能为非独立危险因素。
| 指标 | B | P | OR | OR的95%CI | |
| 下限 | 上限 | ||||
| 年龄 | 1.797 | 0.000 | 6.030 | 2.739 | 13.277 |
| 受教育水平 | -1.634 | 0.000 | 0.195 | 0.083 | 0.459 |
| 梗死面积 | 0.316 | 0.000 | 1.372 | 1.192 | 1.578 |
| 脑萎缩 | 1.654 | 0.003 | 5.226 | 1.725 | 15.833 |
| 脑白质病变 | 0.835 | 0.025 | 1.434 | 1.201 | 4.022 |
| 高血压 | 0.853 | 0.027 | 2.346 | 1.099 | 5.055 |
| 糖尿病 | 0.820 | 0.042 | 2.271 | 1.032 | 4.998 |
| Hcy | 2.064 | 0.000 | 5.921 | 2.012 | 16.344 |
| 出院后康复治疗 | -1.062 | 0.004 | 0.416 | 0.315 | 0.896 |
对年龄、脑梗死面积和Hcy三个连续变量进行ROC曲线分析获取cut-off值,结果如图 3和表 5所示。即年龄超过61岁,脑梗死面积大于5.67 cm2以及Hcy高于18.08 μmol/L视为高风险发生VD。
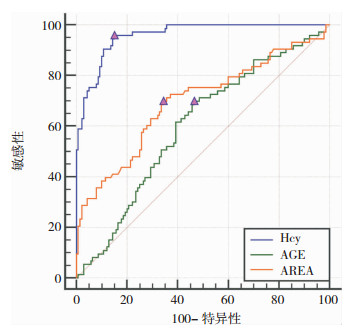
|
| 图 3 Hcy、年龄和脑梗死面积的ROC曲线分析 |
| 指标 | 曲线下面积 | 分类标准 | 尤登指数 | 95%CI | P值 |
| Hcy(μmol/L) | 0.959 | > 18.08 | 0.8089 | 0.924-0.982 | < 0.0001 |
| 年龄(岁) | 0.710 | > 61.1 | 0.3969 | 0.644-0.770 | 0.0001 |
| 脑梗死面积(cm2) | 0.696 | > 5.67 | 0.3558 | 0.629-0.757 | 0.0001 |
首发脑梗死与再发脑梗死的区别在于再发脑梗死造成的严重痴呆等伤残率更高,而首发脑梗死后造成痴呆受一系列因素的影响,可以进行预防和治疗[6]。脑梗死初次发病后发生痴呆的概率为20%~30%,而反复脑卒中或复发性脑梗死的这一概率可达50%以上[7]。国内外已有大量研究报道了脑梗死后VD发病的危险因素,但侧重点各有不同,因而结论也有差异。本研究重点分析中老年初次脑梗死发作后出现痴呆的影响因素,以期对现有临床结论加以验证和补充。本研究结果表明,高Hcy、高龄、较大梗死面积、合并有脑萎缩、脑白质病变、高血压及糖尿病是初次脑梗死患者出现VD的危险因素,较高受教育水平和出院后康复治疗是其保护因素,而吸烟、喝酒及合并有心梗可能是非独立危险因素。
老龄化是临床公认的VD危险因素之一,而Hcy水平与脑梗死以及VD的关系已得到许多研究的确证[8],其主要作用机制为参与含硫氨基酸的代谢,阻碍一氧化氮的产生,对神经细胞产生过氧化毒性从而加剧认知功能缺损。脑梗死与脑部疾病的相关性已得到许多研究的证实,梗死组织由于缺氧缺血可能造成脑白质脱髓鞘、多发性硬化等病变及脑萎缩,是导致痴呆发生的重要原因之一。Jung等[9]通过神经影像学检查发现,脑皮质萎缩会破坏脑白质的完整性,进而造成认知能力减退,增大皮质下VD的发生风险。现有研究也报道了高血压、高血脂及高血糖均是VD发生的危险因素[10-12],本研究结果基本与此一致,但未发现高血脂症与初次脑梗死后VD发生的相关性。脑梗死发病时的部位和面积是否是VD发病的危险因素也是当前研究重点之一,多项研究证实较大的梗死面积及多发性病灶的患者发生VD的概率较高[13, 14],也有报道称梗死部位(基底节区梗死和腔隙性脑梗死)也是影响因素之一[15]。受教育水平在一定程度上表征着认知开发程度,高文化程度者一般脑组织活动较为活跃,甚至可以在一定程度上降低脑梗死后脑组织的损伤程度,因此,受教育水平可视为VD发生的保护因素[16],而康复治疗是对神经功能的辅助恢复,肢体的协调性训练甚至可能增强脑部血流循环状态、促进神经细胞的修复和觉醒,从而降低VD的发生率[17]。本研究结论与以上研究观点基本一致。此外,还提示了吸烟、喝酒及心梗/心肌缺血可能是潜在的危险因素之一。现有研究也报道了酒精、吸烟以及心血管疾病对痴呆的风险 ,同时也提出了VD发病的其他危险因素,如颈动脉狭窄闭塞[20]、睡眠呼吸障碍[21]、尿素和胆红素水平[22]以及遗传因素[23]等,值得引起临床的重视。本研究结果未显示此类因素与首发脑梗后VD风险的相关性,可能尚需要进一步的数据证实。
综上所述,本研究结果表明,中老年初次脑梗死患者出现高Hcy( > 18.08 μmol/L)、高龄( > 61岁)、较大梗死面积( > 5.67 cm2)、脑萎缩或脑白质病变、合并有高血压及糖尿病等情况时,会增大痴呆发生的风险,而较高的受教育水平及积极的康复治疗会降低发病的几率,需要临床加以重点关注,并对可变因素进行改善和控制。
| [1] |
Etherton-Beer CD. Vascular cognitive impairment in dementia[J]. Maturitas, 2014, 79(2): 220-226. DOI:10.1016/j.maturitas.2014.06.004 |
| [2] |
Mori E. How Treatable is Vascular Dementia?[J]. Brain Nerve, 2016, 68(4): 441-450. |
| [3] |
Venkat P, Chopp M, Chen J. Models and mechanisms of vascular dementia[J]. Exp Neurol, 2015, 272: 97-108. DOI:10.1016/j.expneurol.2015.05.006 |
| [4] |
王蓓, 时恒屏, 李世滢, 等. 脑卒中患者智能状况及其与文化程度、基础疾病的相关性[J]. 中国临床康复, 2003, 7(25): 3486-3487. DOI:10.3321/j.issn:1673-8225.2003.25.039 |
| [5] |
Lou P, Chen P, Zhang L, et al. Interaction of sleep quality and sleep duration on impaired fasting glucose:a population-based cross-sectional survey in China[J]. BMJ Open, 2014, 4(3): e004436. DOI:10.1136/bmjopen-2013-004436 |
| [6] |
Kalaria RN, Akinyemi R, Ihara M. Stroke injury, cognitive impairment and vascular dementia[J]. Biochim Biophys Acta, 2016, 1862(5): 915-925. DOI:10.1016/j.bbadis.2016.01.015 |
| [7] |
孙会成, 荣阳, 孙卓, 等. 再发脑梗死的临床特征与病因分析[J]. 中国现代医生, 2008, 46(28): 54-55. DOI:10.3969/j.issn.1673-9701.2008.28.030 |
| [8] |
Wang B. Meta-analysis of plasma homocysteine content and cognitive function in elderly patients with Alzheimer's disease and vascular dementia[J]. Int J Clin Exp Med, 2014, 7(12): 5118-5123. |
| [9] |
Jung WB, Mun CW, Kim YH, et al. Cortical atrophy, reduced integrity of white matter and cognitive impairment in subcortical vascular dementia of Binswanger type[J]. Psychiatry Clin Neurosci, 2014, 68(12): 821-832. DOI:10.1111/pcn.12196 |
| [10] |
Emdin CA, Rothwell PM, Salimi-Khorshidi G, et al. Blood Pressure and Risk of Vascular Dementia:Evidence From a Primary Care Registry and a Cohort Study of Transient Ischemic Attack and Stroke[J]. Stroke, 2016, 47(6): 1429-1435. DOI:10.1161/STROKEAHA.116.012658 |
| [11] |
Appleton JP, Scutt P, Sprigg N, et al. Hypercholesterolaemia and vascular dementia[J]. Clin Sci (Lond), 2017, 131(14): 1561-1578. DOI:10.1042/CS20160382 |
| [12] |
Gudala K, Bansal D, Schifano F, et al. Diabetes mellitus and risk of dementia:A meta-analysis of prospective observational studies[J]. J Diabetes Investig, 2013, 4(6): 640-650. DOI:10.1111/jdi.2013.4.issue-6 |
| [13] |
陆才胜, 刘淑娟, 朱翠, 等. 青年脑梗死患者远期认知功能障碍的相关因素分析[J]. 国际神经病学神经外科学杂志, 2016, 43(4): 310-313. |
| [14] |
滕振杰, 冯静. 脑小血管病与卒中后认知障碍研究进展[J]. 国际神经病学神经外科学杂志, 2017, 44(1): 102-105. |
| [15] |
龙翠英, 郑春玲, 曹新亚, 等. 非痴呆型血管性认知障碍与脑梗死部位及TCD的相关性分析[J]. 中国实用神经疾病杂志, 2016, 19(22): 44-45. DOI:10.3969/j.issn.1673-5110.2016.22.026 |
| [16] |
Lane EM, Paul RH, Moser DJ, et al. Influence of education on subcortical hyperintensities and global cognitive status in vascular dementia[J]. J Int Neuropsychol Soc, 2011, 17(3): 531-536. DOI:10.1017/S1355617711000324 |
| [17] |
董军涛, 林阳阳, 燕铁斌, 等. 不同形式的运动训练对血管性痴呆大鼠学习记忆及海马区突触可塑性的影响[J]. 中国康复医学杂志, 2016, 31(7): 716-722. |
| [18] |
Zhong G, Wang Y, Zhang Y, et al. Smoking is associated with an increased risk of dementia:a meta-analysis of prospective cohort studies with investigation of potential effect modifiers[J]. PLoS One, 2015, 10(3): e118333. |
| [19] |
Liu W, Wong A, Law AC, et al. Cerebrovascular disease, amyloid plaques, and dementia[J]. Stroke, 2015, 46(5): 1402-1407. DOI:10.1161/STROKEAHA.114.006571 |
| [20] |
Kitagawa K, Miwa K, Yagita Y, et al. Association between carotid stenosis or lacunar infarction and incident dementia in patients with vascular risk factors[J]. Eur J Neurol, 2015, 22(1): 187-192. DOI:10.1111/ene.2014.22.issue-1 |
| [21] |
Ramos AR, Dib SI, Wright CB. Vascular Dementia[J]. Curr Transl Geriatr Exp Gerontol Rep, 2013, 2(3): 188-195. DOI:10.1007/s13670-013-0054-5 |
| [22] |
Kundur AR, Bulmer AC, Singh I. Unconjugated bilirubin inhibits collagen induced platelet activation[J]. Platelets, 2014, 25(1): 45-50. DOI:10.3109/09537104.2013.764405 |
| [23] |
Yoon CW, Kim YE, Seo SW, et al. NOTCH3 variants in patients with subcortical vascular cognitive impairment:a comparison with typical CADASIL patients[J]. Neurobiol Aging, 2015, 36(8): 2441-2443. |
 2017, Vol. 44
2017, Vol. 44




