扩展功能
文章信息
- 徐蛟天, 周磊, 王威, 陈孝祥, 林海, 杨智勇, 宋晓斌, 邓兴力
- XU Jiao-Tian, ZHOU Lei, WANG Wei, CHEN Xiao-Xiang, LIN Hai, YANG Zhi-Yong, SONG Xiao-Bin, DENG Xing-Li
- 芹黄素抑制小胶质细胞活化作用研究
- Apigenin inhibits activation of microglial cells:an experimental study
- 国际神经病学神经外科学杂志, 2017, 44(4): 383-388
- Journal of International Neurology and Neurosurgery, 2017, 44(4): 383-388
-
文章历史
收稿日期: 2017-03-15
修回日期: 2017-05-31
2. 云南省干细胞和再生医学重点实验室, 云南省昆明市 650032
2. Yunnan Key Laboratory of Stem Cell and Regenerative Medicine, Kunming 650032, China
帕金森病(Parkinson’s disease, PD)是一种年龄相关神经退行性疾病[1],其病理特点表现为黑质纹状体区域DA神经元的特异性减少[2],其临床特点主要表现为运动迟缓,姿势不稳、肌肉僵直、静止性震颤及其他各种非运动症状[3]。目前临床对于帕金森病的治疗仍无有效手段[4]。尽管帕金森的具体致病机制非常复杂,但是中枢神经系统的长期慢性炎症环境,特别是小胶质细胞活化引起的一系列炎症因子的释放,在多巴胺神经元的变性、死亡缺失的过程中具有重要作用[5]。有研究认为,中枢神经系统慢性炎症以及小胶质细胞的过度活化,两者的“病理联级”作用共同加速帕金森病的病理进程[6]。如何通过抑制小胶质细胞的活化来减轻中枢神经系统的炎症已成为临床治疗和预防帕金森病的关键。近年来关于黄酮类化合物——芹黄素(apigenin, API)研究表明,芹黄素具有广泛的抗炎、抗氧化以及神经保护等生物学作用[7]。故本研究拟以小胶质细胞为靶点,探讨芹黄素对活化小胶质细胞微环境的影响,从而进一步探讨芹黄素的神经保护作用机制,为帕金森病的早期预防奠定基础。
1 材料和方法 1.1 动物及主要设备健康SPF级新生Spraque-Dawley(SD)大鼠(SCXK湘20130004);细胞培养箱(Thermo);PCR扩增试剂(Promega)。荧光定量PCR仪(ABI Prism 7300);凝胶成像系统(Bio-rad);酶标仪(Bio-Tek);荧光显微镜(Olympus);电泳仪(Bio-rad);蛋白电泳系统(Bio-rad)。
1.2 实验材料及试剂细胞培养耗材(Corning);TRIzol (Takara);Alex-Fluor 594-conjugated Goat Anti-Rabbit IgG(Proteintech);芹黄素(美仑生物);CD11b/c(Proteintech, Source:rabbit);INOS (santa,Source:rabbit);FBS(BI);二抗(Proteintech);RIPA裂解液(Beyotime);二甲基亚砜(DMSO, Sigma);逆转录试剂盒(Fermentas);ELISA试剂盒(CUSABIO);DAPI(Beyotime)。引物(Genbank数据库)iNOS:上游5’-TACTACCAGATCGAGCCCTG-3’下游5’-GACAACCTTGGTGTTGAAGG-3’;GAPDH:上游5’-ACCACAGTCCATGCCATCAC -3’下游5’-TCCACCACCCTGTTGCTGTA -3’。
1.3 原代SD大鼠小胶质细胞的培养、纯化与鉴定 1.3.1 大鼠混合胶质细胞的培养取新生SD大鼠(1~2 d),消毒,解剖显微镜下取大脑皮质并剪碎,37℃、0.125%胰蛋白酶消化,血清终止消化,过滤、离心、重悬,单细胞悬液计数,调整细胞密度至5×106个/ml后接种细胞培养瓶,37℃、5%CO2培养箱培养。在倒置显微镜下每天观察细胞形态和生长情况。根据细胞代谢情况,每3~4 d半量换液。
1.3.2 SD大鼠小胶质细胞纯化混合胶质细胞培养7~9 d,细胞可见呈分层生长,小胶质细胞呈半贴壁生长,手拍法收集小胶质细胞,离心、重悬、计数,以8×105个/ml密度爬片,1~2 d后鉴定。
1.3.3 SD大鼠小胶质细胞鉴定取爬片细胞,PBS清洗,含4%多聚甲醛固定30 min,0.1%的PBST (PBS+Triton×100) 透膜15 min,10%BSA封闭1.5 h,一抗CD11b/c(1 :200)4℃孵育过夜,弃一抗,PBS清洗,二抗Alex-Fluor594(1 :100) 室温孵育30 min,PBS清洗,封片剂(含DAPI)封片后正置显微镜下拍照。
1.4 MTT法检测芹黄素对小胶质细胞活率的影响取纯化后小胶质细胞,芹黄素溶于DMSO,并分别以10 μM、20 μM、40 μM和60 μM处理,37℃、5% CO2条件培养24 h,对照组加入相同体积的DMSO。将芹黄素预处理后的小胶质细胞每孔104接种于24孔板。37℃、5% CO2条件培养1~2 d。严格按照MTT试剂盒(碧云天)说明操作,490 nm波长,在酶标仪上测各孔OD值。
1.5 ELISA法检测芹黄素预处理及LPS刺激后小胶质细胞活化的影响取纯化后小胶质细胞,分别以10 μM、20 μM和50 μM浓度芹黄素预处理24 h,对照组加入相同体积的DMSO。LPS(100 ng/ml)处理上述各组小胶质细胞,并设立对照组,37℃、5% CO2细胞培养箱培养12 h,完全培养基全量换液,收获待用。
上述处理后的各组细胞,取各组细胞培养液,ELISA法检测各组小胶质细胞培养液中炎症相关因子[白细胞介素-1(IL-1)、肿瘤坏死因子-α(TNF-α)和白细胞介素-10(IL-10)]以及神经营养因子[脑源性神经营养因子(brain derived neurotrophic factor, BDNF)、血小板源性神经营养因子(platelet derived neurotrophic factor, PDNF)和胶质细胞源性神经营养因子(glial cell-line derived neurotrophic factor, GDNF)]的表达水平。参照ELISA试剂盒说明(CUSABIO, 96T),分别设标准品孔(7个浓度)、空白对照孔和待测样品孔依次加样、显色、终止、读板。在反应终止后5 min内用酶标仪在490 nm波长测量各孔的OD值。
1.6 RT-PCR、western blot检测炎症相关基因iNOS转录以及表达水平收集细胞,提取细胞总RNA,逆转录成cDNA;设计iNOS基因引物,扩增目的基因,1%琼脂糖凝胶电泳,收集并分析数据;RIPA高效裂解液提取细胞总蛋白,BCA法蛋白定量,6%SDS-PAGE凝胶电泳,收集并分析数据。
1.7 统计学处理数据统计采用SPSS 17.0统计软件进行,各组数值用均数±标准差(x±s)表示,组间比较用t检验,P < 0.05时认为差异具有统计学意义。
2 结果 2.1 SD大鼠小胶质细胞的培养使用DMEM/F12完全培养基(含10%胎牛血清)培养SD大鼠混合胶质细胞9 d,小胶质细胞呈半悬浮生长,纯化后处于静息状态的小胶质细胞,呈分枝状、梭形等形态。DMSO处理12 h(图 1A)形态较静息状态无明显变化;LPS(100 ng/ml,Sigma)处理12 h,细胞突起缩短或消失,可见伪足,胞体变大、变圆,似阿米巴状,呈活化状态(图 1B)。
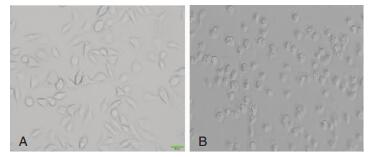
|
| 图 1 培养后的大鼠小胶质细胞(×100) 注:A:对照组;B:LPS(100ng/ml)刺激12h后的小胶质细胞。 |
结果显示,芹黄素在5~60 μM浓度范围,对小胶质细胞活率无明显影响,在100 μM浓度对细胞活性的影响有下降趋势。见图 2。
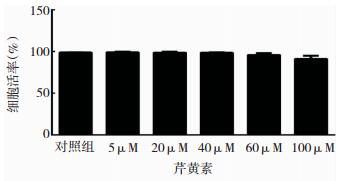
|
| 图 2 芹黄素对小胶质细胞活率的影响 |
荧光显微镜观察可见,小胶质细胞特异性抗体CD11b/c,免疫细胞化学染色鉴定结果阳性,纯化后小胶质细胞纯度>95%。荧光显微镜下观察,蓝色荧光为细胞核,绿色荧光为CD11b/c阳性细胞。对照组静息状态下小胶质细胞,胞体较小,呈梭形(图 3A);LPS处理12 h,小胶质细胞长突起回缩,胞体变大、变圆,可见有伪足状突起增多,似阿米巴状(图 3B);芹黄素预处理组(20 μM),LPS刺激后小胶质细胞形态较对照组无明显改变(图 3C)。
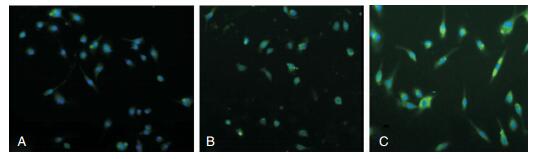
|
| 图 3 芹黄素对小胶质细胞活化的影响(×100) 注:A:对照组;B:LPS组;C:LPS+芹黄素组。 |
结果表明,LPS刺激后,小胶质细胞炎症因子IL-1和TNF-α表达量明显升高,而抗炎因子IL-10表达则呈相反趋势;芹黄素预处理组较单独LPS组,炎症因子IL-1和TNF-α都有明显下降,抗炎因子IL-10表达水平增高,而芹黄素处理组不同浓度之间炎症因子以及抗炎因子表达无显著差异。见图 4。
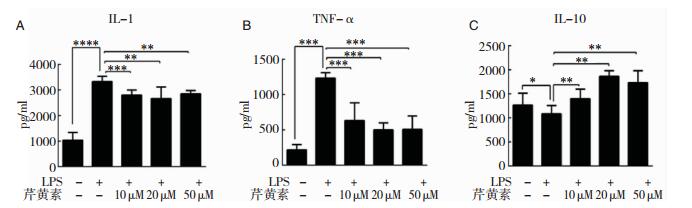
|
| 图 4 小胶质细胞分泌炎症因子的检测 注:A:IL-1;B:TNF-α;C:IL-10。*P < 0.05;**P < 0.01;***P < 0.001。 |
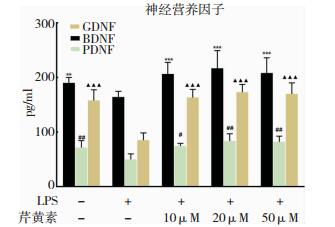
结果表明,芹黄素处理组神经营养因子表达明显高于单独LPS组。见图 5。
|
| 图 5 ELISA法检测各组培养液中细胞神经营养因子表达水平 注:**为与LPS组比较,P < 0.01;***P < 0.001;#为与LPS组比较,P < 0.05;##为与LPS组比较,P < 0.01;▲▲▲为与LPS组比较,P < 0.001。 |
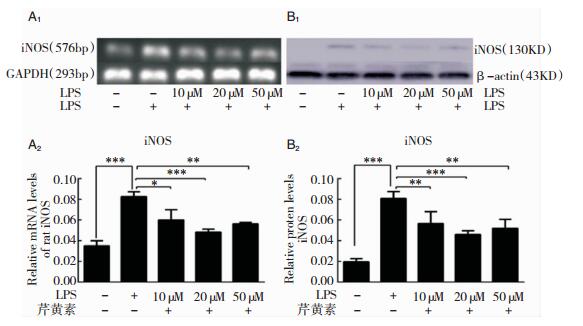
结果显示,单独LPS处理组iNOS基因的转录水平明显高于其他各组(图 6A1、图A2)。芹黄素处理组可显著抑制LPS刺激诱导型一氧化氮合酶(iNOS)的表达水平(图 6B1、图B2)。
|
| 图 6 RT-PCR和Western Blot检测炎症相关基因iNOS转录和表达水平 注:A1:各组iNOS基因以及内参GAPDH的转录mRNA电泳结果;A2:电泳结果灰度值分析计算各组iNOS基因相对转录水平;B1:各组iNOS基因以及内参GAPDH的蛋白电泳结果;B2:电泳结果灰度值分析计算各组iNOS蛋白相对表达量。**为与组比较,P < 0.01;***为与组比较,P < 0.001。 |
帕金森病(PD)为仅次于阿尔茨海默病的第二大神经退行性病变,其主要病理特征为黑质纹状体多巴胺能神经元进行性变性缺失和Lewy小体的形成[8]。对于帕金森疾病的治疗目前临床仍无有效的手段。左旋多巴胺的替代治疗,多巴胺受体激动剂以及深部脑刺激等手段可在一定程度上缓解部分帕金森病的症状,但仍无法有效阻止帕金森病的病理进展。与此同时,这些治疗手段带来的一系列不良反应更进一步限制了其应用前景[9]。尽管对帕金森的具体发病机制还不完全了解,目前的研究观点认为其可能与遗传环境多因素共同作用有关[10]。随着研究的深入,中枢神经系统长期慢性炎症、氧化应激、免疫异常和细胞凋亡等因素也参与帕金森病的病理进程[11]。而越来越多的证据表明帕金森病与炎症因素密切相关,特别是在帕金森病理进展的早期,炎症因素的存在可加快帕金森的病理进展[12]。目前对于包括帕金森在内的神经退行性病变,一旦发病很难再逆转其病理进程,而基于饮食摄入一些具有神经保护作用的物质,诸如具有抗炎症、抗氧化以及抑制细胞凋亡的食物或药物可以有效降低帕金森病的发病风险或者延缓其病理进程[13]。这也使人们意识到,相对于采取一系列手段去逆转帕金森的病理进展,而通过摄入具有抗炎以及神经保护作用的食品或者药品,通过帕金森的早期预防从而整体上降低帕金森的发病率可能会更具有现实意义。
芹黄素(apigenin, API)是一种无毒、无诱变性的黄酮类化合物,其作为一种天然植物成分,广泛存在于蔬菜和水果中[14]。芹黄素具有很多生物学功能,如抗炎、抗氧化和抑制细胞凋亡等生物学特性[15]。在阿尔茨海默病疾病模型的研究中发现,芹黄素是一种有效的MAPK抑制剂[16],其可通过消除由Aβ引起的细胞色素C释放和Caspase级联激活,降低皮质神经元的细胞凋亡从而发挥神经保护的作用[17]。通过对鼠类小胶质细胞株BV-2的研究发现,芹黄素无论是在细胞周期的早期或晚期都能诱导凋亡,表明芹黄素可能是通过调整细胞周期和诱导细胞凋亡抑制小胶质细胞增殖,与此同时芹黄素还可以抑制小胶质细胞的过度活化,抑制中枢神经系统炎症因子的产生从而发挥神经保护作用[18]。脂多糖(lipopolysccharide, LPS),作为一种促炎因子,可有效刺激小胶质细胞活化[19]。本研究结果显示,LPS刺激后的小胶质细胞,细胞形态会发生明显的改变,由静息长梭形、分枝状等形态变为阿米巴样。而芹黄素预处理组则在LPS刺激后形态无明显改变。LPS可促进活化的小胶质细胞分泌IL-1和TNF-α等促炎症因子[20],本研究结果显示,LPS刺激后,IL-1、TNF-α以及诱导型一氧化氮合酶(iNOS)表达水平较对照组都明显升高,而芹黄素预处理组上述因子的表达水平则有明显的降低趋势。这表明芹黄素可明显抑制LPS诱导的小胶质细胞活化。
IL-10是一种多功能负性调节因子,作为体内的一种抗炎性因子,其发挥下调炎症反应,拮抗炎性介质的作用[21]。本研究结果显示,芹黄素可有效降低LPS诱导后IL-1和TNF-α等炎症因子的表达水平,而对于IL-10的表达则与上述呈相反趋势。这表明芹黄素可能是通过上调抗炎因子的表达抑制炎症介质的产生,从而抑制小胶质细胞的持续活化。
正常生理条件下,小胶质细胞在中枢神经系统表现为免疫监视状态(M2型),可抑制破坏性的免疫反应,并同时分泌神经营养因子,从而对神经元起营养支持并产生创伤修复作用。活化状态的小胶质细胞(M1型)则分泌高水平的氧化代谢产物以及促炎因子,这种状态的持续存在则对神经元产生损伤作用[22]。本研究结果显示,LPS刺激后的小胶质细胞,GDNF、BDNF和PDNF分泌水平都明显降低,而芹黄素预处理组相对于LPS组,上述因子则有明显增高趋势。这表明芹黄素在抑制小胶质细胞过度活化的同时可促进神经营养因子的分泌。
综上所述,本研究结果证实,芹黄素可有效抑制LPS刺激后小胶质细胞的活化,在抑制促炎症因子分泌的同时可上调一些抗炎因子以及BDNF、GDNF和PDNF等与多巴胺成熟相关神经营养因子的分泌。这有望成为帕金森病的临床治疗以及早期预防新的突破口。有研究报道芹黄素的抗炎作用可能与P2X7/NF-κB信号通路有关[23],本研究通过一些炎症因子的检测表明,在中枢神经系统芹黄素可通过抑制小胶质细胞的活化产生抗炎作用,但并未对其机制以及可能存在的信号通路做深入的研究。另外,对芹黄素药效以及药理作用的研究还需要通过动物体内实验做更深入的探讨。
鸣谢 感谢昆明医科大学生物医学工程中心为本研究提供的设备及技术支持。| [1] |
邓兴力, 王应莉, 杨智勇, 等. SPIO、EGFP双标GDNF基因修饰中脑神经干细胞移植治疗帕金森病[J]. 中风与神经疾病杂志, 2010, 27(2): 109-112. |
| [2] |
Takahashi J. iPS cell therapy for Parkinson's disease[J]. Rinsho Ketsueki, 2016, 57(8): 1080-1086. |
| [3] |
Zach H, Dirkx M, Pasman JW. The patient's perspective:The effect of levodopa on Parkinson symptoms[J]. Parkinsonism Relat Disord, 2017, 35: 48-54. DOI:10.1016/j.parkreldis.2016.11.015 |
| [4] |
De Virgilio A, Greco A, Fabbrini G, et al. Parkinson's disease:Autoimmunity and neuroinflammation[J]. Autoimmun Rev, 2016, 15(10): 1005-1011. DOI:10.1016/j.autrev.2016.07.022 |
| [5] |
Kaur B, Prakash A. Ceftriaxone attenuates glutamate-mediated neuro-inflammation and restores BDNF in MPTP model of Parkinson's disease in rats[J]. Pathophysiology, 2017, 24(2): 71-79. DOI:10.1016/j.pathophys.2017.02.001 |
| [6] |
Russo I, Berti G, Plotegher N, et al. Erratum to:Leucine-rich repeat kinase 2 positively regulates inflammation and down-regulates NF-kappaB p50 signaling in cultured microglia cells[J]. J Neuroinflammation, 2016, 13(1): 70. DOI:10.1186/s12974-016-0535-5 |
| [7] |
Hassan SM, Khalaf MM, Sadek SA, et al. Protective effects of apigenin and myricetin against cisplatin-induced nephrotoxicity in mice[J]. Pharm Biol, 2017, 55(1): 766-774. DOI:10.1080/13880209.2016.1275704 |
| [8] |
George S, Brundin P. Immunotherapy in Parkinson's Disease:Micromanaging Alpha-Synuclein Aggregation[J]. J Parkinsons Dis, 2015, 5(3): 413-424. DOI:10.3233/JPD-150630 |
| [9] |
Shen Y, Huang J, Liu L, et al. A Compendium of Preparation and Application of Stem Cells in Parkinson's Disease:Current Status and Future Prospects[J]. Front Aging Neurosci, 2016, 8: 117. |
| [10] |
Kalinderi K, Bostantjopoulou S, Fidani L. The genetic background of Parkinson's disease:current progress and future prospects[J]. Acta Neurol Scand, 2016, 134(5): 314-326. DOI:10.1111/ane.2016.134.issue-5 |
| [11] |
Clark LF, Kodadek T. The Immune System and Neuroinflammation as Potential Sources of Blood-Based Biomarkers for Alzheimer's Disease, Parkinson's Disease, and Huntington's Disease[J]. ACS Chem Neurosci, 2016, 7(5): 520-527. DOI:10.1021/acschemneuro.6b00042 |
| [12] |
Alam Q, Alam MZ, Mushtaq G, et al. Inflammatory Process in Alzheimer's and Parkinson's Diseases:Central Role of Cytokines[J]. Curr Pharm Des, 2016, 22(5): 541-548. DOI:10.2174/1381612822666151125000300 |
| [13] |
Balez R, Steiner N, Engel M, et al. Neuroprotective effects of apigenin against inflammation, neuronal excitability and apoptosis in an induced pluripotent stem cell model of Alzheimer's disease[J]. Sci Rep, 2016, 6: 31450. DOI:10.1038/srep31450 |
| [14] |
Mafuvadze B, Benakanakere I, Lopez Perez FR, et al. Apigenin prevents development of medroxyprogesterone acetate-accelerated 7, 12-dimethylbenz(a)anthracene-induced mammary tumors in Sprague-Dawley rats[J]. Cancer Prev Res (Phila), 2011, 4(8): 1316-1324. DOI:10.1158/1940-6207.CAPR-10-0382 |
| [15] |
Wang J, Liu YT, Xiao L, et al. Anti-inflammatory effects of apigenin in lipopolysaccharide-induced inflammatory in acute lung injury by suppressing COX-2 and NF-kB pathway[J]. Inflammation, 2014, 37(6): 2085-2090. DOI:10.1007/s10753-014-9942-x |
| [16] |
Lim W, Park S, Bazer FW, et al. Apigenin Reduces Survival of Choriocarcinoma Cells by Inducing Apoptosis via the PI3K/AKT and ERK1/2 MAPK Pathways[J]. J Cell Physiol, 2016, 231(12): 2690-2699. DOI:10.1002/jcp.25372 |
| [17] |
Qin W, Ren B, Wang S, et al. Apigenin and naringenin ameliorate PKCbetaⅡ-associated endothelial dysfunction via regulating ROS/caspase-3 and NO pathway in endothelial cells exposed to high glucose[J]. Vascul Pharmacol, 2016, 85: 39-49. DOI:10.1016/j.vph.2016.07.006 |
| [18] |
Li KC, Ho YL, Hsieh WT, et al. Apigenin-7-glycoside prevents LPS-induced acute lung injury via downregulation of oxidative enzyme expression and protein activation through inhibition of MAPK phosphorylation[J]. Int J Mol Sci, 2015, 16(1): 1736-1754. DOI:10.3390/ijms16011736 |
| [19] |
Cunha C, Gomes C, Vaz AR, et al. Exploring New Inflammatory Biomarkers and Pathways during LPS-Induced M1 Polarization[J]. Mediators Inflamm, 2016, 2016: 6986175. |
| [20] |
Bonfill-Teixidor E, Otxoa-de-Amezaga A, Font-Nieves M, et al. Differential expression of E-type prostanoid receptors 2 and 4 in microglia stimulated with lipopolysaccharide[J]. J Neuroinflammation, 2017, 14(1): 3. DOI:10.1186/s12974-016-0780-7 |
| [21] |
Sobrinho AP, Minho AS, Fernandes PD. Characterization of anti-inflammatory effect and possible mechanism of action of Tibouchina granulosa[J]. J Pharm Pharmacol, 2017, 69(6): 706-713. DOI:10.1111/jphp.2017.69.issue-6 |
| [22] |
Chen Z, Trapp BD. Microglia and neuroprotection[J]. J Neurochem, 2016, 136(Suppl 1): 10-17. |
| [23] |
Chang X, He H, Zhu L, et al. Protective effect of apigenin on Freund's complete adjuvant-induced arthritis in rats via inhibiting P2X7/NF-kappaB pathway[J]. Chem Biol Interact, 2015, 236: 41-46. DOI:10.1016/j.cbi.2015.04.021 |
 2017, Vol. 44
2017, Vol. 44




