扩展功能
文章信息
- 周瑾瑕, 李东方, 毕方方
- ZHOU Jin-Xia, LI Dong-Fang, BI Fang-Fang
- 自噬在Duchenne型肌营养不良中的研究
- Role of autophagy in Duchenne muscular dystrophy
- 国际神经病学神经外科学杂志, 2017, 44(4): 365-369
- Journal of International Neurology and Neurosurgery, 2017, 44(4): 365-369
-
文章历史
收稿日期: 2017-03-06
修回日期: 2017-06-08
Duchenne型肌营养不良症(Duchenne muscular dystrophy, DMD)一种罕见的全身肌肉进行性消耗和运动功能减退的X染色体隐性致死性遗传性肌肉疾病[1]。其临床特点为进行性肌无力和肌萎缩伴小腿腓肠肌假性肥大,病理表现为线粒体肿胀及受损、蛋白质聚集物、肌浆网膨胀等。DMD的发病机制尚未明确,目前该疾病无法完全治愈。
自噬是一种存在于真核细胞中的“自我消化”过程,能抵御病原体的入侵,并对延缓衰老和延长寿命等均具有积极作用[2]。当自噬被干扰,可导致异常蛋白质和细胞器的聚集,影响正常细胞生长,诱发多种急慢性疾病。微管结合蛋白轻链3(microtubule-associated protein I light chain 3, LC3) 是哺乳动物常见的自噬小体标记物,其参与了自噬的形成[3]。胞浆型LC3(即LC3-Ⅰ)转化为膜型的LC3-Ⅱ,从而启动自噬。LC3-Ⅱ能调控自噬小体的形成,因此,其含量在某种程度上能反映细胞自噬活性。p62是哺乳动物选择性自噬的底物及调节蛋白,它与LC3相互作用,在自噬体形成和降解过程中起重要作用[4]。
近年来有学者发现自噬功能障碍参与了DMD表型的mdx小鼠肌细胞坏死进程,从而提出调节自噬有望成为一种新的药物靶点用来治疗DMD[5]。然而,迄今为止尚无关于DMD患者骨骼肌中自噬表达的相关研究。本研究采用半定量Western blot检测LC3和p62在DMD患者骨骼肌细胞中的表达,判断自噬功能与DMD患者骨骼肌细胞的坏死的关系,为研究调节自噬功能作为新的DMD治疗策略奠定基础。
1 研究对象与方法 1.1 研究对象入选2008年1月~2015年5月在中南大学湘雅医院神经内科病理确诊DMD患者81例,对照组为同时期就诊怀疑肌病,病理学检查未见明显异常者6例。所有入选者均进行了肌电图、血清心肌酶学检查、骨骼肌活检、常规酶组织化学染色、dystrophin蛋白及dysferlin蛋白免疫组织化学染色检查。
1.2 研究方法 1.2.1 常规酶组织化学染色所有参与者均进行肱二头肌肌肉活检术。离体新鲜骨骼肌标本快速制成冰冻标本。将DMD组和对照组的冷冻骨骼肌标本进行连续8 μm的冰冻切片,行标准化NADH-TR染色、苏木素-伊红染色(hematoxylin-eosin staining, HE)、细胞色素C氧化酶染色、改良Gomori三原色染色、琥珀酸脱氢酶染色、酸性磷酸酶染色、ATPase染色、油红O染色及过碘酸雪夫染色。
1.2.2 免疫组织化学染色将前述切好的8 μm的冰冻切片自然晾干后进行免疫组化染色(ABC法)。切片浸入-20℃丙酮溶液10 min,0.01 M PBS漂洗3次;4℃甲醇/0.3%双氧水(H2O2)漂洗30 min;0.01 M PBS再次漂洗3次;0.05体积分数的小牛血清/0.01 M PBS行背景封闭(37℃,15 min);Ⅰ抗(抗Dystrophin-N, -C, -R抗体1 :50或抗dysferlin抗体1 :50)4℃置48 h;0.01 M PBS漂洗3次;Ⅱ抗(1 :200) 37℃置1.5 h;0.01 M PBS漂洗3次;AB复合物(1 :100) 37℃置1.5 h;0.01 M PBS漂洗3次;Tris-HCL缓冲液37℃孵育15 min;DAB显色5 min;蒸馏水漂洗。自来水冲洗充分后,苏木素轻度复染,用梯度乙醇脱水和二甲苯脱水、透明,最后中性树脂胶封片
1.2.3 蛋白提取及Western blot随机挑选6例DMD及6例对照组骨骼肌组织0.05 g加入300 μl RIPA裂解液于匀浆器中反复研磨后置冰上裂解30 min,随后4℃,12000 rpm离心15 min,留取上清,-80℃保存。BCA蛋白定量试剂盒(Sigma, USA)进行蛋白浓度测定。取蛋白样本50 μg/孔,加入5X SDS-PAGE上样缓冲液,调整最终上样体积为10 μl,煮沸10 min后进行SDS-PAGE电泳,转膜,10%BSA溶液封闭,加入稀释好的抗体工作液,4℃过夜孵育,TBST洗膜3次。再加入HRP标记的抗人IgG二抗,TBST洗膜3次后,加上化学发光底物,于暗室内压片、曝光、显影和定影。
1.3 统计学分析运用SPSS 19.0进行统计学分析,计量资料用均数±标准差(x±s)表示,临床资料组间比较采用Mann-Whitney U检验,半定量Western blot组间比较采用t检验。当P < 0.05时为差异有统计学意义。
2 结果 2.1 一般资料分析DMD组在年龄、性别与对照组无明显统计学差异(P>0.05);但DMD组分别有3.7%、14.8%和7.4%患者有早产史、缺氧史和阳性家族史,而对照组均无相关个人史。见表 1。
| 项目 | DMD(n=81) | 对照组(n=6) | P值 |
| 年龄 | 10.11±3.08 | 12.24±4.29 | 0.47 |
| 性别(男/女) | 81/0 | 6/0 | 1.0 |
| 起病年龄 | 4.60±2.35 | - | - |
| 早产儿 | 3(3.70) | 0 | - |
| 出生时缺氧史 | 12(14.81) | 0 | - |
| 家族史 | 6(7.41) | 0 | - |
DMD患者首发症状表现多以双下肢起病为主,其中双下肢无力51例(62.96%),四肢无力3例(3.70%)。另以发现转氨酶升高为主诉者9例(11.11%),肌酶升高为主诉者3例(3.70%)。78例患者有不同程度的腓肠肌肥大坚韧、翼状肩胛、“鸭步”步态和Gower征阳性(96.29%)。39例患者出现程度不同的肌萎缩(48.15%),以肢体近端萎缩多见。
对照组首发症状表现为双上眼睑下垂3例,四肢乏力2例,肝功能异常1例。所有对照组患者均无肌萎缩、腓肠肌肥大坚韧、翼状肩胛、步态异常、Gower征及病理征。6例对照组患者肌电图检查提示无异常者1例,肌源性损害2例,类肌源性损害3例。
2.3 血清肌酸激酶水平检测81例DMD患者血清肌酸激酶(creatine kinase, CK)均显著升高,位于5547~26589 U/L之间(正常值:24~190 U/L)。DMD患者血清CK值在发病初期随病程增加呈上升趋势,持续约3~4年,随后呈整体下降趋势。对照组中除1例患者CK值轻度升高(205.5 U/L)外,余5例CK值均在正常范围。见图 1。

|
| 图 1 DMD患者血清CK值与病程变化趋势图 |
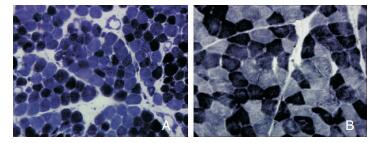
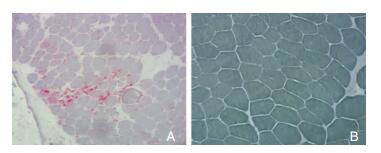
81例DMD患者骨骼肌活检均呈慢性肌营养不良改变。光镜下HE染色见大量萎缩肌纤维,变性、坏死和再生肌纤维,以及炎性细胞浸润(图 2A和图 2B)。ATPase染色可见呈镶嵌式分布的两型肌纤维,无同型肌纤维群化现象。细胞色素C氧化酶染色、NADH脱氢酶(图 3A和图 3B)和琥珀酸脱氢酶染色均可见部分肌纤维酶活性局限性增高或减低。12例油红O染色可见部分肌纤维内脂滴增多。酸性磷酸酶染色可见其中57例在炎性细胞浸润区和肌细胞变性及坏死区可见酶活性增高(图 3A和图 3B),24例未见明显异常。Gomori染色及过碘酸雪夫染色未见明显异常。

|
| 图 2 HE染色(×100) 注:A:DMD组,肌纤维大小不等,圆形化,肌间隙增宽;B:对照组,肌纤维大小形态基本一致。 |
|
| 图 3 NADH脱氢酶染色(×100) 注:A:DMD组,部分肌纤维酶活性局限性增高或减低;B:对照组,未见明显异常。 |
|
| 图 4 酸性磷酸酶染色(×100) 注:A:DMD组,肌纤维变性、坏死,炎性细胞浸润区域酶活性增高;B:对照组,未见明显异常。 |
6例对照组光镜下HE染色肌纤维无明显变性、坏死,其形态大小正常,结缔组织无明显增生,常规酶组织化学均未见明显异常。
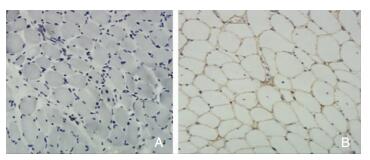
2.5 免疫组织化学染色81例DMD患者抗dystrophin-N, -C, -R染色中均有一型或两型肌纤维膜完全缺失(图 5A)。所有DMD患者抗dysferlin染色均正常。所有对照组骨骼肌抗dystrophin-N, -C, -R和抗dysferlin染色均未见明显异常(图 5B)。
|
| 图 5 抗Dys-N染色(×100) 注:A:DMD组,肌纤维膜Dys-N蛋白表达缺失;B:对照组表达正常。 |
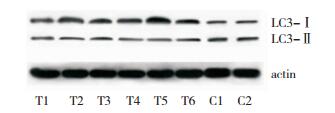
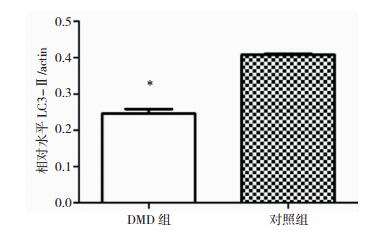
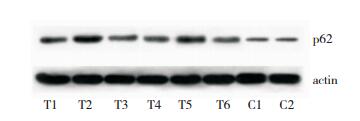
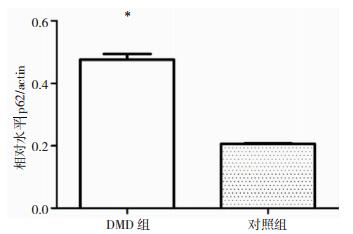
半定量Western blot表明在DMD患者骨骼肌中LC3-Ⅰ的表达量高于对照组骨骼肌,但LC3-Ⅱ在DMD患者骨骼肌中的表达显著低于对照组骨骼肌(图 6和图 7);而DMD患者骨骼肌中p62蛋白的表达明显高于对照组(图 8和图 9)。
|
| 图 6 Western blot显示DMD患者骨骼肌和对照组骨骼肌中LC3蛋白表达 注:T1~T6为DMD组;C1、C2为对照组;actin为内参蛋白。 |
|
| 图 7 DMD组和对照组骨骼肌中LC3-Ⅱ表达统计图 注:*P < 0.05。 |
|
| 图 8 Western blot显示DMD患者骨骼肌和对照组骨骼肌中p62蛋白表达 注:T1~T6为DMD组;C1、C2为对照组;actin为内参蛋白。 |
|
| 图 9 DMD组和对照组骨骼肌中p62表达统计图 注:*P < 0.05。 |
自噬是真核细胞中广泛存在的降解/再循环系统。一方面它可以帮助细胞清除不正常构型的大分子蛋白质、降解受损的细胞器及入侵微生物,维持细胞的自稳态;另一方面自噬作为一种降解途径,在生长因子不足、营养物质缺乏时,通过降解自身坏死和功能失调物质来生成核苷酸和氨基酸等,实现细胞内物质的再循环和再利用。
LC3是酵母ATG8基因在哺乳动物细胞中的同源物,与其它自噬基因共同参与前自噬泡形成。LC3除定位在自噬体分隔膜上,还存在于自噬体形成各阶段的内外膜上。目前,LC3被认为是自噬比较特异的诊断指标[3]。LC3有可溶形式的LC3-Ⅰ和脂化形式的LC3-Ⅱ之分。当自体吞噬发生时,LC3的表达上调,生成有活性的LC3-Ⅰ,并经泛素样加工修饰,与磷脂酰乙醇胺结合,生成LC3-Ⅱ并与溶酶体融合实现降解。LC3-Ⅱ的数量或者LC3-Ⅱ/LC3-Ⅰ的比值与自噬泡的数量成正比关系,在某种程度上反映了细胞的自噬活性。
p62是哺乳动物选择性自噬的底物及调节蛋白,同时也是细胞信号传导中心,它能调节不同的细胞进程。选择性自噬可降解蛋白聚集体、异常折叠蛋白、受损细胞器、病毒、细菌以及核糖体,在自噬的初始阶段,p62能招募无法被正常转运的异常折叠蛋白,使其在细胞浆形成聚集小体,并通过泛素化聚集物后形成更大的聚合体,被可以和ATG8蛋白结合的调节蛋白或受体识别[6],发挥自噬降解作用。
DMD是因抗肌萎缩蛋白基因突变导致肌无力和肌萎缩,肌变性、坏死、再生循环,最终肌细胞再生疲乏,剩余肌细胞数目减少,同时慢性炎症引起肌纤维被脂肪组织及结缔组织替代。DMD患者存在连续性和进展性的骨骼肌损伤。目前较多研究均强调了自噬在肌肉组织调控中起了至关重要的作用[7],如:维持细胞结构和成分,应激反应等,而自噬功能障碍可引起肌纤维的变性、坏死。Bonaldo等研究曾提出:自噬功能障碍是各型肌营养不良症肌细胞坏死机制[8]。而Palma等[5]通过观察4个月大的mdx小鼠和野生型(WT)小鼠胫骨前肌(TA)和隔膜肌肉中自噬标记物的表达发现:脂化形式的LC3(LC3-Ⅱ)在mdx小鼠的胫骨前肌和隔膜肌的表达与WT小鼠相比是减少的,p62在mdx小鼠的胫骨前肌和隔膜肌的表达与WT小鼠相比是增加的,提示自噬降解的异常导致了异常蛋白质和细胞器的聚集,证实了自噬在mdx小鼠中是减少的。进而科学家们通过一系列动物实验发现重新激活自噬可改善DMD表型的mdx小鼠骨骼肌细胞。
本研究DMD患者骨骼肌与对照组骨骼肌相比:LC3-Ⅱ的表达明显降低,p62的表达明显增高。此结果与mdx小鼠胫骨前肌和隔膜肌中自噬标记物的表达一致,因此,我们认为:存在于mdx小鼠骨骼肌中的自噬功能障碍同样存在于DMD患者骨骼肌中。
LC3-Ⅱ的减少是自噬受损的一个明确信号,而p62水平的增加进一步证实了自噬潮的减少,同时在超微结构下也能观察到受损细胞器的积累。而有效的重新激活自噬,能使受损骨骼肌中LC3-Ⅱ的水平较前增加和p62的水平较前降低,且超微结构下可见骨骼肌病理表现得到纠正。因此,我们认为:自噬功能障碍存在于DMD患者骨骼肌中,并参与了DMD骨骼肌细胞的坏死过程,重新激活自噬有望能扭转DMD骨骼肌细胞坏死进程,从而产生有益影响。
综上所述,本研究发现DMD患者骨骼肌细胞中LC3-Ⅱ的表达较对照组明显降低,p62的表达较对照组明显增高,提示DMD患者骨骼肌自噬异常可能是自噬潮受到抑制导致的自噬减少。因此,调整合适的自噬潮,有望延缓DMD的肌细胞死亡,成为一种新的DMD治疗策略。
| [1] |
Viggiano E, Ergoli M, Picillo E, et al. Determining the role of skewed X-chromosome inactivation in developing muscle symptoms in carriers of Duchenne muscular dystrophy[J]. Hum Genet, 2016, 135(7): 685-698. DOI:10.1007/s00439-016-1666-6 |
| [2] |
Shirakabe A, Ikeda Y, Sciarretta S, et al. Aging and Autophagy in the Heart[J]. Circ Res, 2016, 118(10): 1563-1576. DOI:10.1161/CIRCRESAHA.116.307474 |
| [3] |
Lee YK, Lee JA. Role of the mammalian ATG8/LC3 family in autophagy:differential and compensatory roles in the spatiotemporal regulation of autophagy[J]. BMB Rep, 2016, 49(8): 424-430. DOI:10.5483/BMBRep.2016.49.8.081 |
| [4] |
Moscat J, Karin M, Diaz-Meco MT. p62 in Cancer:Signaling Adaptor Beyond Autophagy[J]. Cell, 2016, 167(3): 606-609. DOI:10.1016/j.cell.2016.09.030 |
| [5] |
De Palma C, Perrotta C, Pellegrino P, et al. Skeletal muscle homeostasis in duchenne muscular dystrophy:modulating autophagy as a promising therapeutic strategy[J]. Front Aging Neurosci, 2014, 6: 188. |
| [6] |
Zhang H, Chang JT, Guo B, et al. Guidelines for monitoring autophagy in Caenorhabditis elegans[J]. Autophagy, 2015, 11(1): 9-27. |
| [7] |
Fiacco E, Castagnetti F, Bianconi V, et al. Autophagy regulates satellite cell ability to regenerate normal and dystrophic muscles[J]. Cell Death Differ, 2016, 23(11): 1839-1849. DOI:10.1038/cdd.2016.70 |
| [8] |
Bonaldo P, Sandri M. Cellular and molecular mechanisms of muscle atrophy[J]. Dis Model Mech, 2013, 6(1): 25-39. DOI:10.1242/dmm.010389 |
 2017, Vol. 44
2017, Vol. 44




