扩展功能
文章信息
- 方力群, 王亚楠, 高红梅, 陈左翼, 叶丹红
- FANG Li-Qun, WANG Ya-Nan, GAO Hong-Mei, CHEN Zuo-Yi, YE Dan-Hong
- 姜黄素对阿尔茨海默病模型小鼠脑内胶质细胞介导的炎症反应的抑制作用
- Inhibitory effect of curcumin on glial cell-mediated inflammation in a mouse model of Alzheimer's disease
- 国际神经病学神经外科学杂志, 2017, 44(4): 347-351
- Journal of International Neurology and Neurosurgery, 2017, 44(4): 347-351
-
文章历史
收稿日期: 2017-02-10
修回日期: 2017-07-26
2. 黑龙江省护理高等专科学校, 黑龙江省哈尔滨市 150036
阿尔茨海默病(Alzheimer’s disease, AD)是一种从阶段性记忆障碍逐渐演变成全面性认知功能下降的神经变性疾病[1, 2]。其主要病理特征包括:细胞外老年斑及细胞内神经纤维缠结[3]。目前随着全球老龄化的快速进展,AD已成为一种威胁老年人生命健康的疾病。有数据显示:我国AD患者数量正在急剧增加,预计到2040年我国痴呆患者人数达到2250万[4]。然而,目前如何延缓与控制AD的发展,却无理想方案。姜黄素对痴呆的潜在作用日益受到全球的关注。因此,在抗痴呆领域里姜黄素的作用机制成为新的研究热点[5, 6]。既往研究机制过多集中于姜黄素对Aβ神经毒性的影响,结果却难以令人信服。本文拟从姜黄素是如何参与抑制脑内胶质细胞所产生的系列反应,从而达到改善AD模型小鼠的整体记忆功能的角度进行探讨。
1 材料与方法 1.1 材料 1.1.1 实验动物选用4月龄正常雄性昆明小鼠(KM)80只,体重25.0~30.0 g,购自辽宁长生生物有限公司,合格证:SYXK(辽)2013-0007。将80小鼠按随机原则分4组,即对照组、Alcl3组、溶剂组及姜黄素组。
1.1.2 实验仪器、设备脑立体定位仪;微量注射器;Morris水迷宫;中性树胶;冰冻切片机;超声细胞粉碎机;低温高速离心机。
1.1.3 实验试剂姜黄素;AlCl3;10%水合氯醛。免疫组织化学SP试剂盒;PBS;内源性过氧化物酶阻断剂;山羊非免疫血清;加链霉菌抗生物素蛋白-过氧化物酶;生物素标记的羊抗兔IgG;DAB试剂。1%BSA;0.3%Triton X-100;一抗GFAP(1 :500);cy3(1 :100) 荧光二抗混合液;抗荧光淬灭剂。RIPA裂解液;蛋白酶抑制剂PMSF;磷酸酶抑制剂;BCA试剂盒;凝胶试剂盒;一抗Aβ(1 :500);GAPDH(1 :5000);辣根过氧化物酶(HRP)标记的二抗;分离胶;浓缩胶;蛋白上样缓冲液。
1.2 方法 1.2.1 AD模型建立模型制备方法[7]:2.5 g AlCl3溶解于100 ml灭菌生理盐水中,4℃冰箱贮存备用。小鼠经10%水合氯醛(500 mg/kg体重)腹腔注射麻醉后,固定在脑立体定位仪上,门齿栏设置在耳屏线下3 mm。剪毛消毒后在头皮中央切口,清除顶骨骨膜,参照小鼠脑立体定位图谱,小鼠右侧脑内注射3 μl Alcl3溶液(浓度2.5%),坐标为:前囟往后0.5 mm旁开1.0 mm,微量注射器进针深度为2.5~3.0 mm。留针10 min,缓慢拔针,动物清醒后归笼正常饲养。
1.2.2 给药方法姜黄素溶于2 ml的生理盐水中,它是弱水溶性物质,预实验表明,姜黄素在水溶液中的饱和浓度约30 μM左右,实验采用二甲基亚砜(DMSO)作为助溶剂。MTT实验表明,当细胞培养液中浓度 < 0.15%,DMSO对细胞是安全的,因此本实验最终浓度控制在0.15%以内。如稀释过程中有沉淀出现可使用超声粉碎器打碎,只要在给药时不堵塞就可以。按体重10 mg/kg损伤后10 min腹腔给药,溶剂组注射等量的生理盐水,连续给药3 d。
1.2.3 行为学检测给药后14 d,按照1984年Morris所描述的步骤进行实验[8]。水迷宫实验是在直径100 cm、高50 cm,水深30 cm的圆形池中进行。池中内壁涂成黑色,在水下放置一高约29 cm、直径9 cm的平台,使动物看不见平台。上方安置连接显示系统的摄像机。池中水温保持在24±1℃,实验前保持室内光照恒定,避免光线照射到水中。池壁上标记东北、东南、西北、西南。每天上下午训练小鼠2个时间段,每个时间段训练4次,连续测试5 d。每次训练随机选择1个入水点,面向池壁放入水中,记录小鼠找到平台的时间,即为学习潜伏期。统计第5天上午的逃避潜伏期,如果潜伏期越短说明小鼠的学习记忆能力越强。第5天下午撤平台,然后东南点将小鼠放入水中,记录90秒内穿越平台所在位置的次数,即为记忆潜伏期,穿越平台次数越多说明小鼠记忆越强。
1.2.4 样品制备在第14天时测完行为学后麻醉进行大脑取材。一部分大脑置于4%多聚甲醛中固定,30%蔗糖溶液中沉糖后在冰冻切片机行20 μm冠状面切片,20℃保存以备免疫组化和免疫荧光实验;另一部分取新鲜组织于-80℃冻存或直接进行蛋白浓度测定, 制备western blot实验样品;一部分取新鲜组织中的海马,按体重与PBS(0.01 mol/L)比1 :8,匀浆后-80℃保存,以备ELISA检测。
1.2.5 免疫组织化学染色免疫组织化学SP试剂盒进行常规组化染色,切片经20 mol/L PBS清洗后,加内源性过氧化物酶阻断剂,室温孵育10 min,PBS清洗,加山羊非免疫血清,静置10 min,滴加一抗IBA-1,20 mol/L PBS稀释,4℃过夜。次日,室温复温30 min,PBS清洗,加生物素标记的羊抗兔IgG,室温孵育10 min,PBS清洗后,加链霉菌抗生物素蛋白-过氧化物酶,室温孵育10 min,PBS清洗,加DAB试剂发光3~10 min后,水化20 min后梯度酒精脱水,二甲苯透明,中性树胶封片,光学显微镜下观察阳性细胞形态。
1.2.6 免疫组织荧光染色取冰冻切片加0.3% Triton X-100进行透膜处理10 min,20 mol/L PBS清洗,加1% BSA 37℃封闭30 min,加20 mol/L PBS稀释的一抗GFAP,4℃过夜。第二天,PBS清洗,加cy3荧光二抗混合液37℃孵育1 h,PBS清洗后,抗荧光淬灭剂封片,光显微镜观察,CCD Spotcamera进行图片采集,保存为TIF格式并经Adobe Photoshop 7.0软件(Adobe Systems)对图像进行亮度和背景处理,便于观察。
1.2.7 western blot检测新鲜小鼠脑组织取海马置于冰冷的生理盐水中剪碎,离心,再剪碎,重复5次,加RIPA裂解液,蛋白酶抑制剂PMSF及磷酸酶抑制剂后超声细胞粉碎机粉碎,4℃静置30 min,低温高速离心12000转/min 4℃离心30 min后,取上清,用BCA试剂盒进行蛋白定量,以蛋白质量为30 μg计算所需蛋白样本体积,以10 μl上样体系中需补充的PBS和蛋白上样缓冲液,将配置好的体系100℃下加热5 min,-80℃储存备用。按照凝胶试剂盒配10%浓度的分离胶,5%浓度的浓缩胶,加待测样品后进行电泳,分离胶电压80 V,浓缩胶120 V;取出凝胶,Bio-Rad western blot半干法转膜至PVDF膜,5% BSA 37℃封闭1 h加用稀释的一抗Aβ,GAPDH,4℃过夜。次日加入辣根过氧化物酶标记的二抗,37℃孵育90 min。应用Image-J 5.0专业图像分析软件进行分析,一抗与内参GAPDH的灰度比值作为目的蛋白的相对表达量。
1.2.8 ELISA检测取海马组织匀浆,低温高速离心2000转/min,4℃离心10 min后,取上清,按照ELISA试剂盒说明书进行操作,用于定量检测IL-1β,IL-6和TNF α的蛋白表达。
1.3 统计学分析检测结果用软件GraphPad Prism 5.0进行处理,数据以均数±标准差(x±s)表示,采用单因素方差分析,之后采用Bonferroni法进行两两比较,P < 0.05表示差异有统计学意义。
2 结果 2.1 姜黄素减轻Alcl3所致AD模型的空间记忆损害与对照组相比,Alcl3组的潜伏期均显著延长,穿越平台次数均明显减少(P < 0.05),说明AD小鼠需要更长时间到达平台(图 1A)。与Alcl3组相比,姜黄素组潜伏期显著缩短,而穿越平台次数增多(P < 0.01, P < 0.05)(图 1B)。
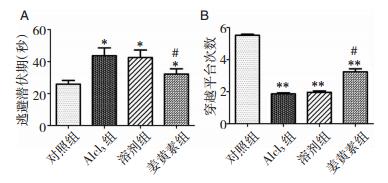
|
| 图 1 Morris水迷宫实验 注:A:逃避潜伏期;B:穿越平台次数。*为Alcl3组与对照组潜伏期和穿越平台次数比较,P < 0.05;**为姜黄素组与Alcl3组潜伏期比较,P < 0.01;#为姜黄素组与Alcl3组穿越平台次数比较,P < 0.05。 |
与对照组相比,Alcl3组小鼠海马区Aβ42的蛋白水平增高(P < 0.01);治疗3 d后姜黄素组的Aβ42蛋白水平与Alcl3组比较明显降低(P < 0.05)。见图 2。
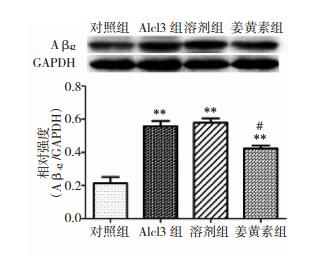
|
| 图 2 Aβ42的蛋白表达 注:**为Alcl3组与对照组比较,P < 0.01;#为姜黄素组与Alcl3组比较,P < 0.05。 |
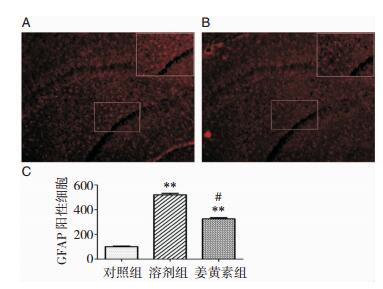
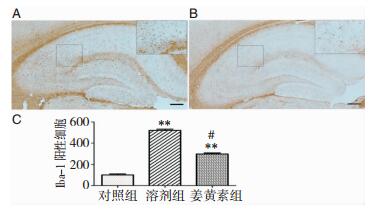
与对照组比较,Alcl3组Iba-1和GFAP的表达增强(P < 0.01),提示小胶质细胞和星形胶质细胞的过度活化(图 3和图 4)。同时,与Alcl3组相比,姜黄素组有效减少了二者的表达(P < 0.05)。用western blot分析二者蛋白水平,发现与Alcl3组相比,姜黄素组减少二者表达水平接近20%(P < 0.05)(图 5)。
|
| 图 3 小胶质细胞免疫组化染色结果 注:**为Alcl3组与对照组比较,P < 0.01;#为姜黄素组与Alcl3组比较,P < 0.05。 |
|
| 图 4 星形胶质细胞的免疫荧光染色结果 注:**为Alcl3组与对照组比较,P < 0.01;#为姜黄素组与Alcl3组比较,P < 0.05。 |
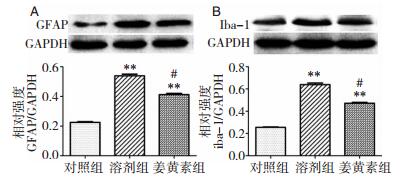
|
| 图 5 Iba-1和GFAP的蛋白表达 注:**为Alcl3组与对照组比较,P < 0.01;#为姜黄素组与Alcl3组比较,P < 0.05。 |
与对照组比较,Alcl3组海马区IL-1β、IL-6和TNF-α水平的表达明显增高(P < 0.01)。与Alcl3组相比,姜黄素组海马区IL-1β、IL-6和TNF-α水平的表达明显降低(P < 0.05)。见图 6。
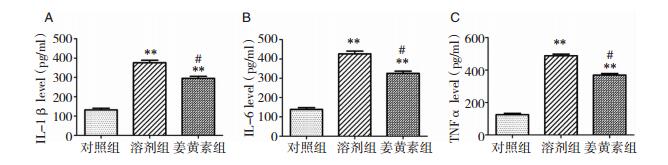
|
| 图 6 IL-1β、IL-6和TNF-α水平的表达比较 注:**为Alcl3组与对照组比较,P < 0.01;#为姜黄素组与Alcl3组比较,P < 0.05。 |
本实验采用脑立体定位仪,右侧脑内注射3 μl Alcl3建立AD模型,利用Morris水迷宫装置检测海马在空间学习与记忆中的作用,实验包括小鼠定位航行实验,空间探索实验,通过以此检测来验证造模后的小鼠是否成功模拟了AD的行为学改变。本研究还通过western blot半定量分析AD模型小鼠Aβ蛋白的表达,进一步验证Alcl3建模的成功与否。有研究发现AD患者的脑内含有高浓度铝的沉积,还有学者报道铝是一种慢性沉积的嗜神经毒物,它选择性地蓄积在大脑神经元内,产生神经毒害作用,从而引起β-淀粉样多肽在脑内沉积并且产生过度表达。铝能够与氨基酸上的谷氨酸或精氨酸一端的羧基结合成稳定复合物而存在于脑内,引起脑内蛋白磷酸化,在神经细胞内形成纤维缠结最终导致神经元的坏死。另外铝可加强铁离子引起的氧化作用及参与由白细胞介素和炎性介质介导的炎症反应。所以本实验根据微量元素-铝学说建立了AD动物模型[9],本实验提示对照组对比,Alcl3组小鼠海马区Aβ42的蛋白水平增高;治疗3 d后姜黄素组的Aβ42蛋白水平明显降低,这说明姜黄素减少海马区的Aβ42聚集。姜黄素对Al+3有络合作用,能够抑制Aβ42形成。主要通过形成姜黄素-Al+3复合物,能够作用于Aβ42,使其失去稳定性,不断降解,进而减少Aβ42产生的神经毒性作用[10]。有研究发现,姜黄素能改善侧脑室注射链脲佐菌素诱导的散发性AD模型组中大鼠被动回避和水迷宫实验的测试行为能力[11]。
本实验通过免疫组化、免疫荧光实验检测小胶质细胞和星形胶质细胞的表达,以及ELISA定量检测IL-1β,IL-6和TNF-α的蛋白表达,证实姜黄素能够减少海马区AD模型小鼠Iba-1和GFAP的表达,并且能够抑制Alcl3所致炎性因子的增多。最终姜黄素能够减弱AD模型中Alcl3所致的空间记忆损害。早年对活化小胶质细胞的认识主要是认为其在CNS中参与对损害神经元的吞噬清除,产生的空隙有由增殖的胶质瘢痕填充;但后来在短暂性脑缺血等模型发现小胶质细胞的活化甚至早于神经元的损害。因此开始有学者提出小胶质细胞的活化更可能是神经元坏死的一个原因而非结果,近年许多在各种病理情况下特别是神经退行性病变中的研究支持了这一假说[12]。通过近几年的研究基本可以肯定,小胶质细胞活化对神经元具有损伤作用。活化小胶质细胞构成了疾病发生发展的重要致病环节。就细胞水平而言,这些病变中活化小胶质细胞的主要功能并非清除死亡细胞或减弱神经毒性,而是通过分泌大量的神经毒性物质,进一步加重了神经元的损害。国内学者通过Nissl染色实验观察发现,姜黄素能够减轻AD模型小鼠神经元的损伤程度[13]。
脑的高级神经生理活动之一是学习与记忆能力,是一项复杂的神经生理活动,依赖于海马与结构完整性。Morris利用水迷宫装置检测海马在空间学习与记忆中的作用而设计。由此从本实验可以推断,姜黄素改善AD模型的记忆途径为:AD模型小鼠由于Aβ的持续存在[14],小胶质细胞被持续激活,导致释放大量炎症因子,而后发生的炎症反应反过来又会引起胶质细胞过度活化以及神经元损伤,这样恶性循环最终导致认知功能下降,加重AD的发生和发展。本实验证明姜黄素足可以抑制此过程的关键环节:即胶质细胞的活化,进一步抑制炎症因子释放,最终对AD模型小鼠损伤的脑神经元有保护作用,从而促进小鼠认知功能的恢复。所以本实验得出这样结论:姜黄素有潜在治疗AD的可能,通过下调Alcl致胶质细胞过度活化引起炎症反应,而提高学习记忆能力。
| [1] |
Citron M. Alzheimer's disease:strategies for disease modiflcation[J]. Nat Rev Drug Discov, 2010, 9(5): 387-398. DOI:10.1038/nrd2896 |
| [2] |
Querfurth HW, LaFerla FM. Alzheimer's disease[J]. N Engl J Med, 2010, 362(4): 329-344. DOI:10.1056/NEJMra0909142 |
| [3] |
Hardy J, Selkoe DJ. The amyloid hypothesis of Alzheimer's disease:progress and problems on the road to therapeutics[J]. Science, 2002, 297(5580): 353-356. DOI:10.1126/science.1072994 |
| [4] |
Williams JW, Plassman BL, Burke J, et al. Preventing Alzheimer's disease and cognitive decline[J]. Evid Rep Techol Assess, 2010, 193(193): 1. |
| [5] |
Begum AN, Jones MR, Lim GP, et al. Curcumin structure-function, bioavailability, and efficacy in models of neuroin?ammation and Alzheimer's disease[J]. J Pharmacol ExpTher, 2008, 326(1): 196-208. DOI:10.1124/jpet.108.137455 |
| [6] |
Caesar I, Jonson M, Nilsson KP, et al. Curcumin promotes A-beta?brillation and reduces neurotoxicity in transgenic Drosophila[J]. 2012, 7(2):e31424. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3278449/figure/pone-0031424-g007/
|
| [7] |
Jack CR, Knopman DS, Jagust WJ, et al. Hypothetical model of dynamic bio markers of the Alzheimer's pathological cascade[J]. Lancet Neurol, 2010, 9(1): 119-128. DOI:10.1016/S1474-4422(09)70299-6 |
| [8] |
Morris R. Developments of water-maze procedure for studying spatial learning in the rat[J]. J Neurosci Methods, 1984, 11(1): 47-60. DOI:10.1016/0165-0270(84)90007-4 |
| [9] |
蔡志友, 赵斌. 阿尔茨海默病分子生物学. 北京: 科学出版社, 2016, 3.
|
| [10] |
戴晓莉, 马玉奎. 姜黄素对三氯化铝致老年痴呆模型大鼠的作用[J]. 食品与药品, 2011, 13(7): 257-259. |
| [11] |
Rajasekar N, Dwivedi S, Tota SK, et al. Neuroprotective effect of curcumin on okadaic acid induced memory impairment in mice[J]. Eur J Pharmacol, 2013, 715(1-3): 381-394. DOI:10.1016/j.ejphar.2013.04.033 |
| [12] |
王廷华, 冯忠堂, 译. Eng-AngLing著. 神经细胞培养理论与技术[M]. 北京: 科学技术出版社, 2009, 3.
|
| [13] |
杨宇, 梁梅冰, 贾真, 等. 姜黄素在阿尔茨海默病中对炎症以及神经元的保护机制研究[J]. 武汉大学学报(医学版), 2015, 5(3): 332-336. |
| [14] |
方力群, 徐金晶, 傅松滨. 阿尔茨海默病转基因果蝇模型β淀粉样蛋白对胆碱能突触的毒性影响[J]. 国际神经病学及神经外科学, 2013, 40(4): 299-303. |
 2017, Vol. 44
2017, Vol. 44



