扩展功能
文章信息
- 胡怀强, 曹雅, 陈彬, 唐吉刚, 曹秉振
- HU Huai-Qiang, CAO Ya, CHEN Bin, TANG Ji-Gang, CAO Bing-Zhen
- 细胞凋亡在热打击致大鼠大脑皮质神经元损害中的作用及机制
- Role of cell apoptosis in neuronal injury in rat cerebral cortex induced by heat stress and related mechanisms
- 国际神经病学神经外科学杂志, 2017, 44(3): 257-260
- Journal of International Neurology and Neurosurgery, 2017, 44(3): 257-260
-
文章历史
收稿日期: 2017-03-16
修回日期: 2017-05-26
2. 中国人民解放军总医院神经内科, 北京市 100853
2. Department of Neurology, General Hospital of PLA, Beijing 100853, China
热射病是由于机体产生的热量超过了体温调节代谢散热的能力,致使核心体温急剧升高,以核心体温大于40℃、中枢神经系统功能异常以及多脏器功能损害为主要临床表现的临床急危重症[1]。随着人类对气候的影响,热浪越来越频繁、越来越严重,热射病的发病率也逐年升高[2, 3],并经常在急诊误诊[4],约20%热射病患者遗留神经功能损害[1],已成为严重威胁公共健康的急重症疾病之一。热射病对脑组织的损害是多因素的,其病理生理机制尚不明确[5]。有研究发现高热可诱导机体细胞发生大量凋亡[6],但目前热打击后脑组织细胞凋亡方面的相关研究仍比较少。本研究旨在观察热打击后大鼠皮质神经元的凋亡变化,探讨凋亡的关键蛋白caspase-3在高温致脑组织损害中的作用。
1 材料与方法 1.1 实验材料SPF级雄性Wistar大鼠48只,体重230~250 g,由山东大学实验动物中心提供。微电脑恒温恒湿控制气候舱由山东德州瑞科孵化设备有限公司提供,TUNEL细胞凋亡检测试剂盒购于上海碧云天生物技术有限公司,兔抗大鼠Caspase-3单克隆抗体购于abcam公司。
1.2 分组造模大鼠随机分为正常对照组(8只)、热打击组(40只),正常对照组大鼠始终置于温度(25±0.5)℃、相对湿度(35±5)%的环境下。按参考文献报道[7, 8],将气候舱舱内温度设置为(40±0.5)℃、相对湿度(60±5)%,待参数稳定后,将热打击组大鼠置于恒温恒湿气候舱内暴露100 min,测量大鼠直肠温度,直肠温度达40℃以上的大鼠为造模成功,热打击组大鼠造模后直肠温度均达到40℃以上,并将造模成功大鼠置于温度(25±0.5)℃、相对湿度(35±5)%的环境中喂养,用于实验。
1.3 标本取材根据King等[9]的研究,本实验于造模成功后0 d(即刻)、1 d、2 d、3 d和7 d各观察时间点随机选取4只大鼠麻醉后先用生理盐水灌注,再用10%中性福尔马林缓冲液灌注固定取脑,置于10%中性福尔马林缓冲液中继续固定,常规石蜡包埋切片,备用。上述各时间点随机选取4只用于PCR检测,快速断头于冰上取脑,置于液氮中,24 h后于-80℃冰箱保存备用待测。
1.4 TUNEL染色各组取相同层面切片,根据上海碧云天生物技术有限公司提供的试剂盒说明书进行染色,于荧光显微镜下观察。
1.5 免疫组织化学染色观察脑组织Caspase-3的表达各组取相同层面切片,常规脱蜡至水,热修复抗原,滴加封闭液,滴加一抗(anti-caspase3 antibody 1 :50),4℃孵育过夜,滴加生物素标记山羊抗兔IgG二抗,滴加辣根酶标记链霉卵白素工作液(PO-SAB)室温孵育30 min,DAB显色,封片,显微镜下观察。
1.6 Real-time PCR检测脑组织Caspase-3的表达将各组脑组织匀浆、两相分离、RNA沉淀、RNA清洗、重新溶解RNA沉淀等步骤进行RNA抽提及质量检测,然后进行cDNA合成,配制退火混合物及RT反应液,进行实时定量PCR检测,制备用于绘制标准曲线的梯度稀释DNA模板,进行Realtime PCR反应,各样品目的基因和管家基因分别进行Realtime PCR反应,根据绘制的梯度稀释DNA标准曲线,各样品目的基因和管家基因的浓度结果直接由机器生成,每个样品的目的基因浓度除以其管家基因的浓度,即为此样品此基因的校正后的相对含量。实时定量PCR使用引物见表 1。
| 基因名称 | 双向引物序列 | 退火温度(℃) | 产物长度(bp) |
| GAPDH | F: 5’GGAAAGCTGTGGCGTGAT3’ | 60 | 308 |
| R: 5’AAGGTGGAAGAATGGGAGTT3’ | |||
| caspase-3 | F: 5’GCTGGACTGCGGTATTGAGA3’ | 60 | 142 |
| R: 5’CCATGACCCGTCCCTTGA3’ |
所有资料数据用SAS 8.1版统计软件进行分析。所用计量资料均采用均数±标准差(x±s)表示,在方差齐性的基础上组间比较用单因素方差分析,P < 0.05表示差异有统计学意义。
2 结果 2.1 热打击后大鼠大脑皮质细胞凋亡情况热打击后大鼠大脑皮质TUNEL免疫荧光染色结果显示,正常对照组和热打击即刻组凋亡染色阴性,热打击1 d后可见到散在少量的荧光阳性的凋亡细胞,2 d和3 d以后可见到较多荧光阳性(红色)的凋亡细胞,第7天仍可见到染色阳性的凋亡细胞。见图 1。

|
| 图 1 热射病大鼠大脑皮质TUNEL染色(×100) 注:A为正常对照组;B、C、D、E、F分别为热打击后0 d、1 d、2 d、3 d、7 d。 |
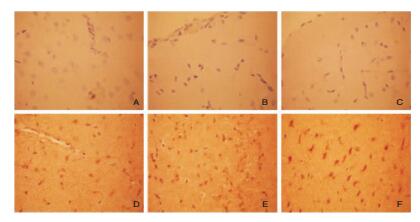
免疫组织化学法观察了热打击后大鼠大脑皮质caspase-3的表达,结果显示正常对照组、热打击后即刻及1 d后Caspase-3在大脑皮质无明显表达,热打击后2 d、3 d和第7 d可见棕黄色的凋亡细胞,在3 d时Caspase-3阳性表达细胞数量达到高峰。见图 2。
|
| 图 2 热打击后各时间点大鼠大脑皮质caspase-3的表达(×100) 注:A为正常对照组;B、C、D、E、F分别为热打击后0 d、1 d、2 d、3 d、7 d。 |
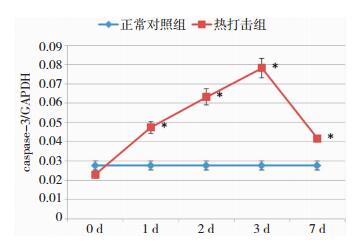
结果显示,热打击后即刻脑组织中caspase-3 mRNA的表达与正常对照组比较差异无统计学意义;热打击后1 d至7 d大鼠脑组织中caspase-3 mRNA表达量出现增高,至第3 d时表达量最高,各观察时间点与正常对照组比较差异均有统计学意义。见图 3。
|
| 图 3 热打击后各组大鼠脑组织caspase-3 mRNA的含量 注:*为与正常对照组比较,差异有统计学意义,P < 0.05。 |
脑是热射病患者最易累及的器官之一。热打击引起血脑屏障破坏、脑水肿、脑细胞变性、坏死及出血等[10],导致严重的中枢神经损伤,多表现为易怒、行为异常、幻觉、谵妄、昏睡、昏迷、抽搐、下视性眼球震颤、斜视性眼阵挛、颅神经损害、癫痫和小脑功能失调等,重症患者可出现多器官功能障碍综合征,其死亡率达10%~50%[11],存活患者中50%出现小脑综合征、多发性神经病和脑损害后遗症状[12]。中枢神经损伤可能就是热射病高死亡率、高致残率的主要原因[13]。研究认为高热引起的细胞毒性、凝血和细胞因子介导的全身炎性反应综合征及其之间存在相互作用是导致热射病多器官衰竭的主要机制[14],也有研究表明高热对细胞有直接毒性作用,导致蛋白变性,中断细胞代谢,诱导细胞凋亡和坏死[15]。本研究通过TUNEL染色动态观察了热打击后大鼠大脑皮质神经元的凋亡情况,结果显示热打击后大脑皮质神经元较正常对照组无明显变化,说明高温热打击没有立即引起神经元的凋亡。随着时间的推移,大脑皮质神经元凋亡的数量逐渐增加,至第3天时达高峰,这也可能是临床中部分热射病患者经积极治疗后意识短暂恢复后症状仍继续加重的原因。因此,热打击诱导神经元凋亡可能在热射病脑损害后继发过程中发挥了重要的作用。
半胱氨酸蛋白激酶家族(caspase)是在细胞凋亡过程中起重要作用的蛋白酶,是执行细胞凋亡的中心环节[16]。Caspase-3是caspase级联反应中下行的最关键的凋亡执行蛋白酶,在各种程序启动的凋亡程序中起着最后枢纽作用[17],与急慢性神经元的变性密切有关,是神经元凋亡的有效标记物[18]。研究表明,尽管皮质星形胶质细胞在高热中发挥神经保护作用,仍存在弥漫的神经元凋亡,且高热通过诱导细胞凋亡直接对神经元产生破坏作用[5, 19]。免疫组织化学染色和荧光定量PCR检测结果均显示,热打击后即刻大鼠皮质神经元的caspase-3的表达与正常对照组无明显差异,说明热打击超早期没有出现神经元的凋亡;随着热打击后时间的延迟,caspase-3在大鼠皮质神经元的表达逐渐增多,较同期正常对照组有显著性差异,于热打击后第3天表达量达到高峰,第7天仍有明显表达,表明热打击在早期可以诱导皮质神经元的凋亡,这可能是高温热打击致中枢神经系统变性损害的机制之一。尽管热打击后第1天时免疫组织化学染色未见明显的caspase-3的表达,但荧光定量PCR检测结果显示该时间点的caspase-3的表达与正常对照组比较差异有统计学意义,这可能是检测方法的差异所致。本研究证明了热打击后不同时间点大脑皮质神经元的凋亡细胞程度与caspase-3活性表达相一致,由此表明,热打击诱导的神经元凋亡可能是通过capase-3途径实现。研究表明,热习服预处理可显著抑制神经元凋亡,减轻脑损伤程度[13]。因此,热打击后神经元发生凋亡可能是介导热射病中枢神经系统损害发生发展的机制之一。
| [1] |
Jain RS, Kumar S, Agarwal R, et al. Acute Vertebrobasilar Territory Infarcts due to Heat Stroke[J]. J Stroke Cerebrovasc Dis, 2015, 24(6): 135-138. DOI:10.1016/j.jstrokecerebrovasdis.2015.02.001 |
| [2] |
Casa DJ, Guskiewicz KM, Anderson SA, et al. National Athletic Trainers'Association position statement:preventing sudden death in sports[J]. J Athl Train, 2012, 47(1): 96-118. DOI:10.4085/1062-6050-47.1.96 |
| [3] |
Solomon SD, Qin M, Manning Z, et al. Contribution of Working Group I to the Fourth Assessment Report of the International Panel on Climate Change. Cambridge: Cambridge University Press, 2007.
|
| [4] |
Oberlin M, Tubery M, Cances-Lauwers V, et al. Heat-related illnesses during the 2003 heat wave in an emergency service[J]. Emerg Med J, 2010, 27(4): 297-299. DOI:10.1136/emj.2008.067934 |
| [5] |
Chao CM, Cheng BC, Chen CY, et al. Proteomic analysis of hypothalamic injury in heatstroke rats[J]. Proteomics, 2015, 15(11): 1921-1934. DOI:10.1002/pmic.v15.11 |
| [6] |
Pallepati P, Averil1-Bates DA. Mild thermotolerance induced at 40℃ protects HeLa cells against activation of death receptor mediated apoptosis by hydrogen peroxide[J]. Free Radical Bio Med, 2011, 50(6): 667-679. DOI:10.1016/j.freeradbiomed.2010.11.022 |
| [7] |
Liu TT, Hu CH, Tsai CD, et al. Heat stroke induces autophagy as a protection mechanism against neurodegeneration in the brain[J]. Shock, 2010, 34(6): 643-648. DOI:10.1097/SHK.0b013e3181e761c1 |
| [8] |
Chen CM, Hou CC, Cheng KC, et al. Activated protein C therapy in a rat heat stroke model[J]. Crit Care Med, 2006, 34(7): 1960-1966. DOI:10.1097/01.CCM.0000224231.01533.B1 |
| [9] |
King MA, Leon LR, Mustico DL, et al. Biomarkers of multiorgan injury in a preclinical model of exertional heat stroke[J]. J Appl Physiol, 2015, 118(10): 1207-1220. DOI:10.1152/japplphysiol.01051.2014 |
| [10] |
沈婷, 吴立峰, 吕建森. 劳力性热射病合并MODS的集束化治疗及预后分析[J]. 中华急诊医学杂志, 2013, 22(4): 423-426. |
| [11] |
Sugimoto N, Shido O, Matsuzaki K, et al. Long-term heat exposure prevents hypoxia-induced apoptosis in mouse fibroblast cells[J]. Cell Biochem Biophys, 2014, 70(1): 301-307. DOI:10.1007/s12013-014-9912-9 |
| [12] |
Rav-Acha M, Shuvy M, Hagag S, et al. Unique persistent neurological sequelae of heat stroke[J]. Mil Med, 2007, 172(6): 603-606. DOI:10.7205/MILMED.172.6.603 |
| [13] |
易均凤, 何根林, 赵清, 等. 热习服对小鼠热射病脑损伤的保护作用[J]. 中国热带医学, 2014, 14(11): 1321-1324. |
| [14] |
Leon LR, Helwig BG. Heat stroke:role of the systemic inflammatory response[J]. Journal of Appl Physiol, 2010, 109(6): 1980-1988. DOI:10.1152/japplphysiol.00301.2010 |
| [15] |
Epstein Y, Roberts WO. The pathopysiology of heat stroke:an integrative view of the final common pathway[J]. Scand J Med Sci Sports, 2011, 21(6): 742-748. DOI:10.1111/j.1600-0838.2011.01333.x |
| [16] |
徐忠祥, 徐平, 张骏, 等. 银丹心脑通对脑缺血再灌注大鼠海马区神经细胞凋亡及Caspase-3表达的影响[J]. 中华神经医学杂志, 2013, 12(6): 588-591. |
| [17] |
Faubel S, Edelstein CL. Caspases as drug targets in ischemia organ injury[J]. Curr Drug Targets Immune Endocr Metabol Disord, 2005, 5(3): 269-287. DOI:10.2174/1568008054863754 |
| [18] |
Barbouti A, Amorgianiotis C, Kolettas E, et al. Hydrogen peroxide inhibits caspase-dependent apoptosis by inactivating procaspase-9 in an iron-dependent manner[J]. Free Radic Biol Med, 2007, 43(10): 1377-1387. DOI:10.1016/j.freeradbiomed.2007.06.020 |
| [19] |
Wang Q, Ishikawa T, Michiue T, et al. Evaluation of human brain damage in fatalities due to extreme environmental temperature by quantification of basic fibroblast growth factor (bFGF), glial fibrillary acidic protein(GFAP), S100β and single-stranded DNA (ssDNA) immunoreactivities[J]. Forensic Sci Int, 2012, 219(1-3): 259-264. DOI:10.1016/j.forsciint.2012.01.015 |
 2017, Vol. 44
2017, Vol. 44




