扩展功能
文章信息
- 李毅锋, 苏燕东, 袁贤瑞
- LI Yi-Feng, SU Yan-Dong, YUAN Xian-Rui
- 伽玛刀放疗失败后听神经瘤的显微外科治疗
- Microsurgical treatment of acoustic neuroma after failed gamma knife radiotherapy
- 国际神经病学神经外科学杂志, 2017, 44(3): 247-251
- Journal of International Neurology and Neurosurgery, 2017, 44(3): 247-251
-
文章历史
收稿日期: 2017-04-20
修回日期: 2017-06-05
听神经瘤是桥脑小脑角区最常见的肿瘤,其生物学性质为良性。手术切除是最佳治疗方案。伽玛刀放射治疗(Gamma knife radiotherapy, GKR)于1969年开始被用于听神经瘤治疗,其具有无创伤和可以控制病变生长的优点。然而,GKR人群当中仍有相当比例会出现治疗失败,主要表现为肿瘤控制不佳、继续生长,伴或不伴新发神经功能障碍或原有症状加重[1]。针对GKR失败后的补救措施,不同学者的做法不一,但一致认为是GKR一旦失败,听神经瘤的临床处理变得更加棘手。
本研究纳入袁贤瑞教授从2002年01月到2016年12月期间显微手术切除伽玛刀放疗后的听神经瘤病例,并在年龄、肿瘤大小、肿瘤扩展分级、病变质地和术前有无脑积水等方面选取仅仅接受手术治疗的同时期病例进行1:1配比,随后分析两组间的差异。
1 资料与方法研究对象纳入标准:① 所有患者均诊断为单侧听神经瘤;② 经石蜡切片病理结果证实。剔除以下病例:双侧听神经瘤或各型神经纤维瘤病,基本资料不完整,随访终止。随访时间截止至2017年3月。
相关指标包括:① 面神经功能评价,采用House-Brackmann面神经功能分级系统[2],分为Ⅰ-Ⅵ六级,Ⅰ级为正常,Ⅵ级为完全瘫痪;② 听力水平评价,按照Sanna-Fukushima听力水平分级法进行评价,见表 1;③ 面神经的粘连程度,分为三种:粘连疏松、粘连中等和粘连紧密;④ 根据术中主刀医师判断和术后MRI复查,综合确定肿瘤的切除程度,将肿瘤分为全切除和未全切除。
| 级别 | PTA, dB | SDS, % | 定义 |
| A | 0-20 | 80-100 | 听力正常 |
| B | 21-30 | 70-79 | 听力良好 |
| C | 31-40 | 60-69 | 听力一般 |
| D | 41-60 | 50-59 | 听力有效 |
| E | 61-80 | 40-49 | 听觉保留 |
| F | ≥81 | ≤39 | 耳聋 |
手术方式采用经病变侧枕下乙状窦后入路,术中全程监测面神经自发肌电图、诱发肌电图、口和眼轮匝肌为代表的表情肌F波、脑干听觉诱发电位以及三叉神经感觉支、后组颅神经电位。
所有数据使用SPSS 18.0软件进行统计学分析,考虑到病例数少,采用Fisher确切概率法检验各因素间是否有差异,以双侧检验P < 0.05为具有统计学意义。
2 结果 2.1 一般资料伽玛刀放疗失败后的听神经瘤手术共有14例纳入GKR组,该组接受手术治疗的原因见表 2。对照组同样纳入14例患者。两组性别分布均为4:10(男:女),GKR组平均年龄50.6岁,病程平均5.24年,病变最大径平均31.5mm,随访时间4~96个月。对照组平均年龄52.4岁,病程平均3.46年,病变最大径平均为33mm,随访时间3.5~96个月。两组患者的肿瘤特征见表 3,两组在以上肿瘤特征方面均未见统计学差异。
| 原因 | 例数(n=14) | 比例(100%) |
| 原症状加重+肿瘤长大 | 2 | 14.3% |
| 新发症状 | 1 | 7.1% |
| 原症状加重+新发症状+肿瘤长大 | 1 | 7.1% |
| 新发症状+肿瘤长大 | 10 | 71.5% |
| 肿瘤特征 | GKR(n=14) | 对照组(n=14) | Fisher检验P值 |
| 病变质地 | |||
| 完全实性 | 9 | 9 | 0.574 |
| 囊实性 | 4 | 5 | |
| 囊性 | 1 | 0 | |
| 内听道有肿瘤 | |||
| 是 | 14 | 13 | 1.000 |
| 否 | 0 | 1 | |
| 病变最大径 | |||
| ≤10 | 0 | 0 | 1.000 |
| 11-20 | 1 | 0 | |
| 21-30 | 7 | 7 | |
| 31-40 | 3 | 4 | |
| ≥40 | 3 | 3 | |
| 术前脑积水 | |||
| 有 | 6 | 6 | 1.000 |
| 无 | 8 | 8 | |
| 病程(年) | |||
| ≤4 | 7 | 9 | 0.775 |
| 4-7 | 3 | 2 | |
| ≥7 | 4 | 3 | |
| 术前脑干/小脑水肿 | |||
| 出现 | 9 | 6 | 0.449 |
| 未出现 | 5 | 8 |
GKR组中实现病变全切除者13例(92.9%),未全切除者1例(7.1%);对照组中14例患者均取得全切除,全切除率为100%。
2.3 面神经与肿瘤的粘连程度GKR组患者的面神经与肿瘤间的粘连程度紧密(8例,57.2%);对照组患者的粘连程度中等(11例,78.6%),显然,接受过伽玛刀放疗很显著地增加了面神经与病变的粘连程度,见表 4。
| 粘连程度 | GKR组 | 对照组 | Fisher检验P值 | |||
| 例数 | 比例(%) | 例数 | 比例(%) | |||
| 粘连疏松 | 1 | 7.1 | 2 | 14.3 | 0.016 | |
| 粘连中等 | 5 | 35.7 | 11 | 78.6 | ||
| 粘连紧密 | 8 | 57.2 | 1 | 7.1 | ||
28例患者的面神经均得到完整的解剖保留,保留蜗神经5例(GKR组:对照组=3:2),保留岩静脉27例(GKR组:对照组=13:14),差异不具有统计学意义,见表 5。
| 血管保留情况 | GKR组 | 对照组 | Fisher检验 P值 |
|||
| 例数 | 比例(%) | 例数 | 比例(%) | |||
| 保留蜗神经 | ||||||
| 有 | 3 | 21.4 | 2 | 14.3 | 1.000 | |
| 无 | 11 | 78.6 | 12 | 85.7 | ||
| 保留岩静脉 | ||||||
| 有 | 13 | 92.9 | 14 | 100 | 1.000 | |
| 无 | 1 | 7.1 | 0 | 0 | ||
GKR组术前和术后听力水平都以F级为主,对照组分别以E级和F级为主,具体见表 6。GKR组术前和术后的听力水平均比对照组差,但无统计学差异。
围手术期无死亡病例出现。GKR组术后住院天数为9~23天,平均13.1天;对照组为7~17天,平均11.1天。统计两组术后发生的重大并发症,结果见表 7。GKR组患者术前更有可能伴有脑干/小脑水肿,这可以解释该组术后后颅窝高压发生率更高,但无统计学意义。术后两组均未见后组颅神经功能障碍。
| 并发症类型 | GKR组(n=14) | 对照组(n=14) | Fisher检验P值 |
| 术后死亡 | 0 | 0 | - |
| 术后出血 | 3 | 3 | - |
| 后颅窝高压 | 5 | 3 | 0.678 |
| 新发脑积水 | 1 | 0 | 1.000 |
| 颅内感染 | 1 | 1 | - |
| 脑脊液漏 | 1 | 0 | 1.000 |
| 伤口皮下积液 | 1 | 2 | 1.000 |
| 肺部感染 | 3 | 0 | 0.222 |
| 口腔真菌感染 | 1 | 0 | 1.000 |
| 后组颅神经障碍 | 0 | 0 | - |
所有病例随访截至2017年3月,包括GKR组中一例未行全切除在内的所有患者均没有肿瘤复发的迹象。
2.8 远期面神经功能GKR组以Ⅲ级居多,对照组以Ⅰ和Ⅱ级为主,显然对照组的整体面神经功能更好,差异有统计学意义,具体见表 8。
| 面神经功能 | GKR组 | 对照组 | Fisher检验 P值 |
|||
| 例数 | 比例(%) | 例数 | 比例(%) | |||
| Ⅰ级 | 3 | 21.4 | 6 | 42.9 | 0.004 | |
| Ⅱ级 | 1 | 7.1 | 7 | 50.0 | ||
| Ⅲ级 | 6 | 42.9 | 1 | 7.1 | ||
| Ⅳ级 | 4 | 28.6 | 0 | 0 | ||
目前没有统一的关于GK治疗失败的定义,一般认为肿瘤继续生长就是治疗失败。表现为:① 主要是肿瘤出现影像学进展。文献报导[3-5]17%~74%的听神经瘤患者在接受GKR后的1年内病灶体积增大,甚至有4%的病例可持续到2年后,随后多数开始回缩,但是也有不能缩小至治疗前水平者。年生长速度为1~3.4mm/年,因此肿瘤影像学进展的观察窗时间至少需要2年。② 新发症状。以颜面部感觉减退和面瘫常见(发生率分别为25%~89%和19%~34%)。③ 原有症状明显加重,如听力、颜面部感觉彻底丧失。
3.2 手术治疗的适应征和目的目前公认的适应征为:超过2~3年随访时间内的肿瘤持续进展或药物治疗无效的难以忍受的并发症,且手术切除可能有效。本研究有50%的患者就是因为肿瘤生长以及新发症状原因而寻求手术治疗。当然,充分告知病情后患者依然坚决要求手术也是适应征之一。手术治疗的目的是移除病变实现肿瘤远期控制、保留神经功能以及解除症状甚至生命危险。关于手术目的最大的争议在于肿瘤的切除程度。多数医师[3, 6-11]认为手术治疗难度大、全切代价高,因此应以实现减压目的的计划内近/次全切或大部分切除策略为主,至于残余病变予观察处理或再次行GKR。仅有少数医师[12-14]坚持争取全切除肿瘤。针对不同学者对手术切除程度的争议,我们罗列了有代表性的几项研究以供比较,详见表 9。显然,即便不推荐全切除,面神经解剖保留率及术后功能并没有明显优势,虽然所有作者在随访截止点均未见肿瘤复发,但一旦复发将使治疗陷入更大的困境。因此尽管手术有很大难度,我们还是认为应当尽可能全切除肿瘤。
术中发现:GKR组蛛网膜增厚坚韧;瘢痕肉芽增生使得肿瘤与周围的神经、血管及脑组织粘连紧密,剥离过程易出血;神经软化、脆弱,与肿瘤之间的分离界面不清晰,可参照图 1。本研究中GKR组有1例未能行全切除的患者,既往有2次GKR史,因此我们推测随着GKR次数增加,其粘连程度更加严重,界面更难以分离,全切除肿瘤更加困难,由于不同术者秉承的手术理念不一致,肿瘤的全切率为33.3%~100%,面神经解剖保留率为75%~95%[7, 8; 10-13, 15, 16],本组在实现92.9%全切率基础上面神经解剖保留率达到100%,疗效优于其他报道。
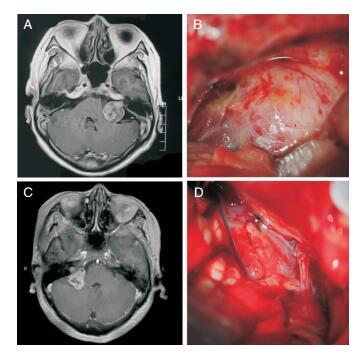
|
| 图 1 GKR组与对照组的对比。 A、B分别为GKR组的术前MRI、术中照片,显示肿瘤大小约为22mm×26mm×30mm, 蛛网膜增厚,瘢痕增生;C、D分别为对照组的术前MRI、术中图片,显示肿瘤大小约为26mm×21mm×25mm,肿瘤边缘清晰。 |
目前未见手术相关死亡的报道。除了面瘫程度,多数学者发现GKR患者的术后并发症与非GKR者之间的差异无统计学意义[10, 13, 15]。本研究具有类似的结果。Samii[13]则发现GKR患者术后出血发生率更高,虽然无统计学差异。这提示我们,针对GKR患者,更应该在术中注意妥善保护脑组织、彻底止血以及加强围手术期管理。
在以往报道中,GKR组术前面瘫更常见,本研究GKR组有2例,而对照组0例,可见前者总体的术后面神经功能更差。Link报道的面神经功能优秀(HB Ⅰ-Ⅱ级)率为73%,Brackmann为58%,Samii为78%,均低于对照组。本研究远期面神经功能优秀率和优良率仅30.8%和76.9%,远低于对照组的92.9%和100%,差异有统计学意义。结合文献与我们自己的观察,分析GKR组远期面神经功能差的原因如下:① 术前面瘫多见;② 术中粘连紧密、分离困难,对面神经的创伤增加;③ GK破坏微循环,远期面神经功能的恢复潜力弱。多数学者报道的术后听力保留结果为全聋几乎达100%,目前普遍认为术后听力保留与术前相关,与GK治疗史无关。本病例组术后仅1例保留有效听力。尽管蜗神经保留3例,但术后均无有效听力,蜗神经的保留与听力之间无必然联系,Samii也持有相同观点。对照组术后听力水平优于GKR组,但不排除术前已有的差异所致。
3.5 术后复发的再次手术疗效同时我们回顾了全切除之后复发的9例听神经瘤患者,其中6例选择接受再次手术。该6例手术治疗的复发肿瘤均获得全切除,术后面神经功能Ⅱ级者4例,Ⅰ和Ⅲ级者各1例,1例保留听力,患者均回归正常生活,优于14例GKR组患者的手术结果。这也从侧面说明我们不应该轻易推荐听神经瘤患者行伽玛刀放疗,手术仍然是首选方案。
3.6 对于最大径小于3cm的听神经瘤的处理本组前期研究[17, 18]发现,伽玛刀治疗该类小听神经瘤的有效控制率、放射性脑水肿及神经功能保留率与肿瘤分型密切相关,以A型(肿瘤位于内听道内)与B型(肿瘤主要位于小脑脑桥间池,但未压迫脑干)的患者效果较好,对于其他类型则较差。而显微手术治疗该类肿瘤则能够实现较高的肿瘤全切率和神经功能保留率,并且能够明显缓解三叉神经症状。
4 结论显微手术切除伽玛刀放疗失败后的听神经瘤具有相当大的挑战性,全切除依然可以获得较为理想的效果。对于初次治疗的听神经瘤患者,医生应慎重选择伽玛刀治疗,手术仍然是首选方案。
| [1] |
Larjani S, Monsalves E, Pebdani H, et al. Identifying Predictors of Early Growth Response and Adverse Radiation Effects of Vestibular Schwannomas to Radiosurgery[J]. PloS one, 2014, 9(10): e110823. DOI:10.1371/journal.pone.0110823 |
| [2] |
House J W. Facial nerve grading systems[J]. The Laryngoscope, 1983, 93(8): 1056-1069. |
| [3] |
Pollock B E, Lunsford D L, Norén G. Vestibular schwannoma management in the next century:a radiosurgical perspective[J]. Neurosurgery, 1998, 43(3): 475-481. DOI:10.1097/00006123-199809000-00041 |
| [4] |
Flickinger J C, Kondziolka D, Niranjan A, et al. Results of acoustic neuroma radiosurgery:an analysis of 5 years' experience using current methods[J]. Journal of neurosurgery, 2001, 94(1): 1-6. DOI:10.3171/jns.2001.94.1.0001 |
| [5] |
Yu C P, Cheung J Y C, Leung S, et al. Sequential volume mapping for confirmation of negative growth in vestibular schwannomas treated by gamma knife radiosurgery[J]. Journal of neurosurgery, 2000, 93: 82-89. DOI:10.3171/jns.2000.93.1.0082 |
| [6] |
Pollock B E. Management of vestibular schwannomas that enlarge after stereotactic radiosurgery:treatment recommendations based on a 15 year experience[J]. Neurosurgery, 2006, 58(2): 241-248. DOI:10.1227/01.NEU.0000194833.66593.8B |
| [7] |
Friedman R A, Berliner K I, Bassim M, et al. A paradigm shift in salvage surgery for radiated vestibular schwannoma[J]. Otology & Neurotology, 2011, 32(8): 1322-1328. |
| [8] |
Wise S C, Carlson M L, Tveiten V, et al. Surgical salvage of recurrent vestibular schwannoma following prior stereotactic radiosurgery[J]. The Laryngoscope, 2016, 126(11): 2580-2586. DOI:10.1002/lary.25943 |
| [9] |
Zhang Z, Nguyen Y, De Seta D, et al. Surgical treatment of sporadic vestibular schwannoma in a series of 1006 patients[J]. Acta Otorhinolaryngologica Italica, 2016, 36(5): 408. |
| [10] |
Iwai Y, Yamanaka K, Yamagata K, et al. Surgery after radiosurgery for acoustic neuromas:surgical strategy and histological findings[J]. Neurosurgery, 2007, 60(2): 75-82. |
| [11] |
Friedman R A, Brackmann D E, Hitselberger W E, et al. Surgical salvage after failed irradiation for vestibular schwannoma[J]. The Laryngoscope, 2005, 115(10): 1827-1832. DOI:10.1097/01.mlg.0000175063.76945.75 |
| [12] |
Husseini S T, Piccirillo E, Taibah A, et al. Salvage surgery of vestibular schwannoma after failed radiotherapy:the Gruppo Otologico experience and review of the literature[J]. American journal of otolaryngology, 2013, 34(2): 107-114. DOI:10.1016/j.amjoto.2012.09.012 |
| [13] |
Gerganov V M, Giordano M, Samii A, et al. Surgical treatment of patients with vestibular schwannomas after failed previous radiosurgery:Clinical article[J]. Journal of neurosurgery, 2012, 116(4): 713-720. DOI:10.3171/2011.12.JNS111682 |
| [14] |
Jiang N, Wang Z, Chen W, et al. Microsurgical Outcomes After Gross Total Resection on Vestibular Schwannoma in Elderly Patients:A Matched Cohort Study[J]. World Neurosurgery, 2017, 101: 457-465. DOI:10.1016/j.wneu.2017.01.120 |
| [15] |
Nonaka Y, Fukushima T, Watanabe K, et al. Surgical management of vestibular schwannomas after failed radiation treatment[J]. Neurosurgical review, 2016, 39(2): 303-312. DOI:10.1007/s10143-015-0690-7 |
| [16] |
Shuto T, Inomori S, Matsunaga S, et al. Microsurgery for vestibular schwannoma after gamma knife radiosurgery[J]. Acta neurochirurgica, 2008, 150(3): 229-234. DOI:10.1007/s00701-007-1486-5 |
| [17] |
蔡林志, 袁贤瑞, 刘庆, 等. 伽玛刀治疗不同类型听神经瘤的疗效分析[J]. 中华神经外科杂志, 2016, 32(1): 13-17. |
| [18] |
蔡林志, 袁贤瑞, 刘庆, 等. 中小型听神经瘤的显微手术治疗[J]. 中华神经外科杂志, 2015, 31(10): 1023-1026. DOI:10.3760/cma.j.issn.1001-2346.2015.10.015 |
 2017, Vol. 44
2017, Vol. 44




