扩展功能
文章信息
- 荔志云, 孙红军, 周杰, 林瑜亮, 党莹, 孙建军, 李长栋, 黄燕萍
- Li Zhi-yun, Sun Hong-jun, Zhou Jie, Lin Yu-liang, Dang Ying, Sun Jian-jun, Li Chang-dong, Huang Yan-ping
- 异甘草素对SHG44人脑胶质瘤干细胞增殖和分化的影响
- Effect of isoliquiritigenin on proliferation and differentiation of SHG44 human brain glioma stem cells
- 国际神经病学神经外科学杂志, 2017, 44(3): 241-246
- Journal of International Neurology and Neurosurgery, 2017, 44(3): 241-246
-
文章历史
收稿日期: 2016-11-01
修回日期: 2017-04-17
现阶段胶质母细胞瘤标准治疗方案是最大程度保护神经功能基础上最大程度手术切除联合放疗及烷化剂辅助化疗。然而胶质母细胞瘤5年存活率仍低于10%[1],总体中位生存期为16~19个月[2]。究其原因胶质瘤细胞耐受化疗是治疗失败的关键。胶质瘤干细胞(Glioma stem cells, GSC)是胶质瘤耐化疗、抗拒放疗以及复发的根源[3]。异甘草素(Isoliquiritigenin,ISL)是一种异黄酮类化合物,主要存在于甘草中,有着很强的药理活性,具有抗肿瘤、抗病毒、抗自由基、松弛血管、抑制血小板聚集、抑制脂质过氧化等生物活性[4, 5]。本课题研究ISL诱导作用于GSC后,细胞形态学改变、分子标志物的表达及Notch1信号通路中关键基因的表达情况。以证实ISL能诱导GSC向星形细胞和神经元细胞分化,并从分子生物学角度揭示其作用机制,为异甘草素在治疗人脑胶质瘤的应用提供一定的理论和实验依据。
1 材料与方法 1.1 材料人脑胶质瘤SHG44细胞系(ATCC公司);胎牛血清、DMEM培养基、DMEM/F12(1 :1) 培养(Gibco公司);B27、EGF、FGF(Invitrogen公司);异甘草素(上海源叶生物科技有限公司,纯度≥98%);小鼠抗人Nestin抗体、兔抗人Bcl-2抗体、小鼠抗人β-actin单克隆抗体、小鼠抗人单克隆抗体β-TubulinⅢ、小鼠抗人单克隆抗体GFAP、异硫氢酸荧光素标记的山羊抗兔、多克隆抗体(goat-a-ribbit-FITC)、藻红蛋白(PE)标记的兔抗小鼠(ribbit-a-mouse-PE)和辣根过氧化物酶标记的山羊抗小鼠IgG(Abcam公司);兔抗人CD133抗体(Abnova公司);反转录试剂盒(Prime ScriptTM reagent Kit)、实时定量PCR试剂盒(SYBR Premix Ex TaqTMII)(大连宝生物工程有限公司)。
1.2 方法 1.2.1 SHG44人脑胶质瘤干细胞的提取、鉴定与培养:前期实验中已经完成了分离、鉴定与培养SHG44人脑胶质瘤干细胞[7]的工作。
1.2.2 实验分组以无血清DMEM/F12培养基(含EGF、FGF、B27)(含与实验组等量的DMSO)为对照组,异甘草素(10μmol/L、40μmol/L、160 μmol/L)为诱导组,DAPT(2.0 μmol/L)为阻断剂组,异甘草素+阻断剂组(10~160 μmol/L + 2.0 μmol/L DAPT)。
1.2.3 CCK8法检测ISL作用后细胞抑制率和细胞形态观察 1.2.3.1 CCK8法检测ISL作用后细胞增殖和抑制率调整胶质瘤干细胞密度至2.5×103个/孔(100 ul)接种到Cyagen 96孔悬浮细胞培养板中并进行预培养。对照组和ISL每个浓度均设6个复孔。37℃、5%CO2、100%湿度培养24 h,每孔加入CCK-8液8 μl,继续孵育3 h后使用酶标仪读取450 nm处吸光度值。重复3次。
1.2.3.2 镜下观察ISL作用后胶质瘤干细胞形态调整胶质瘤干细胞密度至150个/孔(400 μl)接种到Cyagen 24孔悬浮细胞培养板中培养,同时加入各剂量药物。对照组和ISL每个浓度均设3个复孔。37℃、5%CO2、100%湿度培养。隔日加药。实验重复3次。观察药物作用至第7 d胶质瘤干细胞球的形成情况。
Western bliot法检测GFAP、β-Tubulin、Nestin蛋白的表达:富集ISL作用72 h的胶质瘤干细胞至15 mL离心管,1500 rpm离心8 min。弃去培养液,用PBS洗2遍,离心后用1 mL空针吸尽水分,然后加入配好的裂解液,裂解后吸至EP管中,离心(4℃、12000 r离心50 min),收集上清液。对提取蛋白进行定量及变性处理,按10% SDS-PAGE胶分离进行上样,湿法进行转膜。用5%脱脂奶粉室温封闭2 h,GFAP(1 :500)、β-Tubulin(1 :1000)、Nestin(1 :1000),β-actin(1 :1000),4 ℃过夜。常温下0.01 mol/L TBST洗膜后加HRP标记的兔抗小鼠二抗(1 :12000) 常温孵育2 h,0.01 mol/L TBST洗膜后进行曝光。用ipwin 32软件扫描条带灰度值。
1.2.4 实时定量PCRPCR扩增条件为95℃ 30 s、95℃ 5 s、60℃ 31 s,共进行40个循环,PCR引物见表 1。目标基因的相对表达量采用2-ΔΔCt法,其中-ΔΔCt=ΔCt (标准基因)-ΔCt(目标基因)。
| Gene | Upstream primers | Downstream primers | Amplification length(bp) |
| NOTCH1 | 5’-AAGCTGCATCCAGAGGCAAAC-3’ | 5’-TGGCATACACACTCCGAGAACAC-3’ | 172 |
| RBP-JK | 5’-CAGATGATCCTGTGTCACAACTCC-3’ | 5’-GAAGCGCCATCATTTATCATCTC-3’ | 154 |
| HES1 | 5’-GTGTCAACACGACACCGGATAAAC-3’ | 5’-CAGAATGTCCGCCTTCTCCAG-3’ | 185 |
| GAPDH | 5’-GCACCGTCAAGGCTGAGAAC-3’ | 5’-TGGTGAAGACGCCAGTGGA-3’ | 138 |
数据均以均值±标准差(x±s)表示,使用SPSS 20.0软件进行单因素方差分析。
2 结果 2.1 ISL对胶质瘤干细胞抑制的影响 2.1.1 ISL隔日加药至第7 d时对SHG44人脑胶质瘤干细胞球的影响隔日加药至第7 d时,胶质瘤干细胞变化(图 1),经统计分析胶质瘤干细胞球数目减少、直径减小(与对照组比),且P<0.05,当异甘草素浓度小于40 μmol/L时,与160 μmol/L相比,干细胞数目、直径均具有统计学意义(P<0.05),当异甘草素浓度大于40 μmol/L时,与160 μmol/L相比,干细胞数目、直径均无统计学意义(P>0.05)(图 2)。
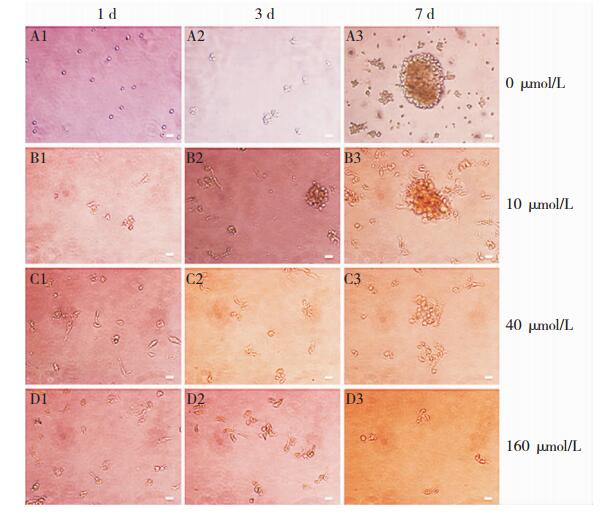
|
| 图 1 胶质瘤干细胞变化(×200) A1、A2、A3分别为对照组1 d、3 d、7 d胶质瘤干细胞变化;B1、B2、B3分别为ISL10μmol/L组1 d、3 d、7 d胶质瘤干细胞变化;C1、C2、C3分别为ISL40 μmol/L组1 d、3 d、7 d胶质瘤干细胞变化;D1、D2、D3分别为ISL160μmol/L组1 d、3 d、7 d胶质瘤干细胞变化,比例尺为50 μm。 |
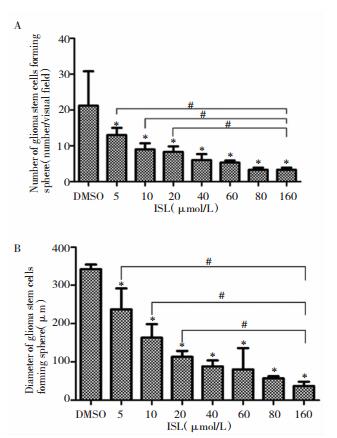
|
| 图 2 不同浓度ISL作用于胶质瘤干细胞至第7 d时直径及数目变化。注:*P<0.05,与对照组比较;#P<0.05,与160 μmol/L组比较 |
CCK8法检测:不同ISL(10~160 μmol/L)在12~48 h,随着浓度增加胶质瘤干细胞活性增强(P < 0.05)。然而,72 h后,不同浓度ISL明显抑制胶质瘤干细胞,且随着浓度增加胶质瘤干细胞活性降低(P < 0.05)(图 3)。
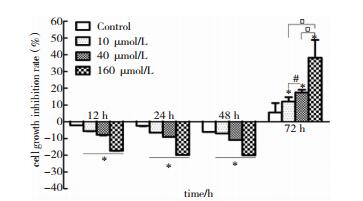
|
| 图 3 不同时间段不同浓度ISL对SHG44胶质瘤干细胞增殖抑制情况。注:*P<0.05,与对照组比较;#P<0.05,40 μmol/L组与10 μmol/L组比较;□P<0.05,与160 μmol/L组比较 |
各浓度组随机选取5个视野拍照发现(图 4),对照组胶质瘤干细胞无明显分化,且呈球形,ISL在24~48 h,随浓度增加分化细胞越多,GFAP蛋白表达组细胞呈星形,触角末端呈板状,β-TubulinⅢ蛋白表达组呈梭形且突起细长,且干细胞随之减少,在72 h后,随着浓度增加分化细胞及干细胞同时减少。
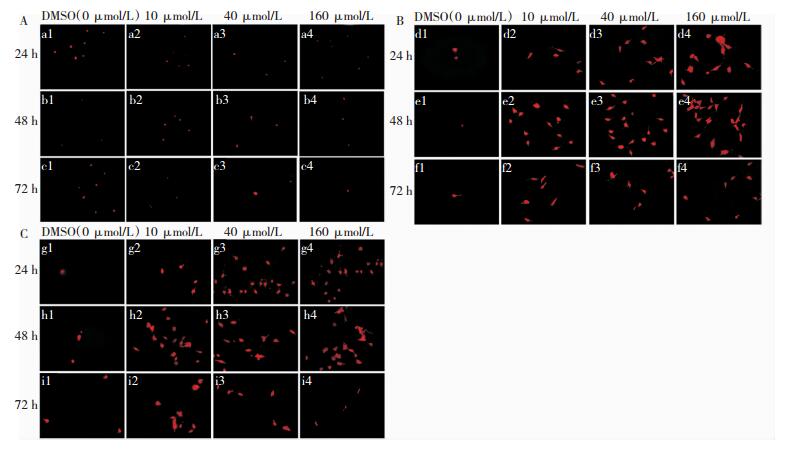
|
| 图 4 不同浓度ISL诱导SHG44胶质瘤干细胞分化情况(IF×400)。 注:A. Nestin蛋白表达情况;B.GFAP蛋白表达情况;C.β-TubulinⅢ蛋白表达情况 |
ISL作用72 h后Western blot检测结果(图 5):与对照组比较,随着ISL浓度的增加Nestin蛋白表达量逐渐下调,差异具有统计学意义(P<0.05);与对照组比较,10、40、160 μmol/L组GFAP蛋白表达水平均上调,差异具有统计学意义(P<0.05),且40 μmol/L组GFAP蛋白表达量较其他浓度组均较高,差异具有统计学意义(P<0.05);与对照组比较,10、40、160 μmol/L组β-Tubulin Ⅲ蛋白表达水平均上调,差异具有统计学意义(P<0.05),且10 μmol/L组β-Tubulin Ⅲ蛋白表达量较其他浓度组均较高,差异具有统计学意义(P<0.05)。
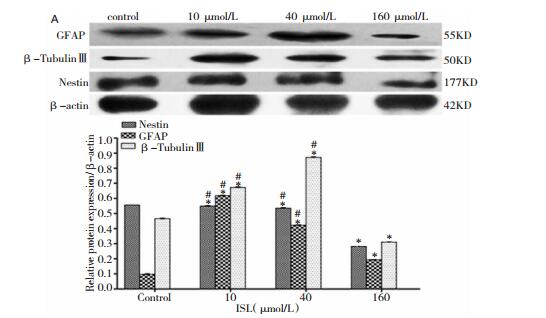
|
| 图 5 不同浓度ISL诱导72 h后胶质瘤干细胞分化相关蛋白的表达 注:与空白对照组比较,*P<0.05;与160 μmol/L异甘草素组比较,#P<0.05 |
Notch1通路阻断剂作用后,Real-time PCR检测结果(图 6):与对照组比较,各ISL组和阻断剂组Notch1、RBP-JK及Hes1的mRNA表达均显著下调,差异具有统计学意义(P<0.05);与ISL组比较,Notch1、RBP-JK及Hes1基因表达在ISL加DAPT组及阻断剂组显著下调,差异具有统计学意义(P<0.05);与阻断剂组比较,Notch1、RBP-JK及Hes1基因表达在ISL加DAPT组显著下调,差异具有统计学意义(P<0.05)。
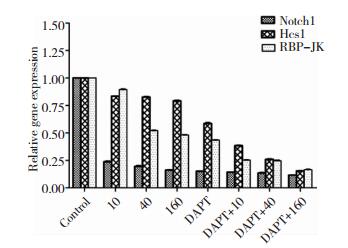
|
| 图 6 不同浓度ISL诱导下胶质瘤干细胞Notch1、Hes1及RBP-JK基因表达情况。 注:*P<0.05,与对照组比较;#P<0.05,与阻断剂(DAPT)组比较 |
目前胶质瘤细胞耐化疗是胶质瘤患者治疗失败的关键。胶质瘤干细胞是胶质瘤细胞克隆源性细胞[8],是胶质瘤抗拒放疗、耐化疗、进展及复发的根源[9],因此研发新型靶向阻断GSC耐药途径增强化疗敏感性成为了胶质瘤研究的主要目标。
本实验异甘草素浓度按等比例进行选择,最低浓度为5 μmol/L,最高浓度为160 μmol/L。首先通过细胞增殖抑制实验(CCK-8) 法检测不同浓度异甘草素对胶质瘤干细胞的抑制率,发现72h内、160 μmol/L浓度内:72 h、160 μmol/L时抑制率最强;另外隔日加药至第7天,通过统计分析胶质瘤干细胞球数目及直径,当异甘草素浓度小于40 μmol/L时,与160 μmol/L相比,干细胞数目、直径均具有统计学意义,当异甘草素浓度大于40 μmol/L时,与160 μmol/L相比,干细胞数目、直径均无统计学意义。综上所述,ISL160μmol/L浓度作用72小时后,GSC数目减少比例最多,分化成星形细胞和神经元细胞最多。前期实验研究发现ISL具有抑制SHG44胶质瘤干细胞增殖的作用,且呈时间和剂量依赖性,同时发现不同浓度ISL在12~48 h主要促进胶质瘤干细胞分化,胶质瘤干细胞形态由球形向星形及多角形转变,由于分化过程中必然伴随着分裂,致使吸光度值升高;然而72 h时ISL主要抑制胶质瘤干细胞增殖,且呈剂量依赖性。以上结果主要原因可能是ISL早期促进胶质瘤干细胞分化且使其化疗敏感性增强,后期大部分胶质瘤干细胞进入分化状态且化疗敏感性强,ISL以杀伤抑制为主。李雅娟等[6]研究发现ISL能抑制大鼠C6胶质瘤细胞的增殖,并能诱导C6细胞向星形胶质细胞分化,且呈时间、剂量依赖性。
Notch1通路属于Notch通路的主要分支通路,是肿瘤干细胞(Tumor stem cells, TSC)和正常干细胞命运的主要决策者[10]。近年来,大量的研究发现随着胶质瘤恶性程度增加,GSC含量越高[11, 12],且Notch1通路相关蛋白表达水平也随之升高[13, 14];另外,化疗敏感性与GSC的数量密切相关[10]。GSC通过活化Notch1通路调控其自我更新、抑分化和激发下游分子途径启动新生肿瘤[15]。因此,研发新型靶点阻断剂阻断Notch1通路相关节点是治疗胶质瘤潜在的临床治疗策略。
DAPT是一种γ分泌酶复合物抑制剂,并间接抑制γ-分泌酶底物Notch的活性,进而影响细胞信号传导和细胞分化。DAPT介导的Notch反应抑制效应能增强胚胎体干细胞向神经分化的功能,且此过程不受SHH信号的干扰[16]。
本研究发现,不同浓度ISL可诱导胶质瘤干细胞向星形细胞及神经元细胞分化,且在12~48 h以诱导分化为主,在72 h后以杀伤为主;通过阻断Notch1信号通路,检测ISL组发现Notch1、Hes1及RBP-JK的mRNA表达均下降,反应出ISL可能通过阻断Notch1通路促胶质瘤干细胞分化且抑制其增殖;此外异甘草素联合DAPT对Notch1通路抑制更强,具有协同效应。
综上所述,本研究证明ISL可能通过阻断Notch1通路促进胶质瘤干细胞向星形细胞及神经元细胞分化,且能抑制其增殖。因此,继续深入研究ISL对胶质瘤干细胞的作用机制,ISL可能是更具选择性、有效性以及低毒的新型抗胶质瘤干细胞药物,与目前的治疗方式相结合,可能将大大改善胶质瘤患者的预后和延长其寿命。
| [1] |
Clarke J, Penas C, Pastori C, et al. Epigenetic pathways and glioblastoma treatment[J]. Epigenetics, 2013, 8(8): 785-795. DOI:10.4161/epi.25440 |
| [2] |
Agarwal S, Manchanda P, Vogelbaum MA, et al. Function of the blood-brain barrier and restriction of drug delivery to invasive glioma cells:findings in an orthotopic rat xenograft model of glioma[J]. Drug Metab Dispos, 2013, 41(1): 33-39. DOI:10.1124/dmd.112.048322 |
| [3] |
Stockhausen MT, Kristoffersen K, Poulsen HS. The functional role of Notch signaling in human gliomas[J]. Neuro Oncol, 2010, 12(2): 199-211. DOI:10.1093/neuonc/nop022 |
| [4] |
Li D, Wang Z, Chen H, et al. Isoliquiritigenin induces monocytic differentiation of HL-60 cells[J]. Free Radic Biol Med, 2009, 46(6): 731-736. DOI:10.1016/j.freeradbiomed.2008.11.011 |
| [5] |
Ye L, Gho WM, Chan FL, et al. Dietary administration of the licorice flavonoid isoliquiritigenin deters the growth of MCF-7 cells overexpressing aromatase[J]. Int J Cancer, 2009, 124(5): 1028-1036. DOI:10.1002/ijc.v124:5 |
| [6] |
李雅娟, 甘露, 王占洋, 等. 异甘草素对大鼠C6胶质瘤细胞增殖和分化的影响[J]. 中国药理学通报, 2015, 31(9): 1298-1303. |
| [7] |
孙红军, 荔志云. 不同无血清培养方式提取SHG44人脑胶质瘤干细胞的比较研究[J]. 国际神经病学神经外科学杂志, 2016, 43(3): 193-197. |
| [8] |
Cruceru ML, Neagu M, Demoulin JB, et al. Therapy targets in glioblastoma and cancer stem cells:lessons from haematopoietic neoplasms[J]. J Cell Mol Med, 2013, 17(10): 1218-1235. DOI:10.1111/jcmm.2013.17.issue-10 |
| [9] |
Schonberg DL, Lubelski D, Miller TE, et al. Brain tumor stem cells:Molecular characteristics and their impact on therapy[J]. Mol Aspects Med, 2014, 39: 82-101. DOI:10.1016/j.mam.2013.06.004 |
| [10] |
Garner JM, Fan M, Yang CH, et al. Constitutive activation of signal transducer and activator of transcription 3(STAT3) and nuclear factor κB signaling in glioblastoma cancer stem cells regulates the Notch pathway[J]. J Biol Chem, 2013, 288(36): 26167-26176. DOI:10.1074/jbc.M113.477950 |
| [11] |
Laks DR, Masterman-Smith M, Visnyei K, et al. Neurosphere formation is an independent predictor of clinical outcome in malignant glioma[J]. Stem Cells, 2009, 27(4): 980-987. DOI:10.1002/stem.v27:4 |
| [12] |
Panosyan EH, Laks DR, Masterman-Smith M, et al. Clinical outcome in pediatric glial and embryonal brain tumors correlates with in vitro multi-passageable neurosphere formation[J]. Pediatr Blood Cancer, 2010, 55(4): 644-651. DOI:10.1002/pbc.22627 |
| [13] |
Li J, Cui Y, Gao G, et al. Notch1 is an independent prognostic factor for patients with glioma[J]. J Surg Oncol, 2011, 103(8): 813-817. DOI:10.1002/jso.21851 |
| [14] |
Dell'albani P, Rodolico M, Pellitteri R, et al. Differential patterns of NOTCH1-4 receptor expression are markers of glioma cell differentiation[J]. Neuro Oncol, 2014, 16(2): 204-216. DOI:10.1093/neuonc/not168 |
| [15] |
Wang J, Wakeman TP, Lathia JD, et al. Notch promotes radioresistance of glioma stem cells[J]. Stem Cells, 2010, 28(1): 17-28. |
| [16] |
Crawford TQ, Roelink H. The notch response inhibitor DAPT enhances neuronal differentiation inembryonic stem cell-derived embryoid bodies independently of sonic hedgehog signaling[J]. Dev Dyn, 2007, 236(3): 886-892. DOI:10.1002/dvdy.v236:3 |
 2017, Vol. 44
2017, Vol. 44


