扩展功能
文章信息
- 田志, 黄军, 王钊, 黄纯海, 张方
- TIAN Zhi, HUANG Jun, WANG Zhao, HUANG Chun-hai, ZHANG Fang
- 驽药针刺对大鼠脊髓损伤后运动功能及BDNF表达的影响
- Effect of crossbow medicine needle therapy on motor function and expression of brain-derived neurotrophic factor after spinal cord injury in rats
- 国际神经病学神经外科学杂志, 2017, 44(2): 176-179
- Journal of International Neurology and Neurosurgery, 2017, 44(2): 176-179
-
文章历史
收稿日期: 2017-01-27
修回日期: 2017-03-20
2. 吉首大学第一附属医院神经外科, 湖南 吉首 416000;
3. 吉首大学第一附属医院康复科, 湖南 吉首 416000
2. Department of Neurosurgery, The First Affiliated Hospital of Jishou University, Jishou, 416000, China;
3. Department of Rehabilitation, The First Affiliated Hospital of Jishou University, Jishou, 416000, China
脊髓损伤 (spinal cord injury,SCI) 一直是神经科学的研究热点和难点之一。SCI的治疗方法较多,临床研究发现针刺疗法能防止继发性损伤,促进脊髓损伤的恢复[1-3]。弩药针刺是众多针刺疗法中的一种,但该疗法的现代临床研究、运用却相对偏少,疗效缺乏系统的评价,其对脊髓损伤后神经保护作用机制尚无相关报道。脑源性神经营养因子 (brain derived neurotrophic factor,BDNF) 与神经元的生长、发育、分化、成熟有很大关系[4],在中枢神经损伤后再生修复和防止神经细胞退行性变等多方面发挥着至关重要的作用[5]。本研究通过随机对照研究,观察脊髓半横断损伤后弩药针刺对大鼠后肢运动功能变化的影响,以及对BDNF表达变化的影响,为探讨弩药针刺对脊髓损伤后神经保护作用的可能机制提供参考依据。
1 材料与方法 1.1 主要仪器和试剂兔抗鼠BDNF购自北京博奥森公司,TritonX-100购自上海远慕公司,其它化学试剂为国产分析纯试剂。弩药针的制备:改良为针灸针。弩药的制备:参考祝炯奎等人[6]的方法制作。
1.2 动物及实验分组健康雄性清洁级SD大鼠100只,购自中南大学湘雅医学院实验动物中心,质量 (200±20) g,适应性饲养5d后进入实验。按随机数字法将大鼠分为5组:正常对照组、假手术组、脊髓损伤组、单纯针刺组、驽药针刺组,各组严格按照实验动物福利准则饲养,且饲养条件相同。
1.3 模型制备30 g/L戊巴比妥钠腹腔注射麻醉,固定于手术台上,备皮,碘伏消毒后,定位T10后采取后正中切口,切开皮肤后分离肌肉显露T10段的棘突及椎板,咬除棘突及椎板,暴露脊髓后用尖刀横断半脊髓,然后分层缝合皮下组织及皮肤,麻醉苏醒后即刻出现一侧后肢瘫痪、拖地行走,但无排尿及排便失禁[7, 8]。术后分别单笼饲养。
1.4 干预方法正常对照组:不造模,不做任何干预。
假手术组:仅去除T10段的棘突及椎板,不横断半脊髓,术后不做任何干预。
脊髓损伤组:造模,术后不做任何干预。
单纯针刺组:造模,术后参照《大鼠穴位图谱的研制》选择SCI平面上下的华陀夹脊穴、足三里、阳陵泉及三阴交[9],用针直刺或斜刺,运针得气后留针20 min,期间捻转两次,拔针。每天1次。
驽药针刺组:造模,术后选择SCI平面上下的华陀夹脊穴、足三里、阳陵泉及三阴交穴,将弩药针浸入弩药液中,然后直刺或斜刺,运针得气后留针20 min,期间捻转两次,拔针。每天1次。
所有针刺治疗均由具备针灸资质执业医师进行。
1.5 运动功能评分采用BBB评分:将动物放入一开口盆,轻敲盆壁,使其爬行,观察动物的臀、膝、踝关节行走、躯干运动及其协调情况。评分时间为晚上7点至8点,为避免主观影响,本研究采用三人独立观察记录,单盲情况下三人独立用BBB运动功能评分法进行评分,取三人均值为准。
1.6 灌注、固定及取材5组分3天、7天、14天、21天共4个亚组,每组5只。大鼠麻醉后迅速开胸、心内插管、并将右心耳剪开,随即用生理盐水灌注至肝脏变为灰白色且从心脏流出为透明清亮液体时停止,改用40 g/L多聚甲醛磷酸缓冲液灌注,直至大鼠四肢抽搐、全身僵硬及肝脏变硬时停止灌注。取下损伤同侧T10-11段半脊髓标本,立即放入4%多聚甲醛溶液中固定,4 h后石蜡包埋行连续切片,切片厚4 μm。
1.7 免疫组织化学染色间断取片,贴于已包被的载玻片上。脱蜡至水后,放入枸椽酸盐缓冲液中,行抗原修复,当容器的温度达92℃后持续15 min,然后端离电炉,室温冷却30 min后用蒸馏水冲洗,再行PBS漂洗。将已证实的脊髓神经元的组织切片行免疫组化染色 (ABC法)。0.01M PBS漂洗3次;0.15体积分数的H2O2/0.01M PBS漂洗30 min;0.01 M PBS再次漂洗3次;0.05体积分数的羊血清/0.01M PBS行背景封闭 (37℃,15 min);Ⅰ抗 (BDNF抗血清1 :500)4℃置48 h;0.01M PBS漂洗3次;Ⅱ抗 (1 :200)37℃置1.5 h;0.01M PBS漂洗3次;AB复合物 (1 :100)37℃置1.5 h;0.01 M PBS漂洗3次;Tris-HCL缓冲液37℃孵育15分钟;DAB显色5分钟;蒸馏水漂洗。对照组除用0.01M PBS代替Ⅰ抗外其余步骤与其他组相同。自来水冲洗充分后,苏木素轻度复染,用梯度乙醇脱水和二甲苯脱水、透明,最后中性树脂胶封片。
1.8 结果判定及统计分析光镜下BDNF免疫组织化学染色的阳性产物呈现为稍高于背景的棕黄色或棕褐色颗粒。每只大鼠随机取5张切片,在光镜下对腹侧灰质中有明显细胞核的阳性细胞数进行计数。结果采用SPSS 22.0统计分析软件包处理数据,数据以x ±s表示,检验水准a=0.05。根据数据资料的特征,多组样本行组间比较采用单因素方差分析,如方差齐性时采用SNK-q进行检验,P < 0.05为差异有统计学意义。
2 结果 2.1 各组的运动功能变化实验前各组大鼠的后肢体运动功能BBB评分均为21.0分,正常组和假手术组BBB评分一直无明显变化。脊髓损伤后大鼠立即出现单侧后肢瘫痪,BBB评分均为0-1分,随后逐步升高,7d后单纯针刺组及弩药针刺组与SCI组比较有差异 (P < 0.05),驽药针刺组与单纯针刺组两组之间对比也有差异 (P < 0.05),到21 d接近正常但未能完全恢复。各组大鼠3 d,7 d,14 d及21 d BBB评分情况比较,结果见表 1。
| 组别 | n | 3 d | 7 d | 14 d | 21 d |
| 正常组 | 5 | 20.00±1.00 | 20.00±1.00 | 20.00±1.00 | 20.00±1.00 |
| 假手术组 | 5 | 20.00±1.00 | 20.00±1.00 | 20.00±1.00 | 20.00±1.00 |
| 模型组 | 5 | 0.73±0.28 | 3.00±0.23 | 9.93±0.55 | 15.27±0.60 |
| 单纯针刺组 | 5 | 1.73±0.28* | 5.93±0.28* | 12.40±0.28* | 16.33±0.34* |
| 弩药针刺组 | 5 | 2.27±0.36* | 8.40±0.28* | 14.80±0.38* | 18.34±0.47* |
| 注:与模型组比较,*P < 0.05 | |||||
常规苏木精-伊红染色后光镜下行病理学观察。对照组和假手术组脊髓形态未见异常。SCI组术后3天可见脊髓水肿、出血,部分神经元坏死;术后7天坏死加重,脊髓呈暗褐色、变细,见少量瘢痕;光镜下可见灰质神经元数量明显减少或皱缩,并有组织坏死和胶质增生;术后21天可见明显的胶质增生,损伤脊髓上下端由白色较韧的瘢痕连接,部分轴突及髓鞘退变形成空泡,神经元数目无继续减少。单纯针刺组和弩药针刺组,术后3天对比SCI组可见脊髓水肿出血、炎性细胞浸润、胶质细胞增生减轻;术后7天神经元数量较脊髓损伤组增多,神经元核固缩、变性等明显减少,灰质中囊腔较少;术后21天神经元形态尚完好丰满,无明显皱缩。
2.3 BDNF在脊髓组织中的定位及损伤后的表达变化结果显示,光镜下BDNF阳性产物主要分布于脊髓腹角的运动神经元胞浆中,正常组和假手术组脊髓灰质神经元存在BDNF,呈稍高于背景的阳性表达,胶质细胞未见明显免疫阳性着色,两组之间各时间差异均不明显 (P>0.05)。脊髓损伤后,SCI组、单纯针刺组及弩药针刺组神经元BDNF免疫阳性产物表达随着时间推移着色加深,且BDNF阳性神经元数逐渐增加,7 d时达到高峰,21 d时下降,7 d,14 d,21 d时相单纯针刺组、弩药针刺组与SCI组相比均具有明显差异 (P < 0.05),弩药针刺组与单纯针刺组相比也有差异 (P < 0.05),结果见表 2,各组BDNF表达情况见附图。
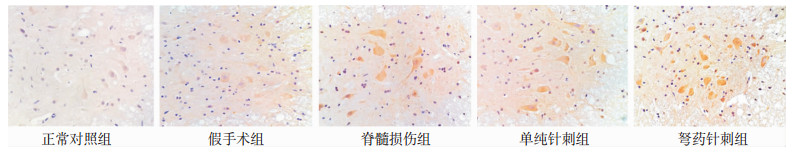
|
| 图 附图 术后7天各组脊髓BDNF免疫组化染色 (×100) |
| 组别 | n | 3 d | 7 d | 14 d | 21 d |
| 正常组 | 5 | 7.40±0.55 | 8.00±0.71 | 7.60±0.55 | 8.00±0.71 |
| 假手术组 | 5 | 7.20±0.45 | 7.60±0.55 | 8.40±0.55 | 7.80±0.45 |
| 模型组 | 5 | 8.40±0.55 | 10.80±0.84 | 8.80±0.45 | 7.60±0.89 |
| 单纯针刺组 | 5 | 9.80±0.84 | 12.80±0.84* | 11.40±0.89* | 10.80±0.84* |
| 弩药针刺组 | 5 | 10.00±0.71 | 16.20±0.84* | 14.80±0.84* | 12.60±0.89 |
| 注:与模型组比较,*P < 0.05 | |||||
因BDNF阳性神经元数在21 d时明显下降,故通过对弩药针刺组大鼠3 d,7 d,14 d BDNF阳性神经元计数及BBB评分进行相关性分析,相关系数r=0.717(P < 0.05),表明两者呈高度正相关。
3 讨论BDNF是由德国神经化学家Barde等人[10]于1982年首次从猪脑中分离纯化出来的一种具有促进神经生长活性的蛋白质,是成熟的中枢及周围神经系统的神经元维持生存及正常生理功能所必需的因子,并能防止神经元受损伤死亡、改善神经元的病理状态,具有促进受损伤神经元再生及分化等生物效应[11, 12]。体内外的研究表明,BDNF对SCI后脊髓神经元轴索及髓鞘的再生具有促进作用[13-15]。
弩药针刺疗法由针具和药物两部份配合组成,适宜疾病广,疗效显著,现代临床运用弩药针刺治疗膝骨性关节炎、神经根型颈椎病、腰椎间盘突出症等疾病,已证实确有明显疗效[6, 16-18]。然而遗憾的是以往对弩药针刺的研究多集中在该疗法的毒理药理、临床适应症及禁忌症方面,但对该疗法的分子作用机制尚无相关报道。本研究发现弩药针刺组的各时间点BBB评分均高于SCI组,特别是在造模并干预7d后效果更加显著 (P < 0.05);通过镜下观察SCI大鼠受损脊髓组织,发现切片中呈现出明显的出血、水肿以及神经元的变性坏死等现象,其损伤的主要病理变化以灰质神经元数量明显减少或皱缩为主,与国内外学者的研究结果相一致[19-21],而驽药针刺治疗后的SCI大鼠脊髓水肿出血、炎性细胞浸润、胶质细胞增生明显减轻且神经元数量较脊髓损伤组增多,神经元核固缩、变性等明显减少;镜下所见BDNF阳性灰质神经元数量与SCI组比较差异有统计学意义 (P < 0.05),提示弩药针刺能增加SCI大鼠脊髓BDNF的表达,且与BBB评分呈高度正相关 (r=0.717,P < 0.05)。表明该法具有保护运动神经元,减轻变性坏死,改善SCI后肢体运动功能的作用。
本研究首次通过系统科学的研究发现弩药针刺疗法可通过促进BDNF表达来保护存活的神经元,减少脊髓的继发性损失,对脊髓损伤发挥神经保护作用,从而改善脊髓损伤后的运动功能。该法通过本研究改良后可作为SCI瘫痪患者的康复治疗的一项重要措施,为脊髓损伤提供了新的治疗策略。同时为挖掘传统民族医学新价值提供了新的方法及思路。
| [1] | 刘悦, 郝学君. 郝学君针刺联合电针督脉穴治疗脊髓损伤后遗症[J]. 实用中医内科杂志, 2014, 28(7): 24–25. |
| [2] | 李晓宁, 迟蕾. 夹脊配合督脉电针治疗脊髓损伤后功能障碍临床观察[J]. 上海针灸杂志, 2015, 32(10): 972–975. |
| [3] | 刘妍妍, 陆贵中, 张立峰. 电针夹脊穴配合康复训练治疗脊髓损伤患者的临床研究[J]. 上海针灸杂志, 2015, 32(1): 45–47. |
| [4] | Henderson CE. Role of neurotrophic factors in neuronal development[J]. Current opinion in neurobiology, 1996, 6(1): 64–70. DOI:10.1016/S0959-4388(96)80010-9 |
| [5] | Gage FH. Mammalian neural stem cells[J]. Science, 2000, 287(5457): 1433–1438. DOI:10.1126/science.287.5457.1433 |
| [6] | 祝炯奎, 祝有学. 论毕节地区苗族弩药针刺法的形成和发展[J]. 中国民族民间医药杂志, 1996, 5(1): 5–6. |
| [7] | 黄纯海, 李学军, 黄军, 等. 大鼠脊髓全横断损伤模型的建立[J]. 国际神经病学神经外科学杂志, 2008, 35(2): 103–106. |
| [8] | 齐超, 李夏青, 张宏. 一种新的大鼠脊髓半离断损伤模型[J]. 中国医学创新, 2015, 12(7): 14–17. |
| [9] | 华兴邦, 周浩良. 大鼠穴位图谱的研制[J]. 实验动物与动物实验, 1991, 2(1): 1–5. |
| [10] | Barde YA, Edgar D, Thoenen H. Purification of a new neurotrophic factor from mammalian brain[J]. EMBO J, 1982, 1(5): 549–553. |
| [11] | Wetmore C, Olson L, Bean AJ. Regulation of brain-derived neurotrophic factor (BDNF) expression and release from hippocampal neurons is mediated by non-NMDA type glutamate receptors[J]. J Neurosci, 1994, 14(3 Pt 2): 1688–1700. |
| [12] | Yan Q, Rosenfeld RD, Matheson CR, et al. Expression of brain-derived neurotrophic factor protein in the adult rat central nervous system[J]. Neuroscience, 1997, 78(2): 431–448. DOI:10.1016/S0306-4522(96)00613-6 |
| [13] | Lu P, Jones LL, Tuszynski MH. BDNF-expressing marrow stromal cells support extensive axonal growth at sites of spinal cord injury[J]. Exper Neurol, 2005, 191(2): 344–360. DOI:10.1016/j.expneurol.2004.09.018 |
| [14] | Jakeman LB, Wei P, Guan Z, et al. Brain-derived neurotrophic factor stimulates hindlimb stepping and sprouting of cholinergic fibers after spinal cord injury[J]. Exper Neurol, 1998, 154(1): 170–184. DOI:10.1006/exnr.1998.6924 |
| [15] | 余科炜, 叶晓健, 曲伸, 等. 脑源性神经营养因子基因修饰细胞移植治疗大鼠脊髓损伤的电生理研究[J]. 中华外科杂志, 2001, 39(9): 724–727. |
| [16] | 刘向阳, 杜江. 苗医弩药针疗法治疗神经根型颈椎病的初步探索[J]. 中国民族医药杂志, 2009, 15(7): 39–40. |
| [17] | 王政, 杨豫川, 王贵春, 等. 苗医弩药针疗法治疗腰椎间盘突出症50例临床研究[J]. 中国民族医药杂志, 2013, 19(11): 17–18. |
| [18] | 熊芳丽, 冯斌, 武红艳, 等. 苗医弩药针疗法对膝骨性关节炎的临床研究及滑液含量的影响[J]. 中华中医药杂志, 2014, 2(1): 306–308. |
| [19] | Borgens RB, Liu-Snyder P. Understanding secondary injury[J]. The Quarterly Review of Biology, 2012, 87(2): 89–127. DOI:10.1086/665457 |
| [20] | David S, Lopez-Vales R, Wee Yong V. Harmful and beneficial effects of inflammation after spinal cord injury:potential therapeutic implications[J]. Handbook of Clinical Neurology, 2012, 109(5): 485–502. |
| [21] | Jiang SH, Tu WZ, Zou EM, et al. Neuroprotective effects of different modalities of acupuncture on traumatic spinal cord injury in rats[J]. Evid-Based Complement alternat Med, 2014, 2014: 431580. |
 2017, Vol. 44
2017, Vol. 44



 ,
,