扩展功能
文章信息
- 李娟, 饶维, 吴颜艳, 荔志云, 马义辉
- LI Juan, RAO Wei, WU Yanyan, LI Zhiyun, MA Yihui
- 创伤性颅脑伤后小鼠皮层和海马Wnt3a和β-Catenin的表达变化
- Changes in expression of Wnt3a and β-catenin in the cortex and the hippocampus after traumatic brain injury in mice
- 国际神经病学神经外科学杂志, 2017, 44(2): 171-175
- Journal of International Neurology and Neurosurgery, 2017, 44(2): 171-175
-
文章历史
收稿日期: 2016-11-09
修回日期: 2017-02-15
2. 兰州军区兰州总医院心脏内科, 甘肃 兰州 730050;
3. 兰州军区兰州总医院神经外科, 甘肃 兰州 730050
2. The Department of Cardiology, Lanzhou General Hospital, Lan Zhou Command, Lanzhou, 730050, China;
3. The Department of Neurosurgery, Lanzhou General Hospital, Lan Zhou Command, Lanzhou, 730050, China
创伤性脑损伤 (traumatic brain injury, TBI) 是人类,尤其是青年人致残的主要原因之一。创伤性脑损伤及其后遗症一直是危害人类健康的主要因素之一,其中伤后运动功能和学习、记忆障碍对患者的影响最为普遍和持久,目前尚缺乏有效的治疗手段。Wnt基因是从小鼠乳腺癌中克隆出的一种原癌基因。目前,大量的研究证实,Wnt基因参与调控胚胎正常发育和细胞增殖与分化等重要生理过程。最新的研究发现,在生理条件下,Wnt能够调节成年中枢神经系统内海马的神经发生。β-Catenin是一种具有介导细胞黏附及信号转导双重活性的多功能蛋白。目前,大量的研究证实,β-Catenin参与调控干细胞增殖及分化,与肿瘤的转移、预后等恶性程度密切相关。近年来,国内外的一些研究证实,Wnt/β-Catenin经典通路对脑卒中、阿尔兹海默症和脊髓损伤均发挥着一定的保护作用。因此,本研究应用TBI小鼠模型,探讨TBI后小鼠皮层和海马区Wnt3a和β-Catenin蛋白的表达变化与意义,为进一步研究Wnt3a和β-Catenin对创伤性颅脑伤后发挥的作用提供帮助。
1 材料与方法 1.1 材料 1.1.1 实验动物及分组健康雄性BALB /c小鼠,由第四军医大学实验动物中心提供,体重 (20 ~ 25g),随机分为8组:正常对照、TBI后1h、3h、6h、24h、3d、7d和14d,每组10只。
1.1.2 主要试剂及仪器BALB/c小鼠购自第四军医大学实验动物中心,兔来源β-Catenin单克隆抗体 (Cell Signaling Technology),兔来源Wnt3a单克隆抗体 (Cell Signaling Technology),小鼠来源β-Actin单克隆抗体 (Cell Signaling Technology),羊抗兔IgG抗体 (Santa Cruz),羊抗兔IgG-FITC (Invitrogen),硝酸纤维膜 (Sigma),ECL发光底物 (Pierce) 荧光显微镜 (Olympus)。PCI3000小鼠皮层精确打击装置 (Hatteras Instruments)。凝胶成像系统 (上海生物技术公司),垂直板凝胶电泳仪和DYCP-40C型电泳槽 (Bio-Rad)。
1.2 方法 1.2.1 动物模型的制备新鲜配制0.8%戊巴比妥钠 (40mg/kg) 腹腔注入麻醉小鼠。气管插管,小动物呼吸机辅助呼吸。沿头部正中线切开头皮、筋膜,分离骨膜直至显露颅骨,致伤部位以前囟后2 mm、矢状缝向右旁开2 mm处为中心,磨钻钻孔 (直径1.5 mm) 形成圆形骨窗,保持硬脑膜完整,随后采用PCI3000小鼠皮层精确打击装置制作颅脑中型损伤模型 (经打击后即刻出现呼吸暂停,随后逐渐清醒,至创伤后24 h时NSS评分为7~12分)。缝合头皮,放回鼠笼喂养。对照组给予上述创伤组同样的手术和打击前准备,但不给予打击。
1.2.2 标本与切片制备随机取对照组和TBI后24 h组小鼠各5只。小鼠麻醉后快速灌注50~100 ml生理盐水,然后灌注4%多聚甲醛约100 ml。取小鼠脑组织再放入4%多聚甲醛中后固定8 h。取标本进行常规石蜡连续切片,切片厚度5 μm,行免疫组化染色。
1.2.2 免疫印迹将冻存的脑组织 (创伤组损伤侧和对照组同侧) 置于预冷的1×PBS液中洗去血液和其他组织,称重后放入置于冰上的碾钵中,按组织重量:裂解液按照1 :10的比例,加入后进行匀浆,收集裂解液,放置30 min,12 000 g离心30 min,吸取上清,采用BCA法蛋白定量测定蛋白浓度。每管上清液再加入1/4体积5×SDS-PAGE上样缓冲液,100℃煮沸5 min使蛋白质变性。聚丙烯酰胺凝胶电泳及转膜,将硝酸纤维膜置于室温下封闭1 h,所使用的封闭液为含5%脱脂牛奶的三羟甲基氨基甲烷缓冲液封闭。使用含5%脱脂牛奶的TBS稀释一抗,4℃孵育过夜。将硝酸纤维膜用TBST漂洗3×10 min。辣根过氧化物酶标记二抗,室温下孵育2 h,再取出硝酸纤维素膜,用TBST漂洗3×10 min。显影:加ECL化学发光底物于胶片下曝光。采用美国Image Lab凝胶成像分析软件进行图像扫描和分析。
1.2.3 免疫组织化学检测切片脱蜡至水,双蒸水洗; 预热的柠檬酸盐抗原修复液 (pH=6.0) 微波修复15 min,冷却30 min后取出切片,用双蒸水洗2次×5 min;1×PBS漂洗3次×5 min;用内源性过氧化物酶阻断剂封闭内源性过氧化物酶,室温孵育15 min;1×PBS漂洗3次×5 min;滴加5%正常驴血清封闭液,室温孵育30 min;直接甩去血清,滴加一抗孵育,4℃过夜;1×PBS漂洗3次×5 min;用FITC标记的羊抗兔IgG 37℃避光孵育孵育2 h;1×PBS漂洗3次×5 min;无荧光缓冲甘油封片。在荧光显微镜下观察, 高倍镜浏览切片,每片随机取损伤区周围和海马区5个视野。
1.3 统计学处理各组数据以x±SD表示,使用SPSS 16.0软件对于各检测结果数据进行分析。采用多个样本均数间方差分析及两两比较的SNK-q检验进行统计学分析。P < 0.05表示差异有统计学意义。
2 结果 2.1 小鼠创伤性脑损伤后皮层中β-Catenin蛋白的表达变化免疫印迹法检测小鼠创伤性脑损伤后β-Catenin蛋白在损伤侧皮层的表达变化,结果发现,对照组的皮层中β-Catenin蛋白有少量表达,创伤性脑损伤后1 h,皮层β-Catenin少量增加,伤后3 h起,β-Catenin表达量明显增加,一直持续至伤后24 h达到高峰。与对照组相比,伤后24 h的蛋白含量增加了近4倍 (P < 0.05, 图 1)。与对照组相比,创伤性脑损伤后7天和14天,小鼠皮层β-Catenin的蛋白表达量仍显著增高 (P < 0.05, 图 1)。免疫荧光染色结果进一步显示,脑损伤24 h后皮层β-Catenin的免疫组织化学染色呈阳性,且可能表达于神经元上 (图 2)。
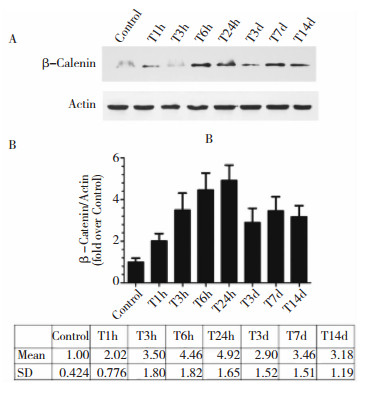
|
| 图 1 TBI后β-Catenin在小鼠皮层的表达变化 |
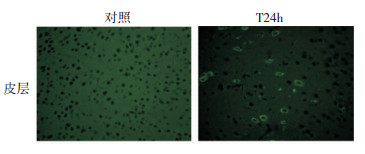
|
| 图 2 TBI后皮层β-Catenin的表达 (×400) |
免疫印迹法检测小鼠创伤性脑损伤后β-Catenin蛋白在海马的表达变化,结果发现,对照组的海马中β-Catenin蛋白有少量表达,创伤性脑损伤后1 h,海马组织中β-Catenin蛋白含量即显著增加,伤后6 h达到高峰,与对照组相比,蛋白含量增加了近5倍 (P < 0.05, 图 3)。β-Catenin蛋白的高表达一直持续至伤后24 h。与对照组相比,创伤性脑损伤后第7天,小鼠海马β-Catenin的蛋白表达量仍显著增高 (P < 0.05, 图 3)。免疫荧光染色结果也进一步证实,脑损伤24 h后海马区β-Catenin的免疫组织化学染色呈阳性 (图 4)。
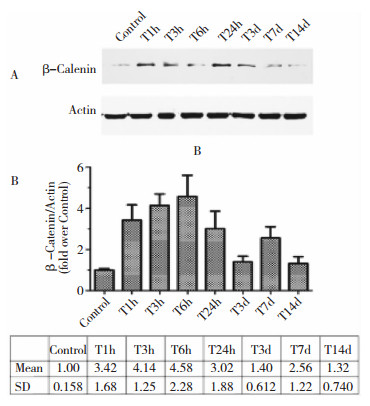
|
| 图 3 TBI后β-Catenin在小鼠海马的表达 |
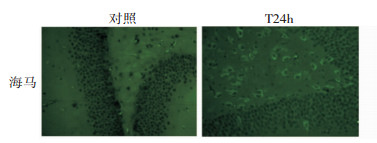
|
| 图 4 TBI后海马区β-Catenin的表达 (×400) |
免疫印迹法检测小鼠创伤性脑损伤后Wnt3a蛋白在损伤侧皮层的表达变化,结果发现,对照组的皮层中Wnt3a蛋白有少量表达,创伤性脑损伤后1 h,皮层Wnt3a蛋白含量显著增加,伤后24 h虽然有所降低,但仍处于高表达状态。与对照组相比,创伤性脑损伤后24 h,小鼠皮层Wnt3a的蛋白表达量仍显著增高,是对照组的6倍水平 (P < 0.05, 图 5)。事实上,与对照组相比,即使在伤后的第7天,Wnt3a蛋白水平仍处于显著增高水平 (P < 0.05, 图 5)。免疫荧光染色结果进一步显示,脑损伤24 h后皮层Wnt3a的免疫组织化学染色呈阳性,且可能表达于神经元上 (图 6)。
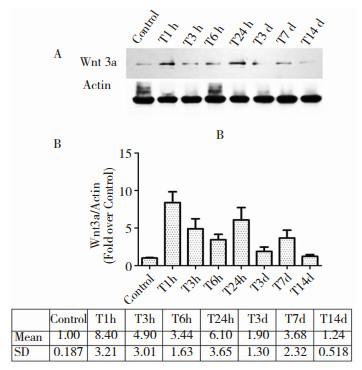
|
| 图 5 TBI后Wnt3a在小鼠皮层表达变化 |

|
| 图 6 TBI后损伤侧皮层Wnt3a的表达 (×400) |
免疫印迹法检测小鼠创伤性脑损伤后Wnt3a蛋白在海马的表达变化,结果发现,对照组的海马中Wnt3a蛋白有少量表达,创伤性脑损伤后1 h,海马组织中Wnt3a蛋白含量增加,一直持续至伤后6 h。与对照组相比,创伤性脑损伤后6 h,小鼠海马Wnt3a的蛋白表达量仍显著增高并且达到高峰,是对照组蛋白水平的6倍 (P < 0.05, 图 7)。免疫荧光染色结果也进一步证实,脑损伤24 h后海马区Wnt3a的免疫组织化学染色结果阳性 (图 8)。
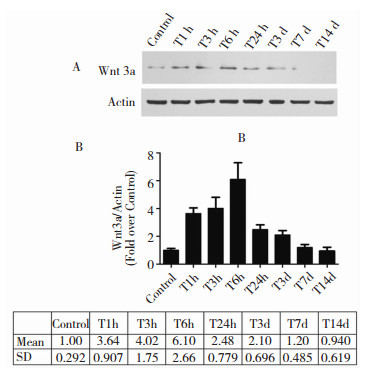
|
| 图 7 TBI后Wnt3a在小鼠海马的表达变化 |
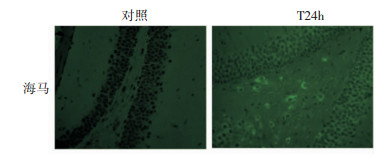
|
| 图 8 TBI后海马区Wnt3a的表达 (×400) |
Wnt基因编码的Wnt蛋白是分泌性蛋白,在脊椎动物中已发现至少20种,其中人类有16种,它们在细胞外基质中积累并激活相邻细胞中的信号通路。目前认为Wnt信号通路的组成主要包括:细胞外因子Wnt,跨膜受体卷曲蛋白 (Frizzled), 糖原合成激酶-3β(GSK-3β)、β-连环蛋白 (β-Catenin) 等[1]。β-Catenin又称β-连环蛋白。是Wnt信号经典通路的核心分子。β-Catenin的表达增加或突变与多种肿瘤的发生发展、侵袭和转移密切相关。β-Catenin可以增强肿瘤干细胞的干性及去极性,促进肿瘤的侵袭及复发[2]。大量的研究已经证实,Wnt/β-catenin经典通路是与哺乳动物胚胎时期神经系统发生关系最为密切的信号通路,其参与神经干细胞的增殖、分化、轴突形成等[3]。最近的研究发现, Wnt也参与调节成年中枢神经系统内的神经发生。Lie等人的研究发现,过表达Wnt3能够增强海马区域的神经再生[4]。Qu通过细胞周期分析发现,β-Catenin能够促进神经干细胞的增殖和自我更新[5]。李慧等人发现,缺血性脑损伤可刺激Wnt7在成年海马SGZ的表达上调,这提示Wnt7可能通过经典Wnt信号通路参与调节脑缺血后成年海马SGZ的神经发生[6]。成年哺乳动物中枢神经系统中仅有两个区域的神经干细胞可以持续产生新的神经元:侧脑室的脑室下区 (the subventricular zone, SVZ) 以及海马齿状回的颗粒下层 (the subgranular zone, SGZ)。越来越多的证据表明,这些区域新生的神经元对学习、记忆以及嗅觉功能发挥着至关重要的作用[7, 8]。国外的研究证实,创伤性颅脑伤能诱导侧脑室的脑室下区和海马齿状回区域内源性神经干细胞的增殖[9, 10]。本研究结果发现,正常小鼠脑组织中Wnt3a和β-Catenin蛋白有少量表达,创伤性脑损伤后Wnt3a和β-Catenin蛋白在损伤侧皮层和海马区的含量增加。Wnt3a和β-Catenin蛋白在小鼠脑损伤早期的蛋白变化,可能提示Wnt3a涉及的蛋白通路参与了创伤性颅脑伤的病理生理过程。Wnt/β-catenin经典通路的干预也许能够实现对创伤性颅脑伤后的保护作用和认知功能的改善。小鼠创伤性脑损伤恢复期出现Wnt3a和β-Catenin蛋白水平的增高,可能对创伤性颅脑伤后内源性神经干细胞的增殖和分化有一定的影响。Adi Shruster等人研究证实,Wnt3a增强了局灶性脑缺血后的神经再生并对神经功能障碍有一定的改善[11]。最新的研究发现,高温预处理对创伤性颅脑伤后脑损伤具有一定的保护作用,而且β-Catenin可能也参与其中[12]。
综上所述,本实验结果提示,Wnt3a和β-Catenin蛋白作为Wnt/β-Catenin经典通路的关键蛋白,可能在创伤性颅脑伤的病理生理机制中发挥着重要作用,通过对相关基因的干预也许能够实现对创伤性颅脑伤后的保护作用和认知功能的改善,并为创伤性颅脑伤的治疗发现全新的靶点。
| [1] | Zhang L, Yang X, Yang S, et al. The Wnt/beta-catenin signaling pathway in the adult neurogenesis[J]. Eur J Neurosci, 2011, 33(1): 1–8. DOI:10.1111/ejn.2010.33.issue-1 |
| [2] | Zulehner G, Mikula M. Nuclear β-catenin induces an early liver progenitor phenotype in hepatocellular carcinoma and promotes tumor recurrence[J]. Am J Pathol, 2010, 176(1): 472–481. DOI:10.2353/ajpath.2010.090300 |
| [3] | 陈亮, 李青松. Wnt信号通路在胶质瘤中的研究进展[J]. 国际神经病学神经外科学杂志, 2016, 43(2): 184–188. |
| [4] | Lie DC, Colamarino SA, Song HJ, et al. Wnt signalling regulates adult hippocampal neurogenesis[J]. Nature, 2005, 437(7063): 1370–1375. DOI:10.1038/nature04108 |
| [5] | Qu Q, Sun G, Li W, et al. Orphan nuclear receptor TLX activates Wnt/beta-catenin signalling to stimulate neural stem cell proliferation and self-renewal[J]. Nat Cell Biol, 2010, 12(1): 31–40. DOI:10.1038/ncb2001 |
| [6] | 李慧, 黄景阳, 陈海丽, 刘宝义, 袁中瑞. 脑缺血再灌注后大鼠海马Wnt7b的表达[J]. 山东大学学报 (医学版), 2013, 51(2): 7–11. |
| [7] | Valley MT, Henderson LG, Inverso SA, et al. Adult neurogenesis produces neurons with unique GABAergic synapses in the olfactory bulb[J]. J Neurosci, 2013, 33(37): 14660–14665. DOI:10.1523/JNEUROSCI.2845-13.2013 |
| [8] | Deng W, Aimone JB, Gage FH. New neurons and new memories:how does adult hippocampal neurogenesis affect learning and memory[J]. Nat Rev Neurosci, 2010, 11(5): 339–350. DOI:10.1038/nrn2822 |
| [9] | Chen XH, Iwata A, Nonaka M, et al. Neurogenesis and glial proliferation persist for at least one year in the subventricular zone following brain trauma in Rats[J]. J Neurotrauma, 2003, 20(7): 623–631. DOI:10.1089/089771503322144545 |
| [10] | Rola R, Mizumatsu S, Otsuk S, et al. Alterations in hippocampal neurogenesis following traumatic brain injury in mice[J]. Exp Neurol, 2006, 202(1): 189–199. DOI:10.1016/j.expneurol.2006.05.034 |
| [11] | Shruster A, Ben-Zur T, Melamed E. Wnt signaling enhances neurogenesis and improves neurological function after focal ischemic injury[J]. PLoS One, 2012, 7(7): e40843. DOI:10.1371/journal.pone.0040843 |
| [12] | Umschweif G, Alexandrovich AG, Trembovler V, et al. The role and dynamics of β-catenin in precondition induced neuroprotection after traumatic brain injury[J]. PLoS One, 2013, 8(10): e76129. DOI:10.1371/journal.pone.0076129 |
 2017, Vol. 44
2017, Vol. 44



