扩展功能
文章信息
- 陈照亮, 刘红, 杨会利, 高玉凯, 张娟, 吉文玉
- CHEN Zhaoliang, LIU Hong, YANG Huili, GAO Yukai, ZHANG Juan, JI Wenyu
- 微小核糖核酸592对神经胶质瘤细胞株U251细胞凋亡的影响
- Effect of microRNA-592 on the apoptosis of glioma cell line U251
- 国际神经病学神经外科学杂志, 2017, 44(2): 165-170
- Journal of International Neurology and Neurosurgery, 2017, 44(2): 165-170
-
文章历史
收稿日期: 2016-11-28
修回日期: 2017-03-07
2. 新疆医科大学第一附属医院儿外一科, 乌鲁木齐 830054
2. Deapartment of First pediatric surgery, The First Affiliated Hospital of Xinjiang Medical University, Wulumuqi 830054
神经胶质瘤是最为常见的原发性中枢神经系统肿瘤。50%~60%的脑部恶性肿瘤都是胶质瘤[1]。对神经胶质瘤现有的治疗策略主要是手术治疗、放射治疗、化学治疗或其他方式的辅助性治疗[2-4]。然而,高转移率和对放化疗的耐受性使得胶质瘤的预后效果都很差[5-7]。我们的研究发现,微小核糖核酸592(miR-592) 在胶质瘤组织中相对于癌旁组织明显表达降低。为了进一步探究miR-592在胶质瘤细胞中作用机制,我们应用miR-592 mimics上调miR-592在胶质瘤细胞 (U251细胞) 中表达水平,研究其对胶质瘤细胞生长和凋亡的影响,并进一步通过实验寻找miR-592的靶分子。
1 材料和方法 1.1 实验材料胶质瘤细胞U251细胞为新疆医科大学第一附属医院中心实验室自有,28份胶质瘤和癌旁组织为我院自2012年4月至2015年7月所收集神经胶质瘤样本,其中28例胶质瘤样本中Ⅰ级胶质瘤4例 (均为毛细胞型星形细胞瘤)、Ⅱ级4例 (少突胶质细胞瘤及弥漫性星型细胞瘤)、Ⅲ级14例 (少突角质细胞瘤,星形细胞瘤,间变性星形细胞瘤)、Ⅳ级6例 (胶质母细胞瘤),均由术中切除获得,均经病理验证,且已经过患者或家属知情同意。RPMI-1640培养基和FBS为美国Gibco公司产品,噻唑蓝、二甲基亚砜 (DMSO) 为美国Sigma公司产品,Runx2单克隆抗体购自于Abcam公司,荧光素酶检测试剂盒购自于Promega公司,酶标检测仪为德国MD公司产品,Lipofectamine 2000、Trizol为美国Invitrogen公司产品,miR-592 mimics和siRNA购自于上海吉凯基因公司,miR-592和Runx2定量检测试剂盒为德国QIAGEN公司产品。实时定量聚合酶链反应试剂盒为美国ABI产品,流式细胞仪为美国BD公司产品,PI和Annexin V凋亡染色试剂盒也为美国BD公司产品,其他相关质粒为实验室自有。
1.2 实验方法 1.2.1 细胞培养人胶质瘤细胞U251以10%的胎牛血清RPMI-1640或DMEM培养基,在37℃、5%CO2、相对湿度为90%的培养箱中培养。用0.25%的胰酶消化,每2天换液传代。
1.2.2 细胞增殖实验 (噻唑蓝)以每孔10 000个细胞接种于96孔板中,每组设3个复孔。细胞贴壁后,向细胞转染100 nmol/L的miR-592 mimics或者Runx2的siRNA,以随机序列的mimic作为实验对照,Runx2的siRNA序列如下:Runx2 siRNA:5’-GCACGCUAUUAAAUCCAAATT-3’。12 h后进行第一次检测:每孔加入5g/L的噻唑蓝液20 μl,继续培养到4 h后,去掉培养基,加入DMSO 150 μl,用酶标仪在490 nm检测吸光值。分别于转染后12、24、36 h和48 h测定吸光度 (A) 值。根据测得的A值绘制生长曲线。
1.2.3 RNA提取及实时定量聚合酶链反应 (qRT-PCR):所有样本用液氮在研钵中研磨,用TRzol提取总RNA,并通过酶标仪测RNA浓度,A260/A280为1.8~2.0。将RNA样本稀释成2 ng/μl,按照说明书配置成15 μl的逆转录体系进行逆转。取其中2 μl作为模板配置成20 μl体系进行定量PCR验证。反应条件为95℃ 10 min预变性,95 ℃ 15 s→60 ℃ 30 s进行40个循环,反应结束后得到各个标本和内参GAPDH的Ct值。计算公式:ΔCt=Ct-CtGAPDH,ΔΔCt=ΔCt (T)-ΔCt (N),相对表达计算公式为2-ΔΔCt。定量引物均购自QIAGEN公司,序列如下:Runx2上游引物:5’-GACCAGTCTTACCCCTCCTACC-3’,Runx2下游引物:5’-CTGCCTGGCTCTTCTTACTGAG-3’;GAPDH上游引物:5’-GAGAGACCCCACTTGCTGCCA-3’,GAPDH下游引物:5’-CTCACACTGCCCCTCCCTGGT-3’。
1.2.4 流式细胞技术以每孔10 000个细胞接种于96孔板中,每组设3个复孔。向细胞转染100 nmol/L的miR-592 mimics或100 nmol/L的Runx2 siRNA,以随机的mimic作为实验对照,序列如前所述。48 h后,用胰酶消化制成单细胞悬液,PBS洗涤3次。按说明书操作进行PI/Annexin V染色细胞,避光染色20 min,流式细胞仪检测各组细胞的凋亡率,实验重复3次,每次3个复孔。结果用FlowJo软件进行分析。
1.2.5 蛋白免疫印迹实验加入200 μl RIPA缓冲液冰上20 min裂解细胞。加入50 μl 5X SDS-PAGE上洋缓冲液,煮沸10 min后进行SDS-PAGE。转膜,10%BSA溶液封闭,加入稀释好的抗体工作液,4 ℃过夜孵育,TBST洗膜3次。再加入HRP标记的抗人IgG二抗,TBST洗膜3次后,加上化学发光底物,于暗室内压片、曝光、显影和定影。
1.2.6 荧光素酶双报告实验以每孔2.0×105个293T细胞接种于24孔板。培养24 h后,用lipofectamine2000将报告质粒和miR-592过表达质粒共转染于293T细胞,并同步共转入pRL-TK作为对照质粒,用量分别为:报告质粒0.4 μg;miR-592过表达质粒0.4 μg;pRL-TK质粒0.05 μg。转染后6 h换完全培养基。48 h后去上清,用PBS洗去未去干净的上清,随后用lysis buffer冰上裂解细胞,收集上清用于荧光素酶活性检测 (试剂盒购自于Promega)。计算方法为:荧光素酶活性=萤火虫荧光素酶读值/海肾荧光读值。
1.2.7 裸鼠肿瘤模型建立购买8周龄的BALB/c (nu/nu) 裸鼠 (上海斯莱克),随机分成3组,每组5只。分别于左、右侧肋部皮下接种miR-592稳定表达的U251细胞、Runx2 siRNA稳定表达的U251细胞 (细胞系均由上海吉凯基因公司制备),以正常U251细胞作为实验对照,细胞接种量均为6.0×106/只,左右侧各3.0×106个。于接种后每隔5 d游标卡尺测定肿瘤大小,以1/3×长径×短径2计算肿瘤体积,并于接种后第50天处死小鼠,绘制肿瘤生长曲线。
1.3 统计学方法各组数据均采用SPSS统计软件进行统计学处理。正态分布的计量资料采用均值±标准差,两组间数据比较采用t检验,P < 0.05表示差异具有统计学意义。
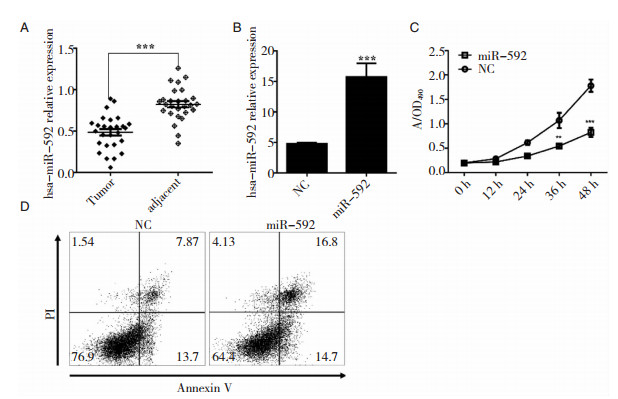
2 结果 2.1 miR-592促进U251细胞凋亡首先,我们通过定量PCR的方法分析了miR-592在神经胶质瘤组织和癌旁组织中的表达变化。结果表明miR-592在神经胶质瘤组织中的相对表达明显下降 (图 1A)。
|
| 图 1 miR-592促进U251细胞凋亡。 A:miR-592在肿瘤和癌旁组织中的表达;B:转染mimics后miR-592的表达水平;C:MTT检测U251细胞生长;D:流式细胞仪检测miR-592过表达后U251细胞周期 |
为了进一步研究miR-592是否在胶质瘤的发生发展中发挥着功能性的作用,我们合成了miR-592的mimics,并合成随机序列的对照。脂质体转染U251细胞后,我们首先检测了miR-592的表达 (图 1B),并通过MTT实验绘制生长曲线 (图 1C)。结果显示,过表达miR-592能明显抑制U251细胞生长。流式细胞实验对U251细胞的凋亡检测结果显示miR-592能显著性上调细胞凋亡率 (图 1D,表 1)。
| Group | Early apoptotic rate (%) | Late apoptotic rate (%) | |||||||
| Repeat 1 | Repeat 2 | Repeat 3 | x±s | Repeat 1 | Repeat 2 | Repeat 3 | x±s | ||
| NC | 13.7 | 12.92 | 14.52 | 13.71±0.8 | 7.87 | 6.51 | 7.21 | 7.2±0.68 | |
| MiR-592 | 12.8 | 11.35 | 14.66 | 12.94±1.66 | 16 | 18.9 | 17.5 | 17.47±1.45** | |
| **P < 0.01, vs NC group | |||||||||
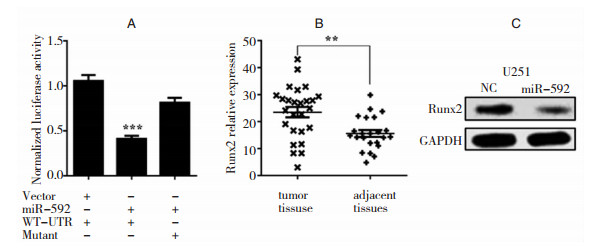
Runx2是miR-592在U251细胞中的直接靶分子:为了进一步探究miR-592在神经胶质瘤细胞中的作用机制。通过查阅文献我们发现Runx2在神经胶质瘤细胞中发挥着重要作用,我们通过生物信息学分析发现miR-592能直接靶向Runx2的3’-UTR。荧光素酶双报告实验也显示miR-592显著性的抑制带有Runx2的3’-UTR的荧光素酶的活性 (图 2A)。为了进一步验证Runx2是否是miR-592的直接靶分子,我们通过定量PCR的方法分析了Runx2在神经胶质瘤组织和癌旁组织中的表达,结果显示Runx2的相对表达在肿瘤组织中明显上调 (图 2B)。随后我们还通过western blot的方法分析了转染miR-592后U251细胞Runx2蛋白的表达,结果显示miR-592抑制Runx2的蛋白水平 (图 2C)。以上结果表明,Runx2是miR-592在U251细胞中的直接靶分子。
|
| 图 2 Runx2是miR-592在U251细胞中的直接靶蛋白 A:荧光素酶双报告实验;B:定量检测Runx2在肿瘤组织和癌旁组织中的表达;C:Runx2在转染miR-592和NC后U251细胞中的表达 |
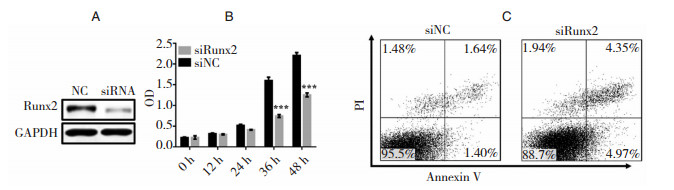
为了研究Runx2是否是miR-592在U251细胞中的功能性靶分子,我们设计了Runx2下调的siRNA。转染U251细胞后,western blot实验验证Runx2的表达 (图 3.A)。同时,我们也检测了下调Runx2对U251细胞生长的影响,结果显示转染了Runx2 siRNA的细胞生长明显比对照组低 (图 3.B)。流式细胞技术对周期的检测显示,Runx2下调表达上调U251细胞的凋亡率 (图 3.C和Table 2)。综上所述,下调Runx2表达能重现miR-592过表达的表型,说明Runx2是miR-592的功能性靶分子。
|
| 图 3 下调Runx2促进U251细胞凋亡 A:western blot验证siRNA下调效率;B:MTT实验检测Runx2下调后细胞生长情况;C:流式细胞仪分析Runx2下调后细胞凋亡率 |
| Group | Late apoptotic rate (%)(n=3, x±s) |
| NC | 1.58±0.25 |
| siRunx2 | 4.57±0.36* |
| *P < 0.05, vs NC group | |
总结以上结果我们得出如下结论:miR-592通过直接靶向Runx2来促进U251细胞凋亡率来抑制细胞生长。
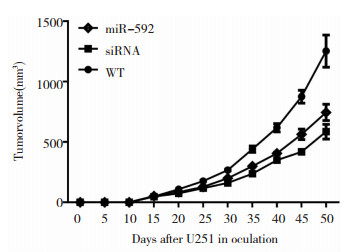
2.4 miR-592通过靶向Runx2调控U251的肿瘤的生长为了进一步验证Runx2是否为miR-592的功能性的靶分子,进一步通过体内的成瘤实验验证以上疑问。通过在裸鼠皮下接种miR-592稳定表达的U251细胞;Runx2 siRNA稳定表达的U251细胞和对照组U251细胞。于接种后每隔5天测定一次肿瘤大小。并于接种后50天处死小鼠。通过绘制肿瘤的生长曲线,发现miR-592过表达明显抑制肿瘤的生长 (图 4)。同时,我们发现,Runx2的下调表达也明显抑制肿瘤的生长 (图 4)。该实验结果表明,miR-592通过下调Runx2抑制胶质瘤肿瘤生长。
|
| 图 4 miR-592靶向Runx2抑制U251肿瘤的生长 |
总结以上所有结果,可得出如下结论:miR-592通过靶向Runx2来调控U251细胞的凋亡和肿瘤的生长。
3 讨论microRNA是一类长度约为22个碱基的非编码RNA。虽然microRNA在哺乳动物细胞中的总体数量很少,但是它们却调节了大约30%的基因。microRNA通过靶向目的分子的3’-UTR来调节mRNA的水平从而进一步调节蛋白的水平[8, 9]。诸多文献报道指出microRNA在肿瘤的发生发展过程中起着各种各样非常重要的作用[10-13]。我们发现,miR-592在神经胶质瘤组织中的表达显著下调。合成miR-592的mimics并转染U251细胞来过表达miR-592,MTT实验结果显示过表达miR-592显著性的抑制细胞生长。流式细胞检测表明,过表达miR-592上调U251细胞的凋亡率。这些结果表明,miR-592在神经胶质瘤细胞中发挥着肿瘤抑制基因的功能。
Runx2是Runt相关转录因子家族的重要成员[14]。它可以形成核心结合因子 (CBF) 复合物结合到DNA序列上,从而达到对基因表达的调控作用[15]。越来越多的研究表明Runx2在包括胶质瘤在内的多种肿瘤中都有表达。Runx2的高表达能促进肿瘤的生长、转移和浸润[16-17]。而下调Runx2的表达又可以抑制肿瘤的生长和发生发展[18]。这些结果表明Runx2发挥着肿瘤抑制因子的功能。应用荧光素酶双报告实验,发现miR-592能直接和Runx2的UTR结合。而在肿瘤组织中Runx2的表达也明显上调,western blot实验结果也显示过表达miR-592的U251细胞的Runx2的表达明显下调。以上结果表明,Runx2是miR-592在U251细胞中的直接靶分子。
为了进一步研究Runx2是否是miR-592在U251细胞中的功能性靶分子,我们通过siRNA特异性的沉默Runx2的表达。MTT实验结果表明,下调Runx2显著性的抑制U251细胞的生长,其凋亡水平也明显上调。这个结果表明,Runx2是miR-592在U251细胞中的功能性靶蛋白。
综上所述,我们得出以下结论:miR-592通过直接靶向Runx2促进凋亡来抑制U251细胞生长。
| [1] | Shipman L. Glioma:Tumour cell teamwork[J]. Nat Rev Cancer, 2016, 16(1): 2. |
| [2] | Furnari FB, Fenton T, Bachoo RM, et al. Malignant astrocytic glioma:genetics, biology, and paths to treatment[J]. Genes Dev, 2007, 21(21): 2683–2710. DOI:10.1101/gad.1596707 |
| [3] | 郝俊海, 常杨军. 神经胶质瘤相关长链非编码RNA的研究进展[J]. 中华神经外科杂志, 2016, 32(1): 94–96. |
| [4] | 王伟民. 重视神经胶质瘤手术治疗的方法研究[J]. 中华神经外科杂志, 2008, 24(4): 312–313. |
| [5] | Castro MG, Lowenstein PR. Neuro-oncology:The long and winding road——gene therapy for glioma[J]. Nat Rev Neurol, 2013, 9(11): 609–610. DOI:10.1038/nrneurol.2013.198 |
| [6] | Hashizume R, Andor N, Ihara Y, et al. Pharmacologic inhibition of histone demethylation as a therapy for pediatric brainstem glioma[J]. Nat Med, 2014, 20(12): 1394–1396. DOI:10.1038/nm.3716 |
| [7] | Reardon DA, Wen PY. Glioma in 2014:unravelling tumour heterogeneity-implications for therapy[J]. Nat Rev Clin Oncol, 2015, 12(2): 69–70. DOI:10.1038/nrclinonc.2014.223 |
| [8] | Iorio MV, Croce CM. MicroRNA dysregulation in cancer:diagnostics, monitoring and therapeutics. A comprehensive review[J]. EMBO Mol Med, 2012, 4(3): 143–159. DOI:10.1002/emmm.201100209 |
| [9] | Wang C, Ji B, Cheng B, et al. Neuroprotection of microRNA in neurological disorders (Review)[J]. Biomed Rep, 2014, 2(5): 611–619. |
| [10] | Dadiani M, Bossel Ben-Moshe N, Paluch-Shimon S, et al. Tumor Evolution Inferred by Patterns of microRNA Expression through the Course of Disease, Therapy, and Recurrence in Breast Cancer[J]. Clin cancer Res, 2016, 22(14): 3651–3662. DOI:10.1158/1078-0432.CCR-15-2313 |
| [11] | Gong X, Zhou W, Chai Y, et al. MicroRNA-induced cascaded and catalytic self-assembly of DNA nanostructures for enzyme-free and sensitive fluorescence detection of microRNA from tumor cells[J]. Chem Commun (Camb), 2016, 11;52(12): 2501–2504. |
| [12] | Kuninty PR, Schnittert J, Storm G, et al. MicroRNA Targeting to Modulate Tumor Microenvironment[J]. Front Oncol, 2016, 6: 3. |
| [13] | Zhang L, Yang CS, Varelas X, et al. Altered RNA editing in 3'UTR perturbs microRNA-mediated regulation of oncogenes and tumor-suppressors[J]. Sci Rep, 2016, 6: 23226. DOI:10.1038/srep23226 |
| [14] | Vladimirova V, Waha A, Lückerath K, et al. Runx2 is expressed in human glioma cells and mediates the expression of galectin-3[J]. J Neurosci Res, 2008, 86(11): 2450–2461. DOI:10.1002/jnr.v86:11 |
| [15] | Niu DF, Kondo T, Nakazawa T, et al. Transcription factor Runx2 is a regulator of epithelial-mesenchymal transition and invasion in thyroid carcinomas[J]. Lab invest, 2012, 92(8): 1181–1190. DOI:10.1038/labinvest.2012.84 |
| [16] | Takahashi T. Overexpression of Runx2 and MKP-1 stimulates transdifferentiation of 3T3-L1 preadipocytes into bone-forming osteoblasts in vitro[J]. Calcif Tissue Int, 2011, 88(4): 336–347. DOI:10.1007/s00223-011-9461-9 |
| [17] | 付胜伟, 岳树源. 微小分子RNA在胶质瘤中的研究进展[J]. 国际神经病学神经外科学杂志, 2012, 39(4): 373–376. |
| [18] | Wang W, Chen B, Zou R, et al. Codonolactone, a sesquiterpene lactone isolated from Chloranthus henryi Hemsl, inhibits breast cancer cell invasion, migration and metastasis by downregulating the transcriptional activity of Runx2[J]. Int J Oncol, 2014, 45(5): 1891–1900. |
 2017, Vol. 44
2017, Vol. 44


