扩展功能
文章信息
- 陈运仰, 鲍娟, 谈跃, 赵晓红, 张媛媛, 赵青
- CHEN Yun-Yang, BAO Juan, TAN Yue, ZHAO Xiao-Hong, ZHANG Yuan-Yuan, ZHAO Qing
- 轻度认知功能障碍与脑白质弥散张量成像的相关性研究
- The study of the relationship between mild cognitive impairment and diffusion tensor imaging of white matter
- 国际神经病学神经外科学杂志, 2017, 44(2): 139-144
- Journal of International Neurology and Neurosurgery, 2017, 44(2): 139-144
-
文章历史
收稿日期: 2017-02-01
修回日期: 2017-04-19
2. 昆明医科大学第二附属医院脑血管病科, 云南省昆明市 650101
轻度认知障碍 (mild cognitive impairment, MCI) 作为痴呆的预警信号已得到广泛认同,早期诊断和识别MCI对延缓痴呆的发生发展有重要意义。作为大脑皮质各个区域之间的联络纤维,脑白质完整性在维持正常认知功能中起着至关重要的作用。近来研究发现,脑白质变性负荷越重,造成纤维束的损害越广泛[1],白质损害早期就可以导致认知功能障碍[2, 3]。磁共振弥散张量成像 (diffusion tensor imaging, DTI) 可检测到普通磁共振扫描无法检测到的脑白质微结构的改变。本研究通过DTI分析不同部位脑白质损害与认知功能的相关性,评估其在MCI超早期诊断中的应用价值。
1 研究对象与方法 1.1 研究对象选取我院2015年9月至2016年1月住院患者56例,分为MCI组34例,男性16例,女性18例,平均年龄 (68.15±7.17) 岁;认知功能正常组22例,男性13例,女性9例,平均年龄 (67.45±8.65) 岁。
MCI诊断据1999年Petersen等[4]的MCI标准:① 患者本人、家属或者知情人提供的记忆障碍的主诉;② 与年龄和教育程度不相符的记忆损害 (临床记忆量表分值低于年龄和教育程度匹配常模的1.5 SD以下);③ 总体认知功能正常 (GDS2~3级);④ 日常生活能力正常 (ADL 14项≤16分);⑤ 未达到痴呆。
排除标准:具有以下任何一项:① 脑卒中 (包括既往严重脑梗死、脑出血等病史,急性期卒中);② 脑外伤、中枢神经系统感染、重金属或者CO中毒、癫痫、帕金森病、多发性硬化、代谢性脑病、颅内肿瘤和脑积水等可导致认知功能下降的神经系统疾病。可影响认知功能的慢性内科疾病,如贫血,甲状腺功能异常,心脏、肝脏和肾脏功能明显障碍等;③ 具有精神病病史,严重抑郁导致的假性认知障碍;④ 无法完成或拒绝行MRI检查者;⑤ 有视力和听力等的严重疾患不能配合完成神经心理测试者;⑥ 存在药物滥用史,以及有酗酒和吸毒等不良嗜好的患者。
所有患者近一个月内均未服用影响认知的药物。
1.2 研究方法 1.2.1 一般情况评定记录入选对象的一般情况,包括性别、年龄、受教育年限、吸烟、饮酒及既往疾病评估等。完成血常规、血生化、甲状腺功能、心电图和超声心动图等检查。
1.2.2 神经心理学量表检查所有研究对象于入院第一天完成评测。
简易智力状态检查表 (Mini-Mental State Examination, MMSE):筛除痴呆。入选条件:文盲>17分;小学 (≤6年)>20分;中学或以上 (>6年)>22分。
总体衰退量表 (Global Deterioration Scale, GDS):是对患者的记忆及总体认知情况进行分级的量表,分为7级。入选条件为:2~3级。
临床记忆量表 (Clinical Memory Scale, CMS):此量表包括指向记忆、联想学习、图象自由回忆、无意义图形再认及人像特点回忆5项分量表。入选条件为总量表分值低于年龄和教育程度匹配常模的1.5 SD以下。
日常生活能力量表 (Activity of Daily Living, ADL):共14项,最高64分。总分≤16分,为完全正常;>16分有不同程度的功能下降;≥22分为功能明显障碍。入选条件为:总分≤16分。
蒙特利尔评估量表北京版 (Montreal Cognition Assessment, MoCA, Beijing Version):用于进一步的全面评定认知功能,该量表包括视空间与执行、命名、记忆、注意、语言、抽象和定向,满分30分;教育年限≤12年,加1分,≥26分为正常。
汉密尔顿抑郁量表 (Hamilton Depression Rating Scale,HDRS):共包含24项。总分≤8分无抑郁症状;9~19分可能有抑郁;≥20分肯定有抑郁症;20~27为轻度抑郁;28~35为中度抑郁;≥36分重度抑郁。本研究纳入标准:总分≤19分。
1.2.3 磁共振检查所有研究对象均行常规MRI及DTI检查,扫描仪器为飞利浦Achieva 3.0 TX多源发射磁共振仪。常规MRI扫描,排除脑梗死、脑积水及肿瘤等病变。DTI扫描:采用单次激发的SE/EPI序列,TR=5500 ms,TE=94.6 ms,层厚/层距=4.0 mm/0 mm,FOV=24 cm×24 cm,Matrix=128×128,25个非线性方向,B值为0和1 000 s/mm2,所有轴面扫描层面平行于前-后联合线 (AC-PC线)。
图像后处理:原始图像在Philips Achieva 3.0 TXS扫描完成后上传到Philips Extended MR WorkSpace 2.6.3.4工作站,重建出部分各向异性 (Fraction Anisotropy, FA) 平滑图像及FA彩图。在FA图上采用圆形感兴趣区 (region-of-interest, ROI)(大小约20 mm2) 对不同脑区白质纤维进行FA值测量。其中额叶白质在半卵圆中心最大层面;胼胝体膝部及压部在侧脑室体部最大层面;顶叶白质选择在中央沟的最深层面;颞叶白质选择在外侧裂的最低层面;枕叶白质选择在基底节区最大层面,每个ROI测量的纤维束均利用FA彩图及T1WI叠加技术追踪同束纤维在其连续层面的上下层面取值,3个值求得的算术均数为最终结果。见图 1。
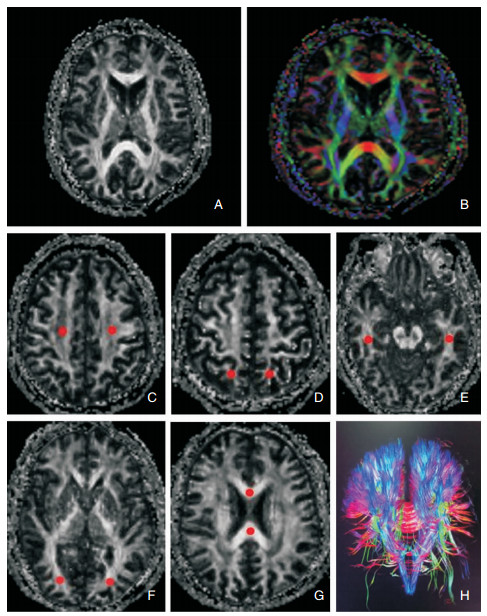
|
| 图 1 患者磁共振检查所示 注:A:FA测量图;B:DTI纤维追踪平面彩图;C:额叶白质在半卵圆中心最大层面测量点;D:顶叶白质中央沟最深层面测量点;E:颞叶白质外侧裂最低层面测量点;F:枕叶白质基底节区最大层面测量点;G:胼胝体膝部及压部在侧脑室体部最大层面测量点;H:DTI纤维追踪立体彩图。 |
SPSS 20.0软件对数据分析处理,计量资料统计量用均数±标准差 (x ±s) 表示,计数资料用例数 (n) 及百分率 (%) 表示。计量资料两组间比较采用t检验,计数资料进行χ2检验。FA值与认知功能的关系采用典型相关分析。所有检验均以P < 0.05水准作为具有统计学意义。
2 结果 2.1 MCI组与认知功能正常组一般情况比较两组间性别、年龄、受教育程度、血压、血糖、血脂、心脏病、吸烟及饮酒史等一般情况比较,差异均无统计学意义 (P>0.05),两组具有较好的可比性。见表 1。
| 一般情况 | MCI组 (n=34) | 认知功能正常组 (n=22) | χ2(t) | P |
| 性别 (男/女) | 16(47.1%)∕18(52.9%) | 13(59.1%)∕9(40.9%) | 0.774 | 0.379 |
| 年龄 (岁) | 68.15±7.17 | 67.45±8.65 | -0.329 | 0.744 |
| 受教育程度 (年) | 9.72±3.03 | 10.18±3.11 | 0.549 | 0.585 |
| 收缩压 (mmHg) | 146.95±22.47 | 139.87±21.74 | -1.166 | 0.249 |
| 舒张压 (mmHg) | 88.58±14.90 | 83.45±13.58 | -1.301 | 0.199 |
| 餐后2 h血糖 (mmol/L) | 8.33±2.64 | 7.72±1.98 | -0.927 | 0.358 |
| 甘油三脂 (mmol/L) | 2.57±0.58 | 2.45±0.76 | -0.667 | 0.507 |
| 总胆固醇 (mmol/L) | 4.82±1.01 | 4.30±1.25 | -1.713 | 0.093 |
| 心脏病 | 6(17.6%) | 3(13.6%) | 0.159 | 0.690 |
| 吸烟 | 19(55.9%) | 10(45.5%) | 0.581 | 0.446 |
| 饮酒 | 8(23.5%) | 5(22.7%) | 0.005 | 0.945 |
MCI组与认知功能正常组比较,右侧额叶FA值、左侧颞叶白质FA值及胼胝体膝部FA值均较认知功能正常组相应部位FA值降低,差异具有统计学意义 (P < 0.05),上述部位有明显白质纤维受损。见表 2。
| 感兴趣区 | MCI组 (n=34) |
认知功能正常组 (n=22) |
t | p |
| 额叶白质 | ||||
| 左侧 | 0.423±0.076 | 0.448±0.043 | 1.40 | 0.167 |
| 右侧 | 0.335±0.068 | 0.428±0.059 | 5.71 | 0.000 |
| 顶叶白质 | ||||
| 左侧 | 0.504±0.043 | 0.486±0.051 | -1.32 | 0.192 |
| 右侧 | 0.512±0.039 | 0.533±0.031 | 1.74 | 0.087 |
| 颞叶白质 | ||||
| 左侧 | 0.391±0.032 | 0.501±0.029 | 12.72 | 0.000 |
| 右侧 | 0.450±0.044 | 0.440±0.038 | -0.88 | 0.386 |
| 枕叶白质 | ||||
| 左侧 | 0.542±0.034 | 0.556±0.040 | 1.40 | 0.166 |
| 右侧 | 0.533±0.025 | 0.547±0.032 | 1.83 | 0.073 |
| 胼胝体膝部 | 0.658±0.053 | 0.783±0.083 | 9.93 | 0.000 |
| 胼胝体压部 | 0.626±0.046 | 0.651±0.057 | 1.80 | 0.076 |
将MCI组和认知功能正常组比较有差异的FA值和MMSE量表中各认知域评分进行典型相关分析,结果显示右侧额叶白质FA值与注意和计算力呈显著正相关 (r=0.342;P < 0.05),余项无明显相关,提示右侧额叶的白质损伤与注意和计算力受损有关。见表 3。
| 感兴趣区 | 注意与计算力 | 记忆力 | 定向力 | 临摹图形 |
| 右侧额叶白质FA值 | ||||
| r | 0.342 | -0.433 | 0.334 | -0.783 |
| P | 0.018 | 0.059 | 0.228 | 0.085 |
| 左侧颞叶白质FA值 | ||||
| r | -0.431 | -0.699 | 0.543 | -0.756 |
| P | 0.331 | 0.786 | 0.231 | 0.123 |
| 胼胝体膝部FA值 | ||||
| r | 0.149 | 0.654 | -0.339 | -0.323 |
| P | 0.155 | 0.089 | 0.098 | 0.431 |
将MCI组和认知功能正常组比较有统计学意义的FA值进一步和能够更准确、更全面评估认知功能的MoCA量表各认知域评分进行典型相关分析,结果发现右侧额叶白质FA值与注意与计算力显著相关 (r=0.332;P < 0.05);左侧颞叶白质FA值与记忆力显著相关 (r=0.456;P < 0.05);胼胝体膝部FA值也与记忆力显著相关 (r=0.429;P < 0.05)。进一步证实右侧额叶的白质损伤可能导致注意和计算力受损,而左侧颞叶白质和胼胝体膝部的白质受损与记忆力的损害有关。见表 4。
| 感兴趣区 | 注意力与计算 | 语言 | 抽象思维 | 记忆力 | 定向力 |
| 右侧额叶白质FA值 | |||||
| r | 0.332 | -0.451 | -0.348 | -0.783 | 0.334 |
| P | 0.041 | 0.134 | 0.662 | 0.115 | 0.228 |
| 左侧颞叶白质FA值 | |||||
| r | -0.544 | -0.675 | -0.534 | 0.456 | 0.543 |
| P | 0.072 | 0.765 | 0.099 | 0.023* | 0.231 |
| 胼胝体膝部FA值 | |||||
| r | 0.422 | 0.654 | -0.543 | 0.429 | -0.339 |
| P | 0.067 | 0.089 | 0.342 | 0.021* | 0.543 |
痴呆最好的治疗时机应在症状期前或疾病最早期,即在不可逆脑损伤发生前。但是,痴呆缺乏确定的早期标志,识别困难。MCI平均每年的痴呆转化率约10%~15%,明显高于正常人群[5, 6],是易转化为痴呆的高危人群,如何早期识别和干预MCI已成为目前的研究新热点。
目前MCI的诊断主要依赖各种神经心理学量表检查,但神经心理测试可受多种因素影响,如年龄、文化背景及受教育程度等,在认知功能的早期阶段,量表的敏感性和特异性也有较大限制,现阶段的研究一直致力在寻求更客观、更准确并能更早期识别MCI的方法。随着医学影像学技术的发展,MRI以其无创性、具有良好的组织对比分辨力、多方位、多参数的显示精细解剖结构等优点,越来越多的被应用于痴呆的研究。既往对于MCI神经影像学的研究多集中于海马、内嗅皮质的体积变化,但由于出现海马、内嗅皮质体积改变时,MCI的认知损害基本已不可逆,新研究开始转向脑内更早期的超微结构改变。DTI是在弥散加权成像技术基础上发展起来的成像技术,通过分析组织内水分子在不同方向上扩散,观察组织的细微结构,能够在没有形态学改变之前发现脑白质超微结构的改变[7]。FA值是目前DTI常用的分析参数,是指水分子各向异性成分占整个张量的比例,值在0~1之间,值越高代表方向弥散度越大,一定程度上反映脑白质完整性,FA值降低提示白质的完整性的损害[8]。各个脑区之间白质联系纤维的结构和功能正常是保证个体从事记忆提取、监控外界环境以及控制自身心理状态等多种高级智能活动基础,白质损害可导致认知功能障碍,严重则表现为痴呆[2, 3],但脑白质变性程度和MCI的相关性尚存在争议。
本研究共纳入MCI组34例,认知功能正常组22例,平衡了组间年龄、性别、文化程度、伴发疾病等因素,使两组间有较好的可比性。通过DTI对不同部位脑白质纤维进行FA值测量,研究结果发现,MCI组患者与认知功能正常组相比,右侧额叶、左侧颞叶及胼胝体膝部白质FA值降低,提示该部位有明显白质损害。将上述部位FA值和MMSE量表中各认知域评分进行相关分析,结果显示右侧额叶白质FA值与注意、计算力呈显著正相关,再进一步将FA值与能更精确评估认知功能的MoCA量表中各认知域评分进行相关分析,除右侧额叶白质FA值与注意、计算力相关外,左侧颞叶、胼胝体膝部白质FA值还与记忆力显著相关。两个量表结果间的差异可能与MoCA涉及的认知领域更加广泛,并且针对认知障碍早期容易受损的延迟回忆与执行注意功能增设了具体测试及评分权重有关,此外,与MMSE相比,MoCA对注意与计算力测试更为复杂。目前关于额叶白质病变的严重程度对整体认知功能影响的相关研究较少,Clinton等[9]的研究显示,额叶皮质下脑白质变性与精神运动处理速度和认知灵活性存在相关性。Smith等[10]则认为,额叶脑白质变性与记忆障碍有关。而颞叶内侧面属于边缘系统,海马是其中的重要结构,与记忆、精神、行为和内脏功能有关,有研究发现,MCI及阿尔茨海默病患者颞叶内侧脑白质结构变化较为明显[11, 12]。本研究结果与Douaud等[13]发现的额叶、颞叶白质微结构病变可能导致情感记忆及描述性记忆损害有关相符。本研究还证实胼胝体膝部白质FA值也与记忆力显著相关,与Madden等[14]胼胝体膝部白质纤维与语意记忆的提取效率有关的研究相符。胼胝体是大脑半球中最大的连合纤维,在记忆的形成和提取过程等认知功能中起着重要作用,当白质病变累及胼胝体时,可能引起皮质及皮质下网络的广泛失连接,从而导致认知功能减退甚至痴呆。Meguro等[15]的研究显示,胼胝体萎缩程度与认知功能的损害存在相关性,可将胼胝体FA值作为胼胝体白质纤维损害的敏感指标评估认知功能损害[16]。
DTI可以较好的评价组织结构的病理生理学变化,检测脑白质微结构的改变。本研究证实,运用DTI检测不同部位脑白质损伤,尤其右侧额叶、左侧颞叶、胼胝体膝部等,对早期区分MCI和认知功能正常者有一定的意义。对于MCI患者,DTI所检测到的白质微结构变化常先于海马体积萎缩的影像学标志[17],较海马、内嗅皮质萎缩能更早的反映患者认知功能已发生损害,可能成为超早期识别与诊断MCI的新方法。
| [1] | Miranda B, Madureira S, Verdelho A, et al. Self-perceived memory impairment and cognitive performance in an elderly independent population with age-related white matter changes[J]. J Neurol Neurosurg Psychiatry, 2008, 79(8): 869–873. DOI:10.1136/jnnp.2007.131078 |
| [2] | Greicius MD, Krasnow B, Reiss AL, et al. Functional connectivity in the resting brain:a network analysis of the default mode hypothesis[J]. Proc Natl Acad Sci USA, 2003, 100(1): 253–258. DOI:10.1073/pnas.0135058100 |
| [3] | Greicius MD, Srivastava G, Reiss AL, et al. Default-mode network activity distinguishes Alzheimer's disease from healthy aging:evidence from functional MRI[J]. Proc Natl Acad Sci U S A, 2004, 101(13): 4637–4642. DOI:10.1073/pnas.0308627101 |
| [4] | Petersen RC, Smith GE, Waring SC, et al. Mild cognitive impairment:clinical characterization and outcome[J]. Arch Neurol, 1999, 56(3): 303–308. DOI:10.1001/archneur.56.3.303 |
| [5] | Vega JN, Newhouse PA. Mild cognitive impairment:diagnosis, longitudinal course, and emerging treatments[J]. Curr Psychiatry Rep, 2014, 16(10): 490. DOI:10.1007/s11920-014-0490-8 |
| [6] | Singh B, Parsaik AK, Mielke MM, et al. Association of Mediterranean diet with mild cognitive impairment and Alzheimer's disease:a systematic review and meta-analysis[J]. J Alzheimer's Dis, 2014, 39(2): 271–282. |
| [7] | 陈运仰, 谈跃. 神经影像在轻度认知障碍研究中的应用[J]. 国际神经病学神经外科学杂志, 2016, 43(1): 73–76. |
| [8] | Pierpaoli C, Basser PJ. Toward a quantitative assessment of diffusion anisotropy[J]. Magn Reson Med, 1996, 36(6): 893–906. DOI:10.1002/(ISSN)1522-2594 |
| [9] | Clinton LK, Blurton-Jones M, Myczek K, et al. Synergistic Interactions between Abeta, tau, and alpha-synuclein:acceleration of neuropathology and cognitive decline[J]. J Neurosci, 2010, 30(21): 7281–7289. DOI:10.1523/JNEUROSCI.0490-10.2010 |
| [10] | Smith EE, Salat DH, Jeng J, et al. Correlations between MRI white matter lesion location and executive function and episodic memory[J]. Neurology, 2011, 76(17): 1492–1499. DOI:10.1212/WNL.0b013e318217e7c8 |
| [11] | Kavcic V, Ni H, Zhu T, et al. White matter integrity linked to functional impairments in aging and early Alzheimer's disease[J]. Alzheimers Dement, 2008, 4(6): 381–389. DOI:10.1016/j.jalz.2008.07.001 |
| [12] | Stebbins GT, Murphy CM. Diffusion tensor imaging in Alzheimer's disease and mild cognitive impairment[J]. Behav Neurol, 2009, 21(1): 39–49. |
| [13] | Douaud G, Jbabdi S, Behrens TE, et al. DTI measures in crossing-fibre areas:increased diffusion anisotropy reveals early white matter alteration in MCI and mild Alzheimer's disease[J]. Neuroimage, 2011, 55(3): 880–890. DOI:10.1016/j.neuroimage.2010.12.008 |
| [14] | Madden DJ, Bennett IJ, Song AW. Cerebral white matter integrity and cognitive aging:contributions from diffusion tensor imaging[J]. Neuropsychol Rev, 2009, 19(4): 415–435. DOI:10.1007/s11065-009-9113-2 |
| [15] | Meguro K, Constans JM, Courtheoux P, et al. Atrophy of the corpus callosum correlates with white matter lesions in patients with cerebral ischaemia[J]. Neuroradiology, 2000, 42(6): 413–419. DOI:10.1007/s002340000302 |
| [16] | Freitas S, Simoes MR, Alves L, et al. Montreal Cognitive Assessment (MoCA):validation study for vascular dementia[J]. J Int Neuropsychol Soc, 2012, 18(6): 1031–1040. DOI:10.1017/S135561771200077X |
| [17] | Zhuang L, Sachdev PS, Trollor JN. Microstructural white matter changes, not hippocampal atrophy, detect early amnestic mild cognitive impairment[J]. PLoS One, 2013, 8(3): e58887. DOI:10.1371/journal.pone.0058887 |
 2017, Vol. 44
2017, Vol. 44




