扩展功能
文章信息
- 陈文琳, 李鑫, 毛翛, 李楠, 曾胜, 杨柯, 唐北沙, 武国德
- CHEN Wen-Lin, LI Xin, MAO Xiao, LI Nan, ZENG Sheng, YANG Ke, TANG Bei-Sha, WU Guo-De
- 晚发型甲基丙二酸尿症合并同型半胱氨酸血症临床及分子遗传学特点研究
- Clinical and molecular genetic features of late-onset methylmalonic aciduria with homocystinemia
- 国际神经病学神经外科学杂志, 2017, 44(2): 132-138
- Journal of International Neurology and Neurosurgery, 2017, 44(2): 132-138
-
文章历史
收稿日期: 2017-01-14
修回日期: 2017-04-19
2. 兰州大学附属第二医院神经内科, 甘肃省兰州市 730030;
3. 中南大学湘雅医院湖南省神经退行性疾病重点实验室, 湖南省长沙市 410008;
4. 医学遗传学国家重点实验室,湖南省长沙市 410008
甲基丙二酸尿症合并同型半胱氨酸血症 (OMIM 277400) 是由于机体内运钴胺蛋白Ⅱ缺陷导致的维生素B12代谢障碍引起的一种常染色体隐性遗传代谢性疾病,可分为早发型 ( < 12个月) 和晚发型 (≥12个月) 两种[1, 2]。晚发型甲基丙二酸尿症合并同型半胱氨酸血症的临床表现各异,发病年龄从1岁到40多岁不等,临床诊断主要依靠血尿代谢检查和分子遗传学分析[3, 4]。该病的发生主要是由MMACHC基因突变引起,目前已发现50余种与该病相关的突变。在本研究中,我们报道一例以精神症状首发的晚发型甲基丙二酸尿症合并同型半胱氨酸血症病例并系统地总结了已发表文献中晚发型甲基丙二酸尿症合并同型半胱氨酸血症病例的临床及分子遗传学特点。
1 资料与方法 1.1 临床资料患者为20岁女性,因间歇性胡言乱语、尿床、苦笑无常8个月,加重2个月就诊。患者父母体健,非近亲结婚,无类似家族史。体查:神清,定向力准确,自知力存在;表情呆板,重复语言;生活自理差,意志行为减退,活动减少;感觉、知觉障碍及妄想无法检查;记忆力、注意力检查不配合。双上肢肌力5级,双下肢肌力5级。辅助检查:尿甲基丙二酸升高 (196.64 μg/mg,正常参考值:0.2~ 3.6 μg/mg) 伴有血同型半胱氨酸水平升高 (90.7 μM, 正常参考值: 5.0~15.0 μM)。血常规未见异常,叶酸、维生素B12水平正常。胸部X-ray未见异常。头颅磁共振报告脑萎缩征象。颈部血管彩超报告双侧椎动脉走行变异。故诊断考虑甲基丙二酸血症合并同型半胱氨酸尿症。给予静脉羟基钴胺素 (1 mg, 每日1次) 和口服叶酸 (5 mg, 每日3次) 治疗后,患者症状明显改善。对该患者及患者父母进行病史询问,静脉采血,体格检查,常规实验室检查和头颅MRI扫描。所有检查均获得患者家属的知情同意,并经兰州大学附属第二医院医学伦理委员会审查同意。
1.2 方法 1.2.1 数据库检索以late-onset combined methylmalonic aciduria and homocystinuria, cblC type、MMACHC、cobalamin、MMA为关键词检索pubmed;以晚发型甲基丙二酸血症合并同型半胱氨酸尿症、cblC、MMACHC基因为关键词检索万方数据库和中国知网数据库获取相关文献。以年龄大于12个月作为纳入晚发型甲基丙二酸血症合并同型半胱氨酸尿症的分析标准。
1.2.2 基因组DNA的提取氯仿抽提法提取外周血淋巴细胞基因组DNA,无水乙醇沉淀,置20℃冰箱保存。
1.2.3 二代测序及Sanger测序法检测MMACHC基因应用高通量测序技术检测患者MMACHC基因全外显子序列,通过比对参考序列找寻基因突变位点,并通过Sanger测序对患者及父母存在的2个 (可疑) 致病性位点进行测序验证。Sanger测序扩增引物通过Primer Premier 5.0软件进行设计,序列: MMACHC-exon2-F1: CCTGAAGGTTAAGGTGTGGG, MMACHC-exon2-R1: GGTCAGTCAGCATTCGGAGG; MMACHC-exon4-F1: CAGAGGTTTAT GTAGTCAGT, MMACHC-exon4-R1: GAGTAGGGCGATACGGTCAG。上述两对引物PCR反应Tm值为60℃,PCR产物经1.5%琼脂糖凝胶电泳分析确认,将未纯化产物送长沙擎科公司测序。测序数据用DNAstar软件读取,并用SeqMan软件将所测序列与UCSC中的基因标准序列进行比对分析,记录序列比对结果。
2 结果 2.1 文献总结分析通过筛选,本次文献复习共纳入31例病案报道或研究,共61例患者,并对他们的临床症状、准确的发病年龄、性别和分子遗传学分析结果根据文献中提供的信息进行总结。61例患者中男性为24例,女性为37例,该病发病的男女比例约为0.64,提示晚发型甲基丙二酸尿症合并同型半胱氨酸血症在女性患者中更常见。
在表 1中,我们总结了61例患者的性别、发病年龄、临床表现和突变分析的结果,其中6例病人临床信息不全,16例病人未进行突变分析。发病年龄从1.25岁到44岁不等,平均发病年龄为15岁.目前与晚发型甲基丙二酸尿症合并同型半胱氨酸血症相关的MMACHC基因突变有28个,包括我们这次报道的新突变 (图 1)。在45例病人的突变分析的结果中,最常见的是c.609G>A (18%),其次是c.271dupA (11%) 和c.482G>A (11%)。
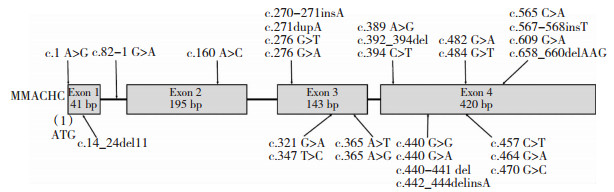
|
| 图 1 与晚发型甲基丙二酸尿症合并同型半胱氨酸血症相关的MMACHC基因突变 (共28个) |
| 编号 | 性别 | 发病年龄 | 临床表现 | 突变 | 参考文献 | |
| 等位基因1 | 等位基因2 | |||||
| 1 | 女 | 44 | 认知减退;视盘苍白;静脉血栓形成;肺栓塞 | c.271dupA | c.440G>C | [5] |
| 2 | 男 | 41 | 抑郁症;神经病变;脊柱异常信号;脑室周围白质病变;脊髓病变 | c.365A>G | c.457C>T | [6] |
| 3 | 男 | 40 | 认知减退;幻觉;神经病变;脊髓病变;脑萎缩 | c.482G>A | c.609G>A | [7] |
| 4 | 男 | 38 | 高血压;癫痫;进行性意识混乱;进行性脑室周围白质病变 | N/A | N/A | [8] |
| 5 | 女 | 36 | 神经病变;精神症状 | c.271dupA | c.482G>A | [9] |
| 6 | 女 | 34 | 冷漠;可逆的白质异常;麻痹性痴呆;呼吸功能不全 | c.347T>C | c.347T>C | [2] |
| 7 | 女 | 32 | 血管球性肾炎;静脉血栓形成 | c.271dupA c.365A>G |
c.457C>T | [6] |
| 8 | 女 | 32 | 神经病变;脊髓病变;视盘苍白;白血球减少症 | c.271dupA | c.440G>C | [5] |
| 9 | 女 | 29 | 不典型 | N/A | N/A | [10] |
| 10 | 女 | 29 | 不典型 | N/A | N/A | [11] |
| 11 | 女 | 28 | 黄斑病变;缺铁性贫血 | c. 482 G>A | c.270_271insA | [12] |
| 12 | 男 | 26 | 神经病变;亚急性脊髓联合变性;认知减退;静脉血栓形成 | c.482G>A | c.82-1G>A | [2] |
| 13 | 女 | 24 | 脊髓病变 | c.271dupA | c.347 T>C | [13] |
| 14 | 男 | 23 | 精神症状;溶血性尿毒综合征 | c.565C>A | c.565C>A | [2] |
| 15 | 男 | 23 | 认知减退;共济失调;神经病变;脊髓病变 | c.392_394del | c.392_394del | [14] |
| 16 | 女 | 22 | 由怀孕/剖腹产手术引发;反应迟缓;神经病变 | c.609G>A | c.1A>G | [7] |
| 17 | 女 | 20 | 认知减退;精神行为异常;大脑萎缩;胼胝体变薄;下肢无力 | c.160 C>A | c.482G>A | # |
| 18 | 男 | 20 | 溶血性尿毒综合征;肾衰竭;恶性高血压 | c.271dupA | c.389A>G | [15] |
| 19 | 女 | 18 | 血管球性肾炎;精神行为异常;癫痫;认知减退;复发性血栓形成;肺栓塞;神经病变;脊髓病变;皮质萎缩, 脑白质病 | c.271dupA | c.365A>G | [6] |
| 20 | 女 | 18 | 昏睡;大脑萎缩;智力迟钝 | 440G>A | 470G>C | [16] |
| 21 | 女 | 18 | 癫痫;贫血;肾损害 | 271dupA | c.565C>A | [17] |
| 22 | 男 | 17 | 精神行为异常;双下肢无力;昏睡 | c.482G>A | c.482G>A | [18] |
| 23 | 男 | 16 | 肾损害 | N/A | N/A | [19] |
| 24 | 女 | 16 | 血栓栓塞;神经病变;脊髓病变;精神行为异常 | c.271dupA | c.347T>C | [13] |
| 25 | 男 | 14 | 精神行为异常;智力迟钝 | N/A | N/A | [20] |
| 26 | 女 | 14 | 认知减退;抑郁症;共济失调;癫痫;神经病变;脊髓病变 | c.394C>T | c.394C>T | [21] |
| 27 | 女 | 14 | 肺动脉高压;溶血性尿毒综合征 | c.271dupA | c.276G>T | [22] |
| 28 | 男 | 14 | 嗜睡;视力下降;黄斑萎缩;眼球震颤 | c.321G>A c.365A>T |
c.658_660delAAG | [23] |
| 29 | 女 | 13 | 认知减退;共济失调 | N/A | N/A | [22] |
| 30 | 女 | 13 | 下肢无力;巨幼细胞性贫血;缺铁性贫血 | c.482G>A | c.658_660delAAG | [24] |
| 31 | 女 | 13 | 精神行为异常;记忆力;下降;嗜睡;食欲减退 | c.482G>A | c.609G>A | [18] |
| 32 | 男 | 13 | 妄想;抽搐;神经病变 | N/A | N/A | [25] |
| 33 | 女 | 12 | 共济失调;神经病变;脊髓病变;精神行为异常 | N/A | N/A | [11] |
| 34 | 女 | 12 | 精神行为异常;智力迟钝 | c.482G>A | c.609G>A | [24] |
| 35 | 男 | 12 | 精神行为异常;共济失调 | c.482G>A | c.658_660delAAG | [18] |
| 36 | 女 | 12 | 精神行为异常;记忆力下降 | N/A | N/A | [25] |
| 37 | 男 | 11 | 溶血性尿毒综合征;高血压脑病;昏迷;惊厥 | N/A | N/A | [26] |
| 38 | 女 | 11 | 认知减退;精神行为异常;共济失调 | N/A | N/A | [27] |
| 39 | 男 | 11 | 头痛;痉挛;嗜睡;意识改变 | c.567_568insT | c.482G>A | [28] |
| 40 | 女 | 10 | 认知减退;神经性厌食症;紧张症;精神错乱;癫痫;脑萎缩;胼胝体变薄 | c.394C > T | c.394C > T | [4] |
| 41 | 女 | 9 | 淡漠;双下肢无力;巨幼红细胞性贫血 | N/A | N/A | [25] |
| 42 | 女 | 8 | 溶血性尿毒综合征 | N/A | N/A | [29] |
| 43 | 女 | 7 | 认知减退;神经病变;脊髓病变;癫痫 | c.482G > A | c.609G > A | [7] |
| 44 | 女 | 6 | 溶血性尿毒综合征;肺动脉高压 | N/A | N/A | [29] |
| 45 | 女 | 4.3 | 共济失调;精神行为异常;巨红细胞性贫血;大脑萎缩;胼胝体变薄 | c.394C>T | c.394C>T | [30] |
| 46 | 女 | 4 | 嗜睡 | c.321G>A c.365A>T |
c.658_660delAAG | [23] |
| 47 | 女 | 4 | 认知减退;脑积水 | c.609G>A | c.440_441del | [28] |
| 48 | 女 | 4 | 溶血性尿毒综合征 | c.276G>A | c.14_24del11 | [21] |
| 49 | 女 | 4 | 溶血性尿毒综合征 | N/A | N/A | [26] |
| 50 | 男 | 3.5 | 认知减退;昏睡;惊厥 | c.609G>A | c.609G>A | [31] |
| 51 | 男 | 3 | 溶血性尿毒综合征;肺动脉高压 | c.276G>A | c.442_444delinsA | [21] |
| 52 | 男 | 3 | 溶血性尿毒综合征;肺动脉高压 | c.276G>T | c.442_444delinsA | [32] |
| 53 | 男 | 2.5 | 溶血性尿毒综合征;肺动脉高压 | c.276G>A | c.14_24del11 | [12] |
| 54 | 男 | 2.5 | 不典型 | N/A | N/A | [31] |
| 55 | 男 | 2 | 昏睡;惊厥;肌张力减退 | c.609G>A | c.394C>T | [31] |
| 56 | 男 | 2 | 智力迟钝;发育迟缓 | c.609G>A | c.609G>A | [33] |
| 57 | 男 | 2 | N/A | c.609G>A | c.609G>A | [20] |
| 58 | 女 | 1.5 | N/A | c.609G>A | c.658_660delAAG | [31] |
| 59 | 女 | 1.5 | N/A | c.609G>A | c.609G>A | [31] |
| 60 | 男 | 1.5 | 溶血性尿毒综合征;肺动脉高压 | c.464G>A | c.464G>A | [4] |
| 61 | 女 | 1.25 | 溶血性尿毒综合征;肺动脉高压 | c.484G>T | c.484G>T | [34] |
| 注:N/A为患者信息不全。 | ||||||
我们排除6例临床资料不全的病例后进行分析发现,晚发型甲基丙二酸尿症合并同型半胱氨酸血症最常见的临床表现是认知减退 (15例,24.6%) 和精神行为异常 (15例,24.6%),其次是溶血性尿毒综合征 (13例,21.3%) 和神经病变 (12例,19.7%),再次是脊髓病变 (10例,16.4%)、癫痫/惊厥 (8例,13.1%)、肺动脉高压 (8例,13.1%)、共济失调 (7例,11.5%) 和脑萎缩 (6例,9.8%)。见图 2。
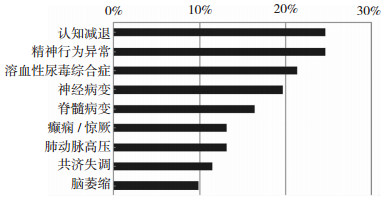
|
| 图 2 晚发型甲基丙二酸尿症合并同型半胱氨酸血症主要的临床症状 |
尽管该病的发病年龄的范围很大,但我们经过分析后发现临床症状与发病年龄之间存在联系。包括脊髓病变 (平均发病年龄:24.4岁)、神经病变 (平均发病年龄:22.3岁)、认知减退 (平均发病年龄:18.3岁) 和脑萎缩 (平均发病年龄:18.3岁) 在内的临床表现更常见于成年人,精神行为异常 (平均发病年龄:15.3岁)、共济失调 (平均发病年龄:12.7岁) 和癫痫/惊厥 (平均发病年龄:12.9岁) 在青少年患者出现的较多,而溶血性尿毒综合征 (平均发病年龄:7.7岁) 和肺动脉高压 (平均发病年龄:4.4岁) 则主要见于儿童患者。见图 3。
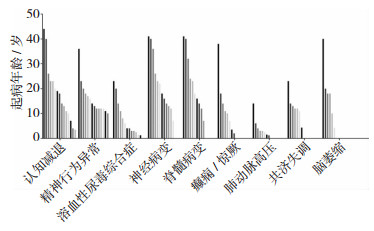
|
| 图 3 晚发型甲基丙二酸尿症合并同型半胱氨酸血症主要临床症状与年龄分布 |
患者胸部正侧位片报告心、肺、膈未见异常。MRI扫描可见胼胝体变薄和全脑明显萎缩 (图 4A和图 4B)。DWI发现双侧尾状核头对称性信号增高 (图 4C和图 4D)。治疗后CT复查发现脑萎缩明显改善 (图 4E、图 4F、图 4G和图 4H)
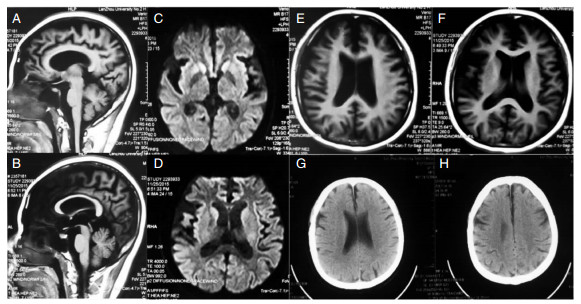
|
| 图 4 患者MRI、DWI和CT影像结果 注:A和B:MRI显示患者全脑萎缩合并有胼胝体变薄;C和D:DWI可见基底节区双侧尾状核头对称性信号增高;E和F:患者就诊时MRI报告全脑萎缩;G和H:治疗后复查CT显示患者脑萎缩明显改善。 |
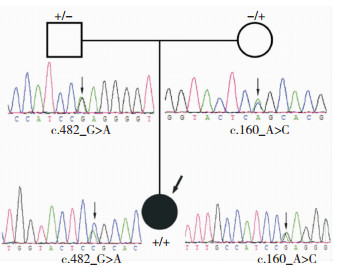
该家系呈常染色体隐性遗传,患者和父母均检测到MMACHC基因的突变。基因序列分析发现患者为复合杂合突变,包括MMACHC基因2号外显子一个错义突变 (c.160A>C) 和4号外显子的一个错义突变 (c.482G>A)。Sanger测序发现父亲携带有MMACHC基因4号外显子的一个错义突变 (c.482G>A),而母亲携带2号外显子一个错义突变 (c.160A>C)。见图 5。
|
| 图 5 家系图和MMACHC基因测序结果 注:患者为复合杂合突变,包括MMACHC基因c.160A>C和c.482G>A两个突变,其中c.482G>A突变来自父亲,c.160A>C来自母亲 |
晚发型甲基丙二酸尿症合并同型半胱氨酸血症的发生与MMACHC基因的突变有着紧密联系,目前对cblC型缺陷患者MMACHC基因突变研究,已发现50余种突变,并且有种族特异性[35]。c.271dupA主要见于欧洲人,c.394C>T在美洲的印第安人及中东地区的迟发型患者中较多见;c.609G>A则在东亚患者中常见[1, 36]。我国早发型cblC缺陷患者MMACHC基因突变主要为c.609G>A与c.658-660delAAG,而c.394 C>T和c.482 G>A突变较常见于晚发型[37]。
本例患者中发现MMACHC基因的2个突变:2号外显子的一个新错义突变 (c.160A>C) 和4号外显子的一个已知错义突变 (c.482G>A)。c.482G>A突变导致第161位精氨酸错译成谷氨酰胺,c.160A>C突变导致第54位丝氨酸错译成精氨酸。
值得一提的是,该患者除了有之前报道过的MRI典型脑萎缩征象外,DWI还发现基底节区双侧尾状核头对称性信号增高,这类影像学改变对代谢病的诊断具有比较明确的指导意义[7, 38]。而且给予该患者静脉羟基钴胺素和口服叶酸治疗后,精神症状和脑萎缩都获得了明显的改善。由于该疾病的临床表现和发病年龄变异很大,最终的确诊要依赖血尿代谢实验室检查和分子遗传学分析,但是一经诊断,上述症状经治疗后多数可得到明显改善。
晚发型甲基丙二酸尿症合并同型半胱氨酸血症临床表现较为复杂,易漏诊误诊,因此对于临床中不明原因的神经精神疾病合并影像学的脑萎缩及双侧基底节区对称性改变要考虑代谢异常的可能性。
| [1] | Lerner-Ellis JP, Tirone JC, Pawelek PD, et al. Identification of the gene responsible for methylmalonic aciduria and homocystinuria, cblC type[J]. Nat Genet, 2006, 38(1): 93–100. DOI:10.1038/ng1683 |
| [2] | Huemer M, Scholl-Burgi S, Hadaya K, et al. Three new cases of late-onset cblC defect and review of the literature illustrating when to consider inborn errors of metabolism beyond infancy[J]. Orphanet J Rare Dis, 2014, 9: 161. DOI:10.1186/s13023-014-0161-1 |
| [3] | Rosenblatt DS, Aspler AL, Shevell MI, et al. Clinical heterogeneity and prognosis in combined methylmalonic aciduria and homocystinuria (cblC)[J]. J Inherit Metab Dis, 1997, 20(4): 528–538. DOI:10.1023/A:1005353530303 |
| [4] | Ben-Omran TI, Wong H, Blaser S, et al. Late-onset cobalamin-C disorder:a challenging diagnosis[J]. Am J Med Genet A, 2007, 143a(9): 979–984. DOI:10.1002/(ISSN)1552-4833 |
| [5] | Powers JM, Rosenblatt DS, Schmidt RE, et al. Neurological and neuropathologic heterogeneity in two brothers with cobalamin C deficiency[J]. Ann Neurol, 2001, 49(3): 396–400. DOI:10.1002/(ISSN)1531-8249 |
| [6] | Thauvin-Robinet C, Roze E, Couvreur G, et al. The adolescent and adult form of cobalamin C disease:clinical and molecular spectrum[J]. J Neurol Neurosurg Psychiatry, 2008, 79(6): 725–728. |
| [7] | Wang X, Sun W, Yang Y, et al. A clinical and gene analysis of late-onset combined methylmalonic aciduria and homocystinuria, cblC type, in China[J]. J Neurol Sci, 2012, 318(1-2): 155–159. DOI:10.1016/j.jns.2012.04.012 |
| [8] | Boxer AL, Kramer JH, Johnston K, et al. Executive dysfunction in hyperhomocystinemia responds to homocysteine-lowering treatment[J]. Neurology, 2005, 64(8): 1431–1434. DOI:10.1212/01.WNL.0000158476.74580.A8 |
| [9] | Tsai AC, Morel CF, Scharer G, et al. Late-onset combined homocystinuria and methylmalonic aciduria (cblC) and neuropsychiatric disturbance[J]. Am J Med Genet A, 2007, 143a(20): 2430–2434. DOI:10.1002/(ISSN)1552-4833 |
| [10] | Lin HJ, Neidich JA, Salazar D, et al. Asymptomatic maternal combined homocystinuria and methylmalonic aciduria (cblC) detected through low carnitine levels on newborn screening[J]. J Pediatr, 2009, 155(6): 924–927. DOI:10.1016/j.jpeds.2009.06.046 |
| [11] | Gold R, Bogdahn U, Kappos L, et al. Hereditary defect of cobalamin metabolism (homocystinuria and methylmalonic aciduria) of juvenile onset[J]. J Neurol Neurosurg Psychiatry, 1996, 60(1): 107–108. DOI:10.1136/jnnp.60.1.107 |
| [12] | Collison FT, Xie YA, Gambin T, et al. Whole Exome Sequencing Identifies an Adult-Onset Case of Methylmalonic Aciduria and Homocystinuria Type C (cblC) with Non-Syndromic Bull's Eye Maculopathy[J]. Ophthalmic Genet, 2015, 36(3): 270–275. DOI:10.3109/13816810.2015.1010736 |
| [13] | Roze E, Gervais D, Demeret S, et al. Neuropsychiatric disturbances in presumed late-onset cobalamin C disease[J]. Arch Neurol, 2003, 60(10): 1457–1462. DOI:10.1001/archneur.60.10.1457 |
| [14] | Backe PH, Ytre-Arne M, Rohr AK, et al. Novel Deletion Mutation Identified in a Patient with Late-Onset Combined Methylmalonic Acidemia and Homocystinuria, cblC Type[J]. JIMD Rep, 2013, 11: 79–85. DOI:10.1007/978-3-642-37328-2 |
| [15] | Cornec-Le Gall E, Delmas Y, De Parscau L, et al. Adult-onset eculizumab-resistant hemolytic uremic syndrome associated with cobalamin C deficiency[J]. Am J Kidney Dis, 2014, 63(1): 119–123. DOI:10.1053/j.ajkd.2013.08.031 |
| [16] | Yamamoto M, Yasui K, Watanabe Y, et al. A case of late-onset cobalamin C disease (methylmalonic aciduria and homocystinuria, cobalamin C type)[J]. Rinsho Shinkeigaku, 2015, 55(1): 23–28. DOI:10.5692/clinicalneurol.55.23 |
| [17] | Jimenez Varo I, Bueno Delgado M, Dios Fuentes E, et al. Combined methylmalonic acidemia and homocystinuria; a case report[J]. Nutr Hosp, 2015, 31(4): 1885–1888. |
| [18] | 雷如意, 刘艳茹, 籍炀飞, 等. 晚发型甲基丙二酸尿症cblC型三例临床特点和基因分析[J]. 中华神经科杂志, 2014, 47(2): 101–106. |
| [19] | Brunelli SM, Meyers KE, Guttenberg M, et al. Cobalamin C deficiency complicated by an atypical glomerulopathy[J]. Pediatr Nephrol, 2002, 17(10): 800–803. DOI:10.1007/s00467-002-0895-1 |
| [20] | Goodman SI, Moe PG, Hammond KB, et al. Homocystinuria with methylmalonic aciduria:two cases in a sibship[J]. Biochem Med, 1970, 4(5): 500–515. |
| [21] | Komhoff M, Roofthooft MT, Westra D, et al. Combined pulmonary hypertension and renal thrombotic microangiopathy in cobalamin C deficiency[J]. Pediatrics, 2013, 132(2): e540–e544. DOI:10.1542/peds.2012-2581 |
| [22] | Shinnar S, Singer HS. Cobalamin C mutation (methylmalonic aciduria and homocystinuria) in adolescence[J]. A treatable cause of dementia and myelopathy. N Engl J Med, 1984, 311(7): 451–454. |
| [23] | 欧阳明, 刘璐, 梁平, 等. 甲基丙二酸尿症合并同型半胱氨酸血症cblC型家系的临床与分子遗传学研究[J]. 中华实验眼科杂志, 2014, 32(8): 723–727. |
| [24] | 崔冬, 陈淑丽, 温鹏强, 等. 迟发型甲基丙二酸血症二家系的临床及基因突变分析[J]. 中华儿科杂志, 2010, 48(6): 469–472. |
| [25] | 李燕飞, 彭涛, 马兴荣, 等. 以精神症状为首发的迟发型甲基丙二酸血症3例报告[J]. 中国当代儿科杂志, 2014, 16(1): 85–86. DOI:10.7499/j.issn.1008-8830.2014.01.019 |
| [26] | Van Hove JL, Van Damme-Lombaerts R, Grunewald S, et al. Cobalamin disorder Cbl-C presenting with late-onset thrombotic microangiopathy[J]. Am J Med Genet, 2002, 111(2): 195–201. DOI:10.1002/ajmg.10499 |
| [27] | Augoustides-Savvopoulou P, Mylonas I, Sewell AC, et al. Reversible dementia in an adolescent with cblC disease:clinical heterogeneity within the same family[J]. J Inherit Metab Dis, 1999, 22(6): 756–758. DOI:10.1023/A:1005508620919 |
| [28] | Wang J, Li E, Wang L, et al. Genetic analysis of four cases of methylmalonic aciduria and homocystinuria, cblC type#[J]. Int J Clin Exp Pathol, 2015, 8(8): 9337–9341. |
| [29] | Guigonis V, Fremeaux-Bacchi V, Giraudier S, et al. Late-onset thrombocytic microangiopathy caused by cblC disease:association with a factor H mutation[J]. Am J Kidney Dis, 2005, 45(3): 588–595. DOI:10.1053/j.ajkd.2004.12.004 |
| [30] | Kilic M, Ozgul RK, Dursun A, et al. Cobalamin C defect:a patient of late-onset type with homozygous p.R132* mutation[J]. Turk J Pediatr, 2013, 55(6): 633–636. |
| [31] | Wang F, Han L, Yang Y, et al. Clinical, biochemical, and molecular analysis of combined methylmalonic acidemia and hyperhomocysteinemia (cblC type) in China[J]. J Inherit Metab Dis, 2010, 33(Suppl 3): S435–S442. |
| [32] | Bouts AH, Roofthooft MT, Salomons GS, et al. CD46-associated atypical hemolytic uremic syndrome with uncommon course caused by cblC deficiency[J]. Pediatr Nephrol, 2010, 25(12): 2547–2548. DOI:10.1007/s00467-010-1609-8 |
| [33] | 唐晖, 郝虎, 汤绍辉, 等. 甲基丙二酸尿症一家系MMACHC基因突变分析[J]. 中华医学遗传学杂志, 2009, 26(1): 62–65. |
| [34] | Gunduz M, Ekici F, Ozaydin E, et al. Reversible pulmonary arterial hypertension in cobalamin-dependent cobalamin C disease due to a novel mutation in the MMACHC gene[J]. Eur J Pediatr, 2014, 173(12): 1707–1710. DOI:10.1007/s00431-014-2330-6 |
| [35] | 王蓓, 赵重波, 朱雯华, 等. 晚发型甲基丙二酸血症CblC亚型一例[J]. 中华神经科杂志, 2014, 47(10): 742–743. DOI:10.3760/cma.j.issn.1006-7876.2014.10.018 |
| [36] | Nogueira C, Aiello C, Cerone R, et al. Spectrum of MMACHC mutations in Italian and Portuguese patients with combined methylmalonic aciduria and homocystinuria, cblC type[J]. Mol Genet Metab, 2008, 93(4): 475–480. DOI:10.1016/j.ymgme.2007.11.005 |
| [37] | 王斐, 韩连书, 胡宇慧, 等. 甲基丙二酸血症伴同型半胱氨酸血症患儿基因突变分析[J]. 中华儿科杂志, 2009, 47(3): 189–193. |
| [38] | Hegde AN, Mohan S, Lath N, et al. Differential diagnosis for bilateral abnormalities of the basal ganglia and thalamus[J]. Radiographics, 2011, 31(1): 5–30. DOI:10.1148/rg.311105041 |
 2017, Vol. 44
2017, Vol. 44




