扩展功能
文章信息
- 王勇朝, 田亚楠, 王建宇, 崔永建, 魏琰
- Wang Yong-Zhao, Tian Ya-Nan, Wang Jian-Yu, Cui Yong-Jian, Wei Yan
- 血清透明质酸水平预测急性期自发性脑出血患者预后的临床研究
- Clinical value of serum hyaluronic acid level in acute stage in predicting the prognosis of patients with spontaneous intracerebral hemorrhage
- 国际神经病学神经外科学杂志, 2017, 44(2): 128-131
- Journal of International Neurology and Neurosurgery, 2017, 44(2): 128-131
-
文章历史
收稿日期: 2016-10-28
修回日期: 2017-02-28
自发性脑出血 (intracerebral hemorrhage, ICH) 是由多种原因引起的脑实质内出血,一般发病突然,进展迅速,具有较高的致残率和致死率[1]。目前对于自发性ICH缺乏有价值的评估标准及有效的治疗措施。透明质酸 (hyaluronic acid, HA) 又称玻璃酸,是微管相关蛋白中含量最高的一种,其分布广泛,存在于眼玻璃体、血浆、血管壁等部位,参与细胞有丝分裂、胞内转运及激活内源性免疫等多种生理活动[2]。最新研究表明,HA分解产物可直接作用于多种信号通路,从而激活下游的炎症信号,参与机体炎症反应[3-5]。当中枢神经系统发生损伤时,神经元胞体或轴突内HA释放进入脑脊液,进而进入血液循环,这种异常调控与神经元凋亡有关,因此,外周血中HA的表达升高可能是神经元损伤的标志[4]。我们前期的研究发现在自发性ICH患者外周血的HA的表达发生改变,且其表达水平与患者的预后存在相关关系。因此,我们进行了关于外周血HA浓度与自发性ICH患者90 d预后的试验性研究,报道如下。
1 对象与方法 1.1 研究对象采用前瞻性方法连续收集2012年1月1日至2015年12月31日期间衡水市哈励逊国际医院收治自发性ICH患者284例为研究对象 (脑出血组)。其中有男性患者181例,女性患者103例;年龄为36~80岁,平均年龄 (56.3±14.2) 岁;自发病至接受治疗时间为2.5~24 h,平均治疗时间 (10.3±6.1) h;主要临床表现为突发一侧肢体无力、偏身感觉障碍、口角歪斜及言语不利等典型症状;美国国立卫生研究院卒中量表 (National Institute of Health stroke scale, NIHSS) 评分平均为 (12.5±6.1) 分。另外收集95例年龄和性别相匹配的健康人作为对照组进行对比分析。本研究经衡水市哈励逊国际医院医学伦理委员会批准。
诊断与入选标准:全部患者均符合第四届脑血管病会议修订的《各类脑血管病诊断要点》[6]中关于自发性ICH的诊断标准。① 颅脑CT明确诊断为脑出血,出血量为10~30 ml,未行手术治疗;② 年龄18~80岁;③ 既往无神经系统疾病和脑外伤史;④ 首次发病,且发病时间24 h以内。
排除标准:① 存在严重躯体疾病,如心、肺、肝、肾等重要脏器衰竭;② 既往存在卒中病史、使用凝血或抗凝药物、激素治疗等;③ 患者出血量多,需行手术治疗;④ 存在精神障碍疾病。
1.2 资料收集及分组收集对照组及脑出血组患者入院时的临床特征包括:年龄、性别、体重指数 (body Mass Index, BMI)、既往史、入院时NIHSS评分、血压、血糖、血脂、影像学检查,并采用改良Rankin评分量表 (Modified Rankin Scale,mRS) 评估患者治疗后90 d时的情况。根据治疗后90 d的mRS评分,进一步将患者分为两组:预后良好组 (得分≤2分) 和预后不良组 (得分>2分),同时评估患者入院时的NIHSS评分与HA表达水平的关系。
1.3 血清HA测定对照组及脑出血组患者入院时通过肘静脉取血4 ml,放入无菌试管中,立即离心收集血清。采用双抗体夹心酶联免疫吸附试验,美国Biosciences公司HA ELISA试剂盒测血清中HA相对浓度。按照试剂盒的说明书采用全波长酶标仪检测吸光度。根据标准管浓度及吸光度建立标准曲线,并根据每个孔的吸光度 (OD值),计算透明质酸的浓度。
1.4 统计学分析采用SPSS 17.0统计软件进行数据处理,计量数据描述采用均数±标准差 (x ±s) 表示,计量资料比较采用t检验和方差分析进行数据统计;定性资料采用卡方检验进行数据统计。以P < 0.05为差异具有统计学意义。
2 结果 2.1 基线资料根据患者治疗后90 d的mRS评分将284例患者分为预后良好组和预后不良组。预后良好组211例患者,其中男性143例,女性68例;平均年龄 (56.3±14.2) 岁。73例预后不良,其中男性48例,女性25例;平均年龄 (61.7±9.9) 岁。两组在性别、年龄、BMI、NIHSS评分方面比较上差异无统计学意义 (P>0.05)。两组患者在合并高血压、糖尿病、房颤、高血脂、凝血异常和高同型半胱氨酸 (homocysteine, HCY) 方面资料比较差异无统计学意义 (P>0.05)。
患者临床表现及颅脑CT显示ICH患者血肿的位置分别为:左侧大脑半球95例 (33.5%),右侧大脑半球159例 (56.0%),其他部位30例 (10.6%),两组患者在出血部位方面比较,差异无统计学意义 (P>0.05);血肿的平均体积为 (23.5.0±4.9) cm3,预后良好组血肿体积为 (18.7±4.1) cm3,预后不良组体积为 (25.5±5.2) cm3,两组比较差异具有统计学意义 (P < 0.001)。见表 1。
| 对照组 (n=95) | 脑血出 (n=284) | 出血预后类型 | ||
| 预后良好组 (n=211) | 预后不良组 (n=73) | |||
| 性别 (男/女) | 62/33 | 191/93a | 143/68 | 48/25 |
| 年龄 (岁) | 55.9±12.7 | 56.3±14.2a | 46.3±8.6 | 62.4±10.5 |
| BIM (kg/m2) | 23.6±4.9 | 24.2±4.4a | 23.9±3.9 | 27.8±6.1 |
| 既往史 | ||||
| 高血压[n(%)] | 64 (67.4) | 211 (74.3) | 155 (73.5)b | 56 (76.7) |
| 糖尿病[n(%)] | 29(30.5) | 91 (32.0) | 65 (30.8)b | 26 (35.6) |
| 房颤病史[n(%)] | 24(25.3) | 86 (30.3) | 62 (29.4)b | 22 (30.1) |
| 高血脂[n(%)] | 22(23.2) | 72 (25.4) | 59 (28.0)b | 13 (17.8) |
| 凝血异常[n(%)] | 2(2.1) | 59 (20.8) | 37 (17.5)b | 22 (30.1) |
| 高HCY[n(%)] | 14(14.7) | 76 (26.8) | 52 (24.6)b | 24 (32.9) |
| 影像学资料 | ||||
| 病变位置 | ||||
| 左侧半球 | - | 95 (33.5) | 64 (30.3)b | 31 (42.5) |
| 右侧半球 | - | 159 (56.0) | 118(55.9)b | 41 (56.2) |
| 其他部位 | - | 30 (10.6) | 29 (13.7)b | 1(1.4) |
| 血肿体积 (cm3) | - | 23.5±4.9 | 18.7±4.1c | 25.5±5.2 |
| 注:a为与对照组比较,P>0.05;b为预后不良组比较,P>0.05;c为与预后不良组比较,P < 0.001。 | ||||
对照组95例患者,其中男性62例,女性33例,平均年龄 (55.9±12.7) 岁;脑出血组患者284例患者,其中男性191例,女性93例,平均年龄 (56.3±7.2) 岁,两组基线资料差异无统计学差异 (P>0.05)。对照组的HA水平为 (238.9±27.5) ng/ml,脑出血组患者的HA水平为 (603.8±57.9) ng/ml,脑出血组患者的HA水平明显高于对照组,差异具有统计学意义 (P < 0.05)。
2.3 脑出血患者神经功能评分与HA表达水平的相关关系284例患者入院后给予止血、营养神经、预防血管痉挛及保护胃黏膜等药物治疗。入院后行NIHSS评分显示,预后良好组NIHSS评分为 (10.6±3.5) 分,预后不良组NIHSS评分为 (14.3±4.5) 分,两组比较差异具有统计学意义 (P < 0.05)。入院时的NIHSS评分与HA的表达水平呈正相关关系 (r2=0.372, P < 0.001);治疗90 d,预后良好组mRS评分为 (1.6±0.9) 分,预后不良组NIHSS评分为 (3.9±1.5) 分,两组比较差异具有统计学意义 (P < 0.05)。治疗90 d的mRS评分与HA的表达水平呈正相关关系 (r2=0.456, P < 0.001)。见图 1。
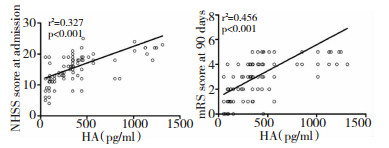
|
| 图 1 脑出血患者入院时NIHSS评分、治疗90 d后评分与HA水平的相关关系 |
两组患者入院时收缩压/舒张压比较,差异无统计学意义 (P>0.05)。两组患者治疗前血清中HA水平进行比较发现,预后不良组HA水平 (796.1±49.6) ng/mL,明显高于预后良好组 (487.2±42.9) ng/ml,差异具有统计学意义 (P < 0.001)。见表 2、图 2。
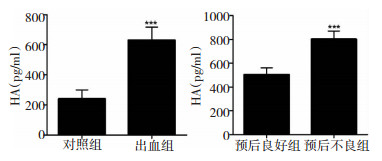
|
| 图 2 健康人群、脑出血及脑出血不同预后组别中血清HA水平 |
| 临床参数 (入院时) |
预后良好组 (n=211) |
预后不良组 (n=73) |
P值 |
| NIHSS评分 | 10.6±3.5 | 14.3±4.5 | 0.041 |
| 收缩压 (mmHg) | 160.3±39.1 | 174.4±21.9 | 0.117 |
| 舒张压 (mmHg) | 106.1±17.5 | 126.1±23.2 | 0.291 |
| 透明质酸 (ng/ml) | 487.2±42.9 | 796.1±59.6 | < 0.001 |
ICH是一种严重危害人们健康的疾病,在我国ICH的发病率约为120~180/10万。与脑缺血相比,脑出血患者的死亡率和生活成本都较高,脑出血后的继发损伤是一个复杂的病理生理过程,其与脑水肿、炎症反应、兴奋性氨基酸毒性、血管活性物质释放和自由基损伤等密切相关。脑出血后多种因素造成血脑屏障 (blood brain barrier, BBB) 破坏、通透性增加,引起细胞外基质 (extracellular matrix, ECM) 释放,进一步加重脑损伤。ECM是存在于器官组织中,由细胞内合成并分泌至细胞外,在组织生成、发育、生长、维持正常功能以及损伤后修复过程中具有重要作用。HA是ECM的重要组成部分,具有维持细胞形状和提供细胞迁移支架的功能。HA发挥何种功能主要取决于它的分子大小,大分子HA在组织结构支撑、抗炎、抑制免疫反应和血管新生等方面发挥重要作用,而小分子HA则具有促进炎症发生、刺激机体免疫和促血管新生的作用。有研究显示在组织损伤等情况下,HA分解,分子量减少,并且其具有很强的保水能力,其表达升高能够进一步加重脑水肿[7, 8]。
既往研究表明,HA表达的水平高低与疾病的严重程度密切相关,在一些疾病如细菌感染、热损伤、类风湿性关节炎和血管炎等疾病中,血清HA水平明显升高,加重炎症反应程度[9, 10]。在神经系统的脑膜中,过度表达的HA可存在于神经细胞及神经胶质间,抑制神经元过度生长或病变时过度激活。HA的受体CD44分子主要表达在脑组织的小胶质细胞、巨噬细胞和血管内皮细胞表面,与炎性因子的释放密切相关[11]。动物研究发现,将细胞内CD44基因敲除后,中性粒细胞从血管内向炎性部位游走的趋化运动明显减弱[12]。脑出血后脑组织的炎性反应迅速且剧烈,CD44主要表达在脑内致炎细胞上的分布特点,说明HA在脑内炎性反应中可能发挥重要作用。本研究发现,第一,急性脑出血患者血清HA水平明显高于对照组;第二,脑出血后血清HA较低的水平往往表明脑出血患者预后较好;第三,HA表达水平的高低与患者发病时的NIHSS评分呈正相关关系,与患者治疗90 d后的mRS评分呈正相关关系。由此可见,HA是一种灵敏度高、特异性强的神经细胞损伤标志物。当发生脑出血时,血清中HA水平明显升高。进一步分析发现HA水平与脑出血的严重程度和预后密切相关。因此,我们可以认为脑出血患者HA水平的检测可作为判断脑损伤严重程度、反映病情变化及预测预后的重要指标之一。
| [1] | 任军伟, 吴惺, 胡锦, 等. 自发性脑出血患者的颅内压、脑灌注压与血压调控研究进展[J]. 国际神经病学神经外科学杂志, 2016, 43(3): 251–254. |
| [2] | Dalmedico MM, Meier MJ, Felix JV, et al. Hyaluronic acid covers in burn treatment:a systematic review[J]. Rev Esc Enferm USP, 2016, 50(3): 522–528. DOI:10.1590/S0080-623420160000400020 |
| [3] | Riehl TE, Santhanam S, Foster L, et al. CD44 and TLR4 mediate hyaluronic acid regulation of Lgr5 + stem cell proliferation, crypt fission, and intestinal growth in postnatal and adult mice[J]. Am J Physiol Gastrointest Liver Physiol, 2015, 309(11): G874–G887. |
| [4] | Agenor A, Dvoracek L, Leu A, et al. Hyaluronic acid/carboxymethyl cellulose directly applied to transected nerve decreases axonal outgrowth[J]. J Biomed Mater Res B Appl Biomater, 2017, 105(3): 568–574. DOI:10.1002/jbm.b.v105.3 |
| [5] | Li Z, Potts-Kant EN, Garantziotis S, et al. Hyaluronan signaling during ozone-induced lung injury requires TLR4, MyD88, and TIRAP[J]. PLoS One, 2011, 6: e27137. DOI:10.1371/journal.pone.0027137 |
| [6] | 中华神经科学会, 中华神经外科学会. 各类脑血管疾病诊断要点[J]. 中华神经科杂志, 1996, 29(6): 379–380. |
| [7] | Osti L, Berardocco M, di Giacomo V, et al. Hyaluronic acid increases tendon derived cell viability and collagen type Ⅰ expression in vitro:Comparative study of four different Hyaluronic acid preparations by molecular weight[J]. BMC Musculoskelet Disord, 2015, 6(16): 284. |
| [8] | Oliviero F, Scanu A, Ramonda R, et al. IL-1? and IL-8 are scavenged by the hexadecylamide derivative of hyaluronic acid:a new mechanism[J]. J Biomed Mater Res A, 2015, 103(9): 2823–2829. DOI:10.1002/jbm.a.v103.9 |
| [9] | Sallisalmi M, Tenhunen J, Kultti A, et al. Plasma hyaluronan and hemorheology in patients with septic shock:a clinical and experimental study[J]. Clin Hemorheol Microcirc, 2014, 56: 133–144. |
| [10] | Alijotas-Reig J. Letter:vasculitis related to non-animal hyaluronic acid skin filler injection[J]. Dermatol Surg, 2010, 36(2): 272–273. DOI:10.1111/j.1524-4725.2009.01416.x |
| [11] | Yamada Y, Hashida M, Harashima H. Hyaluronic acid controls the uptake pathway and intracellular trafficking of an octaarginine-modified gene vector in CD44 positive-and CD44 negative-cells[J]. Biomaterials, 2015, 52: 189–198. DOI:10.1016/j.biomaterials.2015.02.027 |
| [12] | Khan AI, Kerfoot SM, Heit B, et al. Role of CD44 and hyaluronan in neutrophil recruitment[J]. J Immunol, 2004, 173: 7594–7601. DOI:10.4049/jimmunol.173.12.7594 |
 2017, Vol. 44
2017, Vol. 44



