扩展功能
文章信息
- 张艳, 余巨明, 李志民, 王莉
- ZHANG Yan, YU Ju-Ming, Li Zhi-Ming, WANG Li
- 乙酰胆碱特征超低频经颅磁刺激对阿尔茨海默病模型大鼠记忆力的影响
- Effect of acetylcholine characteristic ultra-low frequency transcranial magnetic stimulation on spatial learning and memory function in rats with Alzheimer's disease
- 国际神经病学神经外科学杂志, 2017, 44(2): 118-123
- Journal of International Neurology and Neurosurgery, 2017, 44(2): 118-123
-
文章历史
收稿日期: 2017-01-20
修回日期: 2017-03-13
阿尔茨海默病 (Alzheimer’s disease, AD) 是老年期痴呆最常见类型,以进行性认知功能障碍和行为损害为主要表现。关于AD的发病机制,目前以β-淀粉样蛋白 (β-amyloid, Aβ) 瀑布学说影响较大,该学说认为脑内Aβ沉积是AD发生的起始事件[1]。Aβ是由淀粉样蛋白前体蛋白剪切产生,不溶性Aβ是AD主要致病因素,其中Aβ1-42毒性较强。大鼠脑内注入Aβ1-42导致学习记忆力受损、海马组织脑源性神经营养因子 (brain derived neurotrophic factor, BDNF) 含量减少、胆碱能细胞受损,组织切片发现脑内Aβ沉积及炎性反应[2, 3]。
经颅磁刺激技术 (transcranial magnetic stiumulaion, TMS) 是基于脑电活动的一种神经刺激及神经调节技术。超低频经颅磁刺激 (infro-low frequency transcranial magnetic stiumulation, IF-TMS) 可通过磁场,在脑内产生与某种神经递质慢突触后电位频率相同的感应电流,模拟该种神经递质的慢突触后电位信号,产生该递质生理作用[4]。研究发现,予某一特征IF-TMS治疗,可产生生理状态下该递质的作用,并检测到该递质含量升高[5, 6]。据此,本研究拟用乙酰胆碱特征超低频经颅磁刺激 (acetylcholine characteristic infro-low frequency transcranial magnetic stiumulation, ACh-TMS) 治疗Aβ所致AD大鼠,观察其对大鼠学习记忆力的影响并探索其机制。
1 材料与方法 1.1 实验动物及分组清洁级雄性Sprague-Dawley (SD) 大鼠,10~12周龄,体重 (220±50) g,由川北医学院实验动物中心提供。Morris水迷宫实验粗筛游泳速度一致大鼠 (1.5标准差以内),随机分为正常组 (N组)、模型组 (M组)、假手术组 (P组)、假刺激组 (M+P组)、乙酰胆碱特征超低频磁刺激组 (ACh-TMS组) 和多奈哌齐组 (Donepezil组),每组10只。所有大鼠12 h/12 h明/暗交替环境 (室温 (23±2)℃、湿度50%±10%) 下分笼饲养,自由取食饮水。所有操作符合实验动物伦理学原则。
1.2 主要试剂、仪器及药物盐酸多奈哌齐 (卫材公司,批号:国药准字H20050987);Aβ1-42(美国Sigma公司);大鼠BDNF ELISA试剂盒 (BioTSZ);ACh、AChE、ChAT试剂盒 (南京建成公司);淀粉样物质染液 (北京雷根公司);立体定向仪 (瑞沃德生命科技有限公司);微量进样针 (瑞沃德生命科技有限公司);超低频经颅磁刺激仪 (深圳康立公司);Morris水迷宫及视频分析系统 (北京吉安得尔科技有限公司)。
1.3 模型制作方法参照O’Hare等[7]方法制作聚集态Aβ1-42,终浓度为1 μg/μl,-20℃分装保存。N组大鼠不做处理,余各组10%水合氯醛 (3.5 ml/kg) 腹腔注射 (intraperitoneal injection, i.p.) 麻醉,固定于脑立体定位仪上,常规备皮消毒,头顶正中切口,暴露前囟,参照大鼠脑立体定位图谱,微量进样针双侧海马区 (以前囟点为0,后3.0 mm,旁开2.2 mm,深2.8 mm) 缓慢匀速注射Aβ1-42 5 μl,注射5 min,留针10 min,同样方法P组注射同等剂量生理盐水。注射完毕后缝合头皮,肌注青霉素,连续3 d,预防感染。恢复2周,M组完成Morris水迷宫实验,次日测定海马组织BDNF、ACh含量及AChE、ChAT活性并行脑组织切片刚果红染色。ACh-TMS组予KF10型经颅磁刺激仪模拟ACh特征性磁场刺激 (强度800 Gs),每日1次,每次25 min,每周6 d,持续4周,参照文献[4]。M+P组线圈通电,但不刺激。donepezil组予多奈哌齐 (2.33 mg/kg) 灌胃,每晚1次,连续4周。N组和P组不做处理。各组治疗结束次日起,完成与M组相同实验项目。
1.4 Morris水迷宫Morris水迷宫为直径150 cm、高50 cm圆柱形水池。水池内平均分为Ⅰ、Ⅱ、Ⅲ和Ⅳ四个象限,以每个象限池壁中点为该象限入水点。在第Ⅲ象限正中 (距池壁约为35 cm) 有一直径10 cm,高15 cm圆柱形平台。实验前水中加入墨汁混匀,使平台低于水面1.5 cm,水温维持 (23±2)℃。实验包括定位航向实验 (hidden platform test)、空间探索实验 (probe test) 和可视化平台实验 (visible platform test)。大鼠运动轨迹由置于水池上方红外摄像头捕捉后,经计算机和行为学分析系统进行处理。主要记录各组大鼠逃避潜伏期 (escape latency, EL)、目标象限游泳时间百分比及跨越平台次数,参照文献[8]。
1.5 BDNF、ACh、AChE和ChAT含量测定各组随机选7只大鼠,10%水合氯醛深度麻醉 (i.p. 4 ml/kg),断头取脑,快速冰上取海马组织,过液氮,-80℃保存备用。ELISA法检测BDNF含量,生化比色法检测ACh含量及AChE、ChAT活性。按试剂说明书操作。
1.6 改良Highman刚果红染色各组余大鼠,10%水合氯醛深度麻醉 (i.p. 4 ml/kg),暴露心脏,左室穿刺经主动脉相继灌注生理盐水250 ml和4%多聚甲醛250 ml,取脑,置于新鲜4%多聚甲醛固定。常规脱水、石蜡包埋、切片 (厚5 μm)。参照徐斌等[9]方法染色,光学显微镜下观察淀粉样物质沉积情况。
1.7 统计学分析统计学分析采用SPSS 13.0软件进行分析,计量数据用均数±标准差 (x ±s) 表示。符合方差齐性数据,组间比较用单因素方差分析,若否,则用非参数检验。检验标准以P < 0.05表示差异有统计学意义。
2 结果 2.1 Morris水迷宫随着训练天数增加,各组大鼠EL呈缩短趋势。① 与N组比较,M组和M+P组EL显著延长 (P < 0.05),目标象限游泳时间百分比及跨越平台次数明显下降 (P < 0.05),但N组和P组间及M组和M+P组间以上三项指标差异均无统计学意义 (P>0.05)。与M组和M+P组比较,ACh-TMS组 (训练1~4 d) 和donepezil组 (训练2~5 d) EL明显缩短 (P < 0.05),目标象限游泳时间百分比和跨越平台次数增加 (P < 0.05),但ACh-TMS组与donepezil组间比较差异无统计学意义 (P>0.05)。与N组比较,ACh-TMS组 (除第5天外) 及Donepezil组大鼠EL、目标象限游泳时间百分比和跨越平台次数差异均无统计学意义 (P>0.05)。② 在排除运动及视力对实验结果的影响后,各组大鼠平均游泳速度和可视化平台实验中到达平台所需时间差异无统计学意义 (P>0.05)。见图 1。
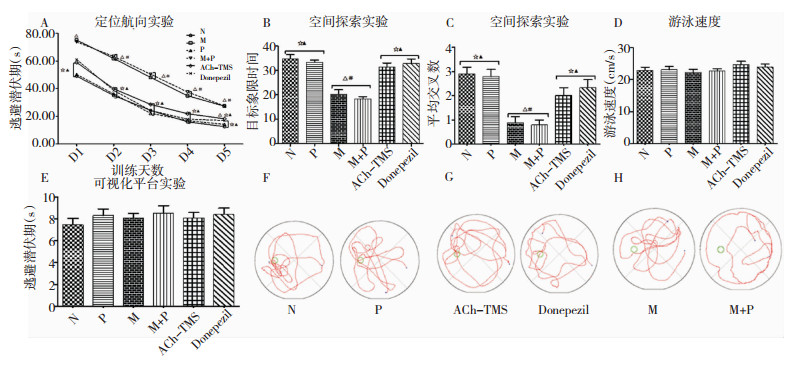
|
| 图 1 各组大鼠Morris水迷宫实验结果 注:A-E分别代表EL (s)、目标象限游泳时间百分比、跨越平台次数、平均游泳速度 (cm/s) 和到达可视平台所需时间 (s);F-H分别代表各组空间探索实验中游泳轨迹。△为与N组比较,P < 0.05;☆为与M组比较,P < 0.05;▲为与M+P组比较,P < 0.05;#为与donepezil组比较,P < 0.05。 |
与N组比较,M组和M+P组ACh含量、ChAT活力明显下降 (P < 0.05);虽然AChE活力下降,但差异无统计学意义 (P>0.05)。ACh-TMS组及Donepezil组AChE活力较N组明显下降 (P < 0.05)。N组和P组间ACh含量及ChAT、AChE活力无明显差异 (P >0.05)。与M+P组比较,ACh-TMS组和donepezil组ACh含量、ChAT活力明显上升 (P < 0.05);donepezil组AChE活力下降 (P < 0.05),ACh-TMS组AChE活力无明显变化 (P>0.05),ACh-TMS组和donepezil组间AChE活力比较差异无统计学意义 (P>0.05)。见表 1。
| 组别 | 例数 (n) |
ACh (μg/mgprot) |
AChE (U/ mgprot) |
ChAT (U/g) |
| N组 | 7 | 67.71±8.20☆▲ | 1.51±0.21☆# | 39.16±4.41☆▲ |
| M组 | 7 | 51.45±5.44△▲# | 1.27±0.25# | 24.84±2.33△▲# |
| P组 | 7 | 65.65±4.70☆▲ | 1.45±0.37☆# | 37.51±2.69☆▲ |
| M+P组 | 7 | 37.00±8.37△☆# | 1.22±0.21# | 17.21±2.91△☆# |
| ACh-TMS组 | 7 | 57.21±8.32☆▲ | 1.06±0.27△ | 32.97±9.03☆▲ |
| donepezil组 | 7 | 62.29±4.63☆▲ | 0.92±0.07△☆▲ | 33.30±9.11☆▲ |
| 注:△为与N组比较,P < 0.05;☆为与M组比较,P < 0.05;▲为与M+P组比较,P < 0.05;#为与donepezil组比较,P < 0.05。 | ||||
与N组比较,M组和M+P组BDNF含量明显减少 (P < 0.05),但N组和P组间比较差异无统计学意义 (P>0.05)。与M组比较,M+P组、ACh-TMS组和Donepezil组BDNF含量显著减少 (P < 0.05)。与M+P组比较,ACh-TMS组BDNF含量明显提高 (P < 0.05),donepezil组无明显变化 (P>0.05)。ACh-TMS组与donepezil组间BDNF含量比较,差异具有统计学意义 (P < 0.05)。见表 2。
| 组别 | 例数 (n) | BDNF (ng/L) |
| N组 | 7 | 207.74±14.44☆▲# |
| M组 | 7 | 185.13±3.70△▲# |
| P组 | 7 | 203.50±8.78☆▲# |
| M+P组 | 7 | 131.82±4.01△☆ |
| ACh-TMS组 | 7 | 151.81±4.52△☆▲# |
| donepezil组 | 7 | 133.77±3.48△☆ |
| 注:△为与N组比较,P < 0.05;☆为与M组比较,P < 0.05;▲为与M+P组比较,P < 0.05;#为与donepezil组比较,P < 0.05。 | ||
如图 2所示,M组 (图 2c) 大鼠海马区可见成片砖红色Aβ沉积,主要集中于齿状回 (dentatus gyrus, DG),沉积物周围细胞带消失、大量胶质细胞浸润、广泛神经元细胞变性,核深染。ACh-TMS组 (图 2d)、donepezil组 (图 2e) 和M+P组 (图 2f) Aβ沉积较M组少,但M+P组Aβ沉积周围胶质细胞浸润明显,DG区细胞带不完整。N组 (图 2a) 和P组 (图 2b) 未见Aβ沉积,DG细胞带完整,但P组可见部分神经元细胞形态不规则,N组神经元细胞形态正常,细胞核淡染。
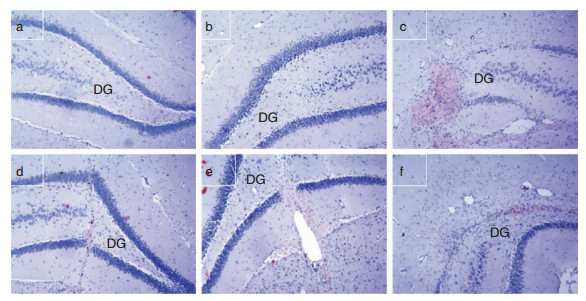
|
| 图 2 大鼠海马组织刚果红染色 (×100) 注:a:N组;b:P组;c:M组;d:ACh-TMS组;e:donepezil组;f:M+P组;DG:齿状回。 |
随着社会老龄化进程,AD发病人数呈增长趋势,给家庭、社会经济及医疗资源带来沉重负担,尤其是中低收入的发展中国家[10]。尽管研究者们从不同角度探索AD的治疗新方案,但仍面临各种困难。目前,临床用于AD治疗的药物主要是胆碱酯酶抑制剂 (cholinesterase inhibitors, ChEIs) 和美金刚,但其费用较昂贵,且随着病程进展,疗效下降[11]。ACh是胆碱能神经元的重要递质,ChEIs通过抑制AChE的活性,提高脑内ACh含量从而改善AD患者认知功能[12]。Aβ主要通过影响ACh的合成和分解以影响中枢胆碱能物质传递[13]。ACh是在胆碱能神经细胞胞浆内,以乙酰辅酶A和胆碱为原料,ChAT催化作用下合成。ACh极易被AChE水解,因此,ACh含量主要取决于ChAT及AChE活性变化[11]。BDNF是中枢神经系统分布最为广泛的神经营养因子,在学习和记忆形成中有重要作用[14]。研究发现,AD患者BDNF及其受体表达下降[3],BDNF可以延迟AD患者及正常老年人认知功能下降时间[15]、保护tau蛋白过度磷酸所致神经元损伤[16]、影响ACh合成和释放[17]。TMS技术作为一种新的技术,逐渐被应用于神经精神性疾病的诊治,如癫痫、帕金森病等[18, 19]。有证据表明,TMS可改善AD患者认知功能[20],但主要集中在高、低频的研究,对IF-TMS的研究较少。国内报道其能改善脑瘫患儿运动功能、抑郁症及睡眠障碍患者临床症状[21-23]。
本研究显示,双侧海马注射Aβ1-42导致大鼠学习记忆力下降,海马组织BDNF、ACh含量和ChAT活性下降。刚果红染色提示,海马DG区Aβ沉积。在未干预情况下,大鼠学习记忆力进行性下降,ACh、ChAT和BDNF含量呈下降趋势,这可能是Aβ对中枢神经系统持续性损害的结果。同时AChE活性也呈下降趋势,其原因可能是,ACh减少后AChE活性也代偿性下降。ACh-TMS和多奈哌齐治疗后,ACh含量较M+P组明显提高,但仍较正常组差,这与之前的研究结果一致[24]。然而,ACh-TMS与多奈哌齐治疗效应存在差异,与M+P组相比,ACh-TMS组AChE活力无明显变化,donepezil组则显著下降,这与多奈哌齐抑制AChE活性有关,而ACh-TMS组较donepezil组对BDNF有显著促表达作用。故我们推测,ACh-TMS对AD模型大鼠学习记忆力的改善作用可能与增强海马BDNF表达、提高ACh含量有关,但并不影响AChE活性。M+P组大鼠学习记忆力呈进行性下降,但病理切片并未发现相应Aβ量的积累,相反,呈减少趋势,这可能与大鼠对Aβ的自身清除作用有关[25]。M组与M+P组海马Aβ沉积部位周围,胶质细胞浸润较其他组明显,这提示,ACh-TMS还可能存在抑制炎症反应的作用。但不足的是,本研究仅对其进行了粗略的观察,并未进行量化。另外,对于大鼠体内Aβ沉积量与时间的关系、磁刺激治疗是否影响Aβ沉积、磁刺激治疗作用持续时间等方面内容也未进行更深的探索。这也是我们该研究以后所要进一步探索的内容。
综上所述,海马注射Aβ1-42可引起大鼠学习记忆力、ACh含量及BDNF表达水平下降。ACh-TMS可在一定程度上改善Aβ所致损害,其机制可能与ACh-TMS提高了中枢胆碱能递质含量、促进BDNF表达、抑制炎症反应等有关。
| [1] | Karran E, Mercken M, De Strooper B. The amyloid cascade hypothesis for Alzheimer's disease:an appraisal for the development of therapeutics[J]. Nat Rev Drug Discov, 2011, 10(9): 698–712. DOI:10.1038/nrd3505 |
| [2] | Christensen R, Marcussen AB, Wortwein G, et al. A beta (1-42) injection causes memory impairment, lowered cortical and serum BDNF levels, and decreased hippocampal 5-HT (2A) levels[J]. Exp Neurol, 2008, 210(1): 164–171. DOI:10.1016/j.expneurol.2007.10.009 |
| [3] | Qin XY, Cao C, Cawley NX, et al. Decreased peripheral brain-derived neurotrophic factor levels in Alzheimer's disease:a meta-analysis study (N=7277)[J]. Mol Psychiatry, 2017, 22(2): 312–320. DOI:10.1038/mp.2016.62 |
| [4] | 徐建兰, 徐晓雪, 蔡青, 等. 连续多次γ-氨基丁酸和多巴胺特征重复超低频经颅磁刺激对大鼠脑内神经递质功率的影响[J]. 中国康复医学杂志, 2010, 25(2): 127–130. |
| [5] | 白延强, 刘月红, 兰景全, 等. 家兔脑室注射乙酰胆碱、去甲肾上腺素的脑波涨落图分析[J]. 航天医学与医学工程, 1995, 8(3): 183–186. |
| [6] | 徐建兰, 蔡青, 徐晓雪, 等. 大鼠脑内多巴胺水平与脑电11mHz超慢波谱系功率的相关性[J]. 中国组织工程研究与临床康复, 2009, 13(13): 2510–2514. DOI:10.3969/j.issn.1673-8225.2009.13.023 |
| [7] | O'Hare E, Weldon DT, Mantyh PW, et al. Delayed behavioral effects following intrahippocampal injection of aggregated A beta (1-42)[J]. Brain Res, 1999, 815(1): 1–10. DOI:10.1016/S0006-8993(98)01002-6 |
| [8] | 原丽, 韩维娜, 李少凤, 等. [Gly14]-humanin拮抗Aβ 31-35引起的大鼠空间学习记忆损伤[J]. 生理学报, 2012, 64(6): 625–632. |
| [9] | 徐斌, 陈俊抛, 辉刘, 等. 两种改进的甲醇刚果红染色[J]. 临床与实验病理学杂志, 2001, 17(2): 174. |
| [10] | Chan KY, Wang W, Wu JJ, et al. Epidemiology of Alzheimer's disease and other forms of dementia in China, 1990-2010:a systematic review and analysis[J]. Lancet, 2013, 381(9882): 2016–2023. DOI:10.1016/S0140-6736(13)60221-4 |
| [11] | Scheltens P, Blennow K, Breteler MM, et al. Alzheimer's disease[J]. Lancet, 2016, 388(10043): 505–517. DOI:10.1016/S0140-6736(15)01124-1 |
| [12] | Ferreira-Vieira TH, Guimaraes IM, Silva FR, et al. Alzheimer's disease:Targeting the Cholinergic System[J]. Curr Neuropharmacol, 2016, 14(1): 101–115. DOI:10.2174/1570159X13666150716165726 |
| [13] | Martorana A, Esposito Z, Di Lorenzo F, et al. Cerebrospinal fluid levels of Abeta42 relationship with cholinergic cortical activity in Alzheimer's disease patients[J]. J Neural Transm (Vienna), 2012, 119(7): 771–778. DOI:10.1007/s00702-012-0780-4 |
| [14] | Diniz BS, Teixeira AL. Brain-derived neurotrophic factor and Alzheimer's disease:physiopathology and beyond[J]. Neuromolecular Med, 2011, 13(4): 217–222. DOI:10.1007/s12017-011-8154-x |
| [15] | Buchman AS, Yu L, Boyle PA, et al. Higher brain BDNF gene expression is associated with slower cognitive decline in older adults[J]. Neurology, 2016, 86(8): 735–741. DOI:10.1212/WNL.0000000000002387 |
| [16] | Jiao SS, Shen LL, Zhu C, et al. Brain-derived neurotrophic factor protects against tau-related neurodegeneration of Alzheimer's disease[J]. Transl Psychiatry, 2016, 6(10): e907. DOI:10.1038/tp.2016.186 |
| [17] | Lapchak PA, Araujo DM, Hefti F. Cholinergic regulation of hippocampal brain-derived neurotrophic factor mRNA expression:evidence from lesion and chronic cholinergic drug treatment studies[J]. Neuroscience, 1993, 52(3): 575–585. DOI:10.1016/0306-4522(93)90407-7 |
| [18] | Lefaucheur JP, Andre-Obadia N, Antal A, et al. Evidence-based guidelines on the therapeutic use of repetitive transcranial magnetic stimulation (rTMS)[J]. Clin Neurophysiol, 2014, 125(11): 2150–2206. DOI:10.1016/j.clinph.2014.05.021 |
| [19] | 罗琴. 重复经颅磁刺激对帕金森病抑郁患者的生活质量及运动症状疗效的影响[J]. 国际神经病学神经外科学杂志, 2015, 42(6): 488–491. |
| [20] | Eliasova I, Anderkova L, Marecek R, et al. Non-invasive brain stimulation of the right inferior frontal gyrus may improve attention in early Alzheimer's disease:a pilot study[J]. J Neurol Sci, 2014, 346(1-2): 318–322. DOI:10.1016/j.jns.2014.08.036 |
| [21] | 邱海南. 超低频经颅磁刺激结合综合康复改善脑瘫患儿粗大运动功能[J]. 神经损伤与功能重建, 2015, 10(4): 364–365. |
| [22] | 孙元锋, 李哲, 李韵, 等. 超低频经颅磁刺激治疗失眠症患者的疗效[J]. 实用医学杂志, 2013, 29(13): 2168–2169. DOI:10.3969/j.issn.1006-5725.2013.13.036 |
| [23] | 张烨, 黄国平, 李跃, 等. 重复超低频经颅磁刺激对首发抑郁症患者的早期疗效及认知功能影响的初步分析[J]. 四川精神卫生, 2013, 26(1): 38–41. |
| [24] | Li Q, Chen M, Liu H, et al. Expression of APP, BACE1, AChE and ChAT in an AD model in rats and the effect of donepezil hydrochloride treatment[J]. Mol Med Rep, 2012, 6(6): 1450–1454. |
| [25] | Braidy N, Poljak A, Jayasena T, et al. Accelerating Alzheimer's research through 'natural' animal models[J]. Curr Opin Psychiatry, 2015, 28(2): 155–164. |
 2017, Vol. 44
2017, Vol. 44




