扩展功能
文章信息
- 蔡旸, 丁晶, 汪昕
- 局灶性脑皮质发育不良的磁共振应用进展
- 国际神经病学神经外科学杂志, 2017, 44(1): 92-96
-
文章历史
收稿日期: 2016-10-09
修回日期: 2017-01-06
局灶性脑皮质发育不良 (focal cortical dysplasia, FCD) 是脑皮质发育不良 (malformations of cortical dysplasia, MCD) 的亚型之一,主要病理学特征为皮质结构排列异常、皮质下白质内灰质异位、灰质神经元簇集丛,异形细胞伴或不伴气球细胞[1]。2011年国际抗癫痫联合会 (ILAE) 将FCD分为3型:Ⅰ型为皮质结构异常;Ⅱ型为皮质结构异常伴异常神经元,根据是否存在气球细胞分为Ⅱa、Ⅱb二型;Ⅲ型为皮质结构异常伴其它可能致痫灶[2]。
FCD见于30%~40%的儿童及20%的成人癫痫患者[3],是目前难治性癫痫常见病因之一。外科手术是FCD合并癫痫的首选治疗方案,Rowland等[4]对37篇文献的meta分析显示,55.8%±16.2%的FCD患者术后均能达到Engel Ⅰ期。不同的FCD分型对外科手术的治疗效果不同,Xue等[3]对105例FCD患者术后1年的随访发现,FCD Ⅱ型 (75%) 和Ⅲ a型 (74%) 患者的术后Engel Ⅰ期比例大于FCD Ⅰ型 (45%)。FCD病灶的准确定位及切除范围直接影响患者的预后[5]。通过磁共振早期发现FCD,评估其可能分型,联合脑电检测,及其他影像学技术如PET、SPECT、fMRI进行术前评估是建立诊疗方案的重要环节[6]。鉴于磁共振是FCD检测的首选影像学方法,本文就磁共振检测FCD的研究进展做一综述。
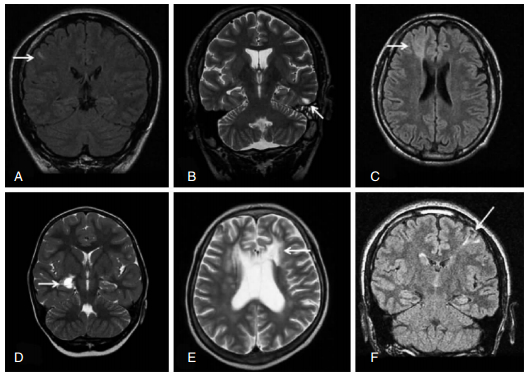
1 局灶性脑皮质发育不良磁共振表现FCD的MRI影像学表现主要为:信号异常 (T2WI、FLAIR序列高信号),局部皮质增厚,灰白质交界处模糊,异常脑回或脑沟,及局灶性脑叶发育不良或萎缩。FCD不同亚型磁共振影像及病理表现参见图 1、表 1。
常规MRI成像对FCD的诊断灵敏度较低[7],近30%的FCD病灶均表现为MRI阴性[8]。此外,由于婴幼儿脑部不完全髓鞘化,灰白质交界模糊及高信号可同样出现在正常人群,进一步增加了婴幼儿FCD的诊断难度[9]。对各年龄段FCD诊断灵敏度的提高还需进一步依赖图像后处理技术及新序列的开发与应用。
| 分型 | 病理学表现 | MRI表现 | |
| FCD Ⅰ型 | Ⅰ a Ⅰ b Ⅰc |
辐射状皮质结构紊乱 水平状皮质结构紊乱 同时包含Ⅰa及Ⅰb型 |
T2WI及FLAIR上呈高信号,T1WI低信号,可伴有轻度的灰白质交界处模糊或异常脑沟回 (尚无MRI特征可区分FCD Ⅰa及Ⅰb型) |
| FCD Ⅱ型 | Ⅱ a Ⅱ b |
皮质结构异常,伴异形神经元 皮质结构异常,伴异形神经元和气球细胞 |
T1WI及T2WI均可表现为皮质增厚,灰白质交界模糊;皮质下白质异常呈T2WI高信号,T1WI低信号 (FCD Ⅱ B特异表现为transmantle征) |
| FCD Ⅲ型 | Ⅲ a | 皮质结构异常,伴海马硬化,合并颞叶皮质异常 | 灰白质信号改变,伴海马体积减小,相应侧脑室及颞角扩大,T2WI及FLAIR序列信号增高 |
| Ⅲ b | 皮质结构异常,伴癫痫发作相关性肿瘤 (如胚胎发育不良性神经上皮瘤、神经胶质瘤) | 灰白质信号改变,伴肿瘤性病灶 (T1WI低信号,T2WI稍高信号,增强扫描可呈轻度强化,可伴钙化、囊性变) | |
| Ⅲ c | 皮质结构异常,伴血管畸形 | 灰白质信号改变,伴等或稍高信号病灶,合并出血呈T1WI、T2WI高信号 | |
| Ⅲ d | 皮质结构异常,伴早期致痫灶 (如外伤、缺血性损伤、脑炎等) | 灰白质信号改变,伴各责任病灶特点不同影像学表现各异 | |
| Ⅲ NOS | 皮质结构异常伴其它相关责任病灶 (Ⅱ型除外) | ||
| mMCD | Ⅰ Ⅱ |
分子层内/近分子层异位神经元 分子层外的异位神经元 |
无特征性MRI表现,待进一步的病理学及高分辨MRI序列诊断 |
基于体素的形态学分析法 (voxel-based morphometry, VBM) 基于体素对核磁共振图像进行形态学分析,通过空间标准化、组织分割、平滑、统计检验等过程,对分割出的脑组织成分进行组间体素比较,以z值反应组间差异,从而量化分析脑形态学上的异常,是目前探测异常信号最常用的后处理方法。
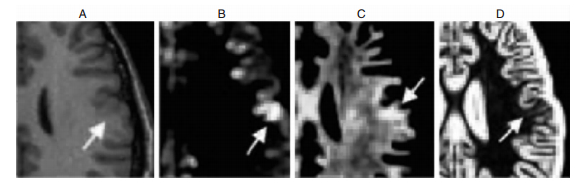
微小病灶在常规MRI多为阴性,该种异常信号经VBM法可显示阳性[7]。Bobiha等[10]示T1WI-VBM分析法对灰质病灶的检出率为63%~86%,T2WI-VBM为87%~100%。2008年Focke等[11]首次对FCD患者FLAIR图像进行VBM处理,得出该法对FCD皮质异常病灶的敏感度大于88%。此外,VBA (voxel-based analysis) 为VBM基础上的扩展,该法通过相应的换算公式进一步得到厚度、密度、梯度参数图,分别表示FCD的三种形态学特征 (图 2),有助于FCD病灶的检测[12]。
基于表面形态学技术 (surface-based morphometry) 通过构建皮质表面,计算皮质厚度、折叠指数 (gyrification index, GI)、曲率、脑沟深度等一系列参数反应皮质形态变化。Freesurfer是最常见的皮质形态分析工具,通过识别并连接白质点,构建白质曲面,获得灰白质交界线,并通过向外扩展法进一步获得灰质表面。
Thesen等[13]通过分析5例FCD患者的皮质厚度、曲率等6项形态学指标,指出皮质厚度异常对FCD的检测率最高,其联合灰白质对比度,对皮质发育不良的检测灵敏度和特异度分别为92%和96%。Cardinale等[14]以FLAIR图像为模板,对5例FCD患者进行Freesurfer分析,示SUPR-FLAIR (surface-projected fluid-attenuation-inversion-recovery) 法可准确识别MRI阴性病灶,且与脑电及术后病理完全相符。
2.3 形态分析程序形态分析程序 (morphometric analysis program, MAP) 法为基于MATLAB和SPM软件的脚本程序,以高分辨率T1WI如MPRAGE序列为图像基础,通过配准、分割、计算机模型分别生成FCD特征性3D图像,包括灰白质特征性的“扩展”图和“连接”图,反应灰白质交界处的模糊程度。
MAP法目前已被用于FCD的术前评估,对致痫灶的定位具有一定的指导意义。如2012年Wang等[15]利用MAP法发现了一例MRI阴性难治性癫痫患者的病灶,经EEG证实后予以手术切除,术后病理为FCD IIB型,且患者术后未再出现过癫痫发作。2015年Wang等[16]对150例MRI阴性术后癫痫患者在大于1年的随访后,回顾性分析术前MRI图像,指出MAP阳性的患者预后最佳,术前完全MAP阴性的患者预后最差,在该队列中,MAP阳性率为43%,其灵敏度和特异度分别达90%和67%。
3 MRI新序列在FCD检测中的应用 3.1 双反转恢复序列双反转恢复序列 (double inversion recovery, DIR) 采用两个反转脉冲序列,分别抑制脑脊液和白质信号,使灰质显示更为清晰,显著提高了不同组织间的信号对比,是一种灰质特异性显示序列。目前该序列已广泛应用于多种疾病的诊断中,如多发性硬化、精神分裂症、AD、癫痫等[17]。
2004年Mahmutyazicioglu等[18]首次将DIR用于对颞叶癫痫病灶的检测,发现DIR可提高颞叶癫痫患者异常病灶的对比度。2005年Rugg-Gunn等[19]对33例常规MRI阴性的部分发作性癫痫患者行DIR-SPM分析,发现15例患者在DIR图像上均显示出异常信号,且其中10例与EEG定位一致。2013年Morimoto等[20]通过比较3D DIR与其它序列在21例颞叶癫痫患者中的影像学表现,显示3D DIR对前颞叶白质异常信号 (anterior temporal lobe white matter abnormal signal, ATLAS) 显示最佳,且ATLAS为预示癫痫侧向性的有效指标。同年该团队对15例颞叶癫痫患者的DIR和FDG-PET图像共分析显示,FDG-PET低代谢区与DIR高信号区具较高一致性,二者联用可提高对颞叶癫痫侧向性判断的准确率[21]。
对皮质的特异性显示使DIR在FCD的检测中具有潜在的应用价值。2016年Lily等[22]回顾性分析16例FCD患者的磁共振图像,发现DIR对FCD的诊断敏感性和特异度均达88%。Granata等[23]对40例皮质发育不良患者的相应病灶做信号密度统计,提出与常规T1、FLAIR序列相比,DIR图像上的病灶对比度最高,尤其对灰白质交界模糊和皮质下白质高信号的显示更佳。Wychowski等[24]对29例难治性癫痫患者的前瞻性研究显示,有3例患者仅于DIR图像上表现为阳性,且其中1例与脑电完全相符,提示DIR阳性病灶具有一定的临床意义。
DIR对非皮质内病灶检出的灵敏度、特异度依然有待进一步研究,如Seewann等[25]提出DIR对灰白质交界处的病灶显示率较高,但对很多微小皮质内及软膜下病灶依然未能清晰显示,其真正灰质内病灶检出率仅为10%。由于扫描时间过长,信噪比较低,脑脊液和血管流动伪影干扰较大[17],DIR图像的诊断特异度往往不高,其临床应用性还需进一步证实。
3.2 超高场MRI目前随着各参数的完善,超高场MRI (如7T MRI) 正逐渐应用于临床。由于对图像信噪比、分辨率及灰白质对比度的显著增加,超高场MRI同样可以提高皮质病灶如FCD的检出[26]。
De Ciantis等[27]对21位3T MRI阴性的难治性癫痫患者行7T GRE及7T FLAIR平扫,6例患者均表现为7T阳性,术后病理均证实为FCD。Zucca等[28]对13例FCD Ⅱ a/b型患者病理组织行7T影像学分析,与病理结果对比后得出,白质纤维丢失及异常细胞增生所致的脱髓鞘化过程是FCD Ⅱb型MRI白质内高信号的主要原因。此外,极高场强在FCD病灶的检测中同样有所应用。Reeves等[29]选取体外FCD病理组织ROI,行9.4T MRI扫描并进行线性分析 (line profile analysis, LPA),指出9.4T MRI联合LPA法可以发现皮质异常排列,有助于对微小皮质发育不良的发现。
然而,磁场不匀性是影响超高场MRI图像质量的重要因素。Seiger等[30]对22例被试3T、7T MPRAGE图像分别行vbm处理,结果示7T-vbm图像对大脑上部皮质显示较好,下部皮质由于在3T-vbm图像上干扰较少反而显示更为清晰。有效的图像后处理可以降低磁场不均对图像质量的影响,如Wang等[7]基于7T MP2RAGE图像做MAP处理,得出与3T图像相比,7T-MAP图像对病灶的显示及边界描绘更为清晰。
4 结论与展望综上,随着影像学的进展如图像后处理及新序列的开发,MRI图像的结构分辨率不断提高,有助于FCD的及时诊断。然而,DIR、7T MRI在FCD病灶检出中的临床可适性及应用性还需更大规模的临床研究与随访。未来,图像后处理技术的完善及与多序列的联合应用,有望进一步提高FCD的检出灵敏度和特异度。
| [1] | Najm IM, Tassi L, Sarnat HB, et al. Epilepsies associated with focal cortical dysplasias (FCDs)[J]. Acta Neuropathol, 2014, 128(1): 5–19. DOI:10.1007/s00401-014-1304-0 |
| [2] | Blumcke I, Spreafico R. An international consensus classification for focal cortical dysplasias[J]. Lancet Neurol, 2011, 10(1): 26–27. DOI:10.1016/S1474-4422(10)70225-8 |
| [3] | Xue H, Cai L, Dong S, et al. Clinical characteristics and post-surgical outcomes of focal cortical dysplasia subtypes[J]. J Clin Neurosci, 2016, 23: 68–72. DOI:10.1016/j.jocn.2015.04.022 |
| [4] | Rowland NC, Englot DJ, Cage TA, et al. A meta-analysis of predictors of seizure freedom in the surgical management of focal cortical dysplasia[J]. J Neurosurg, 2012, 116(5): 1035–1041. DOI:10.3171/2012.1.JNS111105 |
| [5] | Sacino MF, Ho CY, Murnick J, et al. Intraoperative MRI-guided resection of focal cortical dysplasia in pediatric patients:technique and outcomes[J]. J Neurosurg Pediatr, 2016, 17(6): 672–678. DOI:10.3171/2015.10.PEDS15512 |
| [6] | Duncan JS, Winston GP, Koepp MJ, et al. Brain imaging in the assessment for epilepsy surgery[J]. Lancet Neurol, 2016, 15(4): 420–433. DOI:10.1016/S1474-4422(15)00383-X |
| [7] | Wang I, Alexopoulos A. MRI postprocessing in presurgical evaluation[J]. Curr Opin Neurol, 2016, 29(2): 168–174. DOI:10.1097/WCO.0000000000000305 |
| [8] | Bernasconi A, Bernasconi N, Bernhardt BC, et al. Advances in MRI for 'cryptogenic' epilepsies[J]. Nat Rev Neurol, 2011, 7(2): 99–108. DOI:10.1038/nrneurol.2010.199 |
| [9] | Leach JL, Miles L, Henkel DM, et al. Magnetic resonance imaging abnormalities in the resection region correlate with histopathological type, gliosis extent, and postoperative outcome in pediatric cortical dysplasia[J]. J Neurosurg Pediatr, 2014, 14(1): 68–80. DOI:10.3171/2014.3.PEDS13560 |
| [10] | Bonilha L, Montenegro MA, Rorden C, et al. Voxel-based morphometry reveals excess gray matter concentration in patients with focal cortical dysplasia[J]. Epilepsia, 2006, 47(5): 908–915. DOI:10.1111/epi.2006.47.issue-5 |
| [11] | Focke NK, Symms MR, Burdett JL, et al. Voxel-based analysis of whole brain FLAIR at 3T detects focal cortical dysplasia[J]. Epilepsia, 2008, 49(5): 786–793. DOI:10.1111/j.1528-1167.2007.01474.x |
| [12] | Colliot O, Bernasconi N, Khalili N, et al. Individual voxel-based analysis of gray matter in focal cortical dysplasia[J]. Neuroimage, 2006, 29(1): 162–171. DOI:10.1016/j.neuroimage.2005.07.021 |
| [13] | Thesen T, Quinn BT, Carlson C, et al. Detection of epileptogenic cortical malformations with surface-based MRI morphometry[J]. PLoS One, 2011, 6(2): e16430. DOI:10.1371/journal.pone.0016430 |
| [14] | Cardinale F, Francione S, Gennari L, et al. SUrface-PRojected FLuid-Attenuation-Inversion-Recovery Analysis:A Novel Tool for Advanced Imaging of Epilepsy[J]. World Neurosurg, 2016[Epub ahead of print]. |
| [15] | Wang ZI, Jones SE, Ristic AJ, et al. Voxel-based morphometric MRI post-processing in MRI-negative focal cortical dysplasia followed by simultaneously recorded MEG and stereo-EEG[J]. Epilepsy Res, 2012, 100(1-2): 188–193. DOI:10.1016/j.eplepsyres.2012.02.011 |
| [16] | Wang ZI, Jones SE, Jaisani Z, et al. Voxel-based morphometric magnetic resonance imaging (MRI) postprocessing in MRI-negative epilepsies[J]. Ann Neurol, 2015, 77(6): 1060–1075. DOI:10.1002/ana.24407 |
| [17] | Ryan ME. Utility of Double Inversion Recovery Sequences in MRI[J]. Pediatr Neurol Briefs, 2016, 30(4): 26. DOI:10.15844/pedneurbriefs-30-4 |
| [18] | Mahmutyazicioglu K, Ozdemir H, Savranlar A, et al. Double inversion recovery sequence in temporal lobe epilepsy:preliminary results[J]. Tani Girisim Radyol, 2004, 10(3): 182–188. |
| [19] | Rugg-Gunn FJ, Boulby PA, Symms MR, et al. Imaging the neocortex in epilepsy with double inversion recovery imaging[J]. Neuroimage, 2006, 31(1): 39–50. DOI:10.1016/j.neuroimage.2005.11.034 |
| [20] | Morimoto E, Kanagaki M, Okada T, et al. Anterior temporal lobe white matter abnormal signal (ATLAS) as an indicator of seizure focus laterality in temporal lobe epilepsy:comparison of double inversion recovery, FLAIR and T2W MR imaging[J]. Eur Radiol, 2013, 23(1): 3–11. DOI:10.1007/s00330-012-2565-4 |
| [21] | Morimoto E, Okada T, Kanagaki M, et al. Evaluation of focus laterality in temporal lobe epilepsy:a quantitative study comparing double inversion-recovery MR imaging at 3T with FDG-PET[J]. Epilepsia, 2013, 54(12): 2174–2183. DOI:10.1111/epi.12396 |
| [22] | Wong-Kisiel LC, Britton JW, Witte RJ, et al. Double Inversion Recovery Magnetic Resonance Imaging in Identifying Focal Cortical Dysplasia[J]. Pediatr Neurol, 2016, 61: 87–93. DOI:10.1016/j.pediatrneurol.2016.04.013 |
| [23] | Granata F, Morabito R, Mormina E, et al. 3T Double Inversion Recovery Magnetic Resonance Imaging:diagnostic advantages in the evaluation of cortical development anomalies[J]. Eur J Radiol, 2016, 85(5): 906–914. DOI:10.1016/j.ejrad.2016.02.018 |
| [24] | Wychowski T, Hussain A, Tivarus ME, et al. Qualitative analysis of double inversion recovery MRI in drug-resistant epilepsy[J]. Epilepsy Res, 2016, 127: 195–199. DOI:10.1016/j.eplepsyres.2016.09.001 |
| [25] | Seewann A, Kooi EJ, Roosendaal SD, et al. Postmortem verification of MS cortical lesion detection with 3D DIR[J]. Neurology, 2012, 78(5): 302–308. DOI:10.1212/WNL.0b013e31824528a0 |
| [26] | Trattnig S, Springer E, Bogner W, et al. Key clinical benefits of neuroimaging at 7T[J]. Neuroimage, 2016: 1–13. |
| [27] | De Ciantis A, Barkovich AJ, Cosottini M, et al. Ultra-high-field MR imaging in polymicrogyria and epilepsy[J]. AJNR Am J Neuroradiol, 2015, 36(2): 309–316. DOI:10.3174/ajnr.A4116 |
| [28] | Zucca I, Milesi G, Medici V, et al. Type Ⅱ focal cortical dysplasia:Ex vivo 7T magnetic resonance imaging abnormalities and histopathological comparisons[J]. Ann Neurol, 2016, 79(1): 42–58. DOI:10.1002/ana.24541 |
| [29] | Reeves C, Tachrount M, Thomas D, et al. Combined Ex Vivo 9.4T MRI and Quantitative Histopathological Study in Normal and Pathological Neocortical Resections in Focal Epilepsy[J]. Brain Pathol, 2016, 26(3): 319–333. DOI:10.1111/bpa.2016.26.issue-3 |
| [30] | Seiger R, Hahn A, Hummer A, et al. Voxel-based morphometry at ultra-high fields. a comparison of 7T and 3T MRI data[J]. Neuroimage, 2015, 113: 207–216. DOI:10.1016/j.neuroimage.2015.03.019 |
| [31] | Kim DW, Kim S, Park SH, et al. Comparison of MRI features and surgical outcome among the subtypes of focal cortical dysplasia[J]. Seizure, 2012, 21(10): 789–794. DOI:10.1016/j.seizure.2012.09.006 |
 2017, Vol. 44
2017, Vol. 44