扩展功能
文章信息
- 孙勇, 张相彤, 梁洪生
- NLRP3炎性体在脑出血中的研究进展
- 国际神经病学神经外科学杂志, 2017, 44(1): 87-91
-
文章历史
收稿日期: 2016-11-03
修回日期: 2017-01-13
脑出血 (intracerebral hemorrhage,ICH) 是神经外科一种常见疾病,约占所有脑卒中类型的10%~15%,全球每年发病人数超过2亿,其高致残率、致死率给家庭和社会带来沉重负担[1]。当前,脑出血后引起脑损伤的机制仍不完全清楚,临床上缺乏有效的治疗手段。脑出血后引起脑组织损伤的机制包括:血肿占位压迫、兴奋性神经毒性、氧化应激和炎症反应等。很多研究表明,无菌性炎症反应导致的神经元损伤是引起脑出血后继发性损伤的关键因素[2]。脑出血后首先激活固有免疫系统,表现为血肿周围聚集大量的炎症细胞,包括神经系统所固有的小胶质细胞和星形胶质细胞,以及来源于血管渗出的中性粒细胞、巨噬细胞等[3]。浸润的炎症细胞释放大量的炎症因子、自由基和其他有毒性物质进一步加重神经细胞损伤,进而影响脑出血患者的预后[4]。其中,小胶质细胞最早出现在血肿周围,是中枢神经系统重要的免疫细胞,主要参与中枢神经系统的固有免疫反应[5]。
1 NLRP3炎性体概述一般情况下,炎症反应是机体免疫系统为清除有害刺激,并促进组织损伤修复的一种保护性病理生理过程,然而过度的炎症反应对机体会造成损害。在固有免疫系统中,机体主要通过模式识别受体 (pattern recognition receptors,PRR) 识别外源性或内源性刺激,进而启动炎症反应并介导细胞内炎症因子释放。PRR可识别特定的病原相关分子模式 (PAMPs) 或损伤相关分子模式 (DAMPs),根据受体在细胞分布部位不同,PRR可分为两类:一类是位于细胞膜的膜结合受体,如Toll样受体 (Toll like receptors,TLRs);另一类是位于胞浆内的核苷酸结合寡聚化结构域 (NOD) 样受体 (nucleotide-bindingoligomerzation domain like receptors,NLRs)[6]。
NLRs是一种结构上高度保守的胞浆内受体家族,NLRP3是其典型代表,广泛参与宿主抗感染的免疫防御反应及无菌性炎症反应。当外源性或内源性刺激物激活NLRP3后,可通过N端热蛋白结构域 (pyrin domain,PYD) 与衔接蛋白即凋亡相关斑点蛋白 (apoptosis associated speck-like protein,ASC) 结合,衔接蛋白ASC募集效应蛋白半胱氨酸天冬氨酸酶-1前体 (pro-caspase-1),从而形成由NLRP3/ASC/pro-caspase-1组成的复杂蛋白复合物,称为NLRP3炎性体[7]。
NLRP3炎性体在很多疾病发生发展中起着重要作用,如病原体感染、2型糖尿病、动脉粥样硬化性、阿尔兹海默病、脑缺血再灌注损伤等[8]。近几年NLRP3炎性体在脑出血疾病中研究逐渐增多,明确NLRP3炎性体在脑出血后无菌性炎症反应中的具体机制有重要意义,本文就NLRP3炎性体激活机制及其在脑出血疾病中的研究进展作一综述。
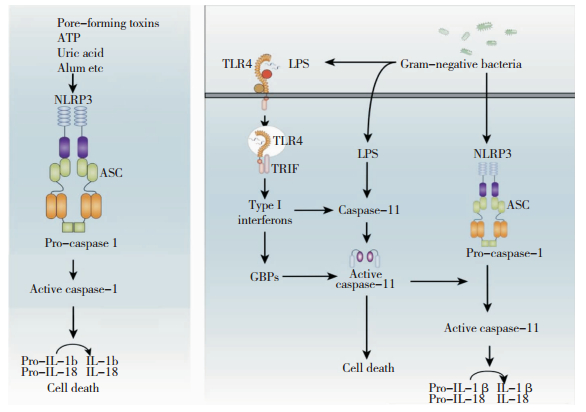
2 NLRP3炎性体活化机制 2.1 NLRP3炎性体活化的经典通路经典途径中,外源性或内源性刺激物作用于NLRP3,促进形成NLRP3炎性体,随后pro-caspase-1被剪切为有活性的半胱氨酸天冬氨酸酶-1(caspase-1),活化的caspase-1剪切IL-1β及IL-18前体,产生成熟的IL-1β及IL-18并分泌到细胞外,进而导致细胞损伤或死亡[9, 10](图 1A)。该途径中,NLRP3可被革兰氏阳性菌 (G+菌)、病毒、孔毒素、晶体物质 (如ATP、二氧化硅、明矾) 等激活。研究者认为这些物质并不能直接作用于NLRP3炎性体,而是通过一种或多种下游细胞生物学事件起激活作用[11]。目前公认的激活NLRP3炎性体机制包括:钾离子外流、线粒体活性氧的作用、溶酶体破裂后组织蛋白酶的释放、线粒体损伤后线粒体DNA或心磷脂的释放、线粒体易位[12, 13]。另外,双链RNA (dsRNA) 激活的蛋白激酶R (PKR)、相关死亡结构域 (Fas Associated Death Domain,FADD) 和caspase-8等,是否与NLRP3炎性体激活有关仍存在争议[14-16]。研究证实,白细胞分化抗原CD36在NLRP3介导的无菌性炎症反应中起一定作用。CD36的可溶性配体,如晶体或者纤维状态的氧化修饰的低密度脂蛋白 (LDL),可促进NLRP3炎性体的激活[17]。此外,NLRP3的去泛素化也是其激活的必备条件[18]。
实验证实,RNA和线粒体DNA也可激活NLRP3[12]。最近一项研究表明,RNA病毒诱导形成丝氨酸/苏氨酸激酶RIP1和RIP3复合体,该复合体启动并激活GTP酶DRP1,使线粒体发生易位,导致线粒体损伤,进而激活NLRP3[19]。近期研究证实,细菌感染后其复制过程中形成的RNA:DNA聚合物是导致NLRP3激活的第三类核酸[15]。在核酸激活NLRP3过程中,其能否直接与NLRP3起作用或通过核酸结合蛋白而发挥功能,目前仍不清楚。
2.2 NLRP3炎性体活化的非经典通路目前发现,细菌脂多糖 (LPS) 可通过非经典途径激活NLRP3炎性体通路,具体机制为:LPS可促进NLRP3炎性体组装,但NLRP3炎性体不能直接活化caspase-1。同时LPS与细胞膜受体TLR4结合,产生Ⅰ型干扰素,后者促进细胞合成caspase-11和鸟苷酸结合蛋白 (GBPs)。LPS进入胞液中直接结合caspase-11导致其活化,且GBPs也可促进caspase-11激活。活化的caspase-11促进NLRP3炎性体剪切pro-caspase-1,进而成熟的caspase-1促进IL-1β/IL-18产生并发挥生物学效应。同时,活化的caspase-11也可直接引起细胞死亡[10, 20](图 1B)。
通常情况下,固有免疫系统需要通过受体识别刺激信号才能导致炎性体装配,然后促进caspases剪切活化。然而,caspase-11的活化能独立地发生在很多已知炎性体中 (包括NLRP3、NLRC4和NLRP6)[21]。研究者认为,caspase-11是胞液内LPS的直接受体,caspase-11结合LPS后自身寡聚化,进而活化发挥生物学功能。虽然人类缺乏caspase-11,但研究发现,人类中的caspase-4和caspase-5类似于caspase-11的作用,可直接结合LPS并触发细胞死亡[20, 21]。和其他caspases不同,caspase-11在稳定的环境中表达量很低,Ⅰ型干扰素可促进caspase-11合成,其介导的STAT1-IRF9活化是上调caspase-11表达的主要机制[20, 22]。此外,Ⅰ型干扰素通过它在GBPs中的作用来活化caspase-11,然而关于GBPs调控caspase-11通路确切机制尚不清楚。虽然caspase-11可调控细胞死亡,但确切机制仍不明了,caspase-11可以与caspase-1相互作用,但是NLRP3-ASC复合体的装配似乎没有caspase-11的参与。非经典通路有深刻的生物学意义,caspase-11缺陷的小鼠可明显地免受内毒素休克致命的影响,然而在全身性感染中caspase-11具有保护作用,可能是源于它诱导细胞死亡能力强于IL-1β和IL-18的释放[20]。这些研究结果表明caspase-11激活的调节异常对机体是有害的。
3 NLRP3炎性体与脑出血关系众多研究表明,脑出血后引起的无菌性炎症反应在继发性脑损伤中起重要作用[2, 23]。到目前为止,研究人员已经证实,在人类和动物脑出血后血肿周围可以检测到大量的炎症因子,如IL-1β、IL-6、TNF-α等,其中IL-1β在众多炎症因子中起着关键的作用,参与细胞的多项功能并促进其他炎症因子的合成与释放[24]。实验证实,在脑出血后血肿周围的小胶质细胞中NLRP3激活并形成NLRP3炎性体,促进caspase-1活化并导致IL-1β/IL-18表达增高,诱发及加剧无菌性炎症反应[25-30]。目前关于NLRP3炎性体在脑出血中的研究,主要是针对NLRP3和caspase-1。
作为一种蛋白质多聚复合物,NLRP3炎性体激活及调控机制在脑出血疾病中尚不清楚。Chen等[25]在Ⅶ型胶原酶诱导SD大鼠脑出血模型中研究发现,血肿周围的小胶质细胞中离子通道受体P2X7(P2X7R)、NLRP3/ASC/caspase-1、IL-1β/IL-18表达增高,当使用小干扰RNA (siRNA) 沉默P2X7R基因后表达量则降低,并能显著减轻脑水肿及改善神经功能缺失。此外,脑出血后使用选择性P2X7R抑制剂治疗,可明显降低NADPH氧化酶2(NOX2)、诱生型一氧化氮合酶 (iNOS)、过氧亚硝基 (ONOO-) 和过氧化物酶 (MPO) 的表达量,能抑制中性粒细胞浸润,同时伴随着NLRP3/ASC/caspase-1和炎性产物IL-1β/IL-18降低,同样可减轻大鼠脑水肿程度并通过抑制神经元凋亡而改善神经功能。使用ONOO-的促分解物FeTPPS时,亦可抑制NLRP3激活,并降低IL-1β/IL-18水平。这些研究结果表明,大鼠脑出血后,P2X7R在激活NLRP3炎性体通路中起重要作用。ONOO-作为P2X7R的下游信号分子在诱发NLRP3炎性体激活过程中可能起关键作用,其可能机制如下:①线粒体被ONOO-氧化损伤后释放线粒体DNA,激活NLRP3炎性体[12];②其硝化作用导致硫氧还原蛋白结合蛋白 (TXNIP) 与硫氧还蛋白分离,TXNIP结合NLRP3后激活其炎性体通路;③ONOO-可能通过增强钾离子外流而激活NLRP3[11]。因此,抑制P2X7R或ONOO-可能成为治疗脑出血后二次脑损伤的靶点。Tang等[26]在注射自体动脉血诱导小鼠脑出血模型中研究发现,NLRP3/caspase-1、IL-1β升高的同时,伴随着线粒体通透性转换孔形成和线粒体活性氧增加。而敲除NLRP3基因可降低过氧化物酶水平,抑制中性粒细胞浸润,减轻脑出血后24h脑水肿程度,改善脑出血后24h、72h的神经功能,同时NLRP3/caspase-1、IL-1β下降。此外,使用阴离子通道 (VDAC) 抑制物 (TRO-19622) 或线粒体活性氧清除剂 (Mito-TEMPO),可通过抑制活性氧 (ROS) 产生而起到同样作用。同时,在幼鼠研究中发现,鱼藤酮可诱导线粒体通透性转换孔形成,促进活性氧生成,导致NLRP3炎性体激活,然而使用TRO-19622或Mito-TEMPO后可抑制此过程。该研究表明,在脑出血中,线粒体活性氧产生可能是激活NLRP3的关键因素。有学者研究发现[27],脑出血后天门冬氨酸受体1(NMDAR1) 增高,而使用天门冬氨酸受体拮抗剂 (MK801) 可以抑制脑出血后NLRP3表达,说明NMDAR1可能在NLRP3炎性体激活通路中起一定的协同作用,其有待进一步研究。
调控基因表达的微小RNA (microRNA) 是研究最多的非编码RNA,其通过调节转录后水平在多种病理生理过程中发挥重要作用[31]。Yuan等[28]在C57BL/6小鼠脑出血模型中发现,microRNA-223(miR-223) 可以调控NLRP3表达并影响炎症反应。研究表明,NLRP3的mRNA3′端非编码固定区域存在miR-223可结合位点,并且miR-223可直接通过该区域来调控NLRP3的表达。其研究结果指出,脑出血后小胶质细胞激活,miR-223可下调小胶质细胞中NLRP3的表达,减少caspase-1、IL-1β、IL-6和TNF-α的产生,从而抑制炎症反应和神经损伤,减轻脑水肿及改善神经功能。该研究提示,miR-223可通过抑制NLRP3炎性体激活而减轻炎症损害,但是否还存在其他机制尚不清楚。Yang等[29]研究发现,在体外,使用重组腺病毒编码的NLRP3干扰RNA (NLRP3 RNAi) 可抑制小胶质细胞引起的炎症反应 (IL-1β、IL-6、TNF-α分泌减少),并且能增加神经元活性、减少神经元凋亡。体内干预实验中,在脑出血后48h血肿周围脑组织中也得到了同样结果 (NLRP3、IL-1β、IL-6、TNF-α表达量降低),并显著减轻脑水肿和改善神经功能。
Caspase-1作为NLRP3炎性体的效应分子,在该炎性体通路介导的炎症反应中发挥着重要作用。有学者[30]在诱导CD-1成年雄性小鼠脑出血前20min,通过侧脑室微量注射选择性caspase-1抑制剂Ac-YVAD-CMK,发现Ac-YVAD-CMK治疗组能显著地减轻脑水肿并改善神经系统功能。其神经保护作用可能与下调IL-1β、磷酸化JNK激酶、基质金属蛋白酶-9(MMP-9) 以及抑制紧密连接蛋白ZO-1的降解有关。结果表明Ac-YVAD-CMK可通过抑制caspase-1活化,减轻炎症导致的血脑屏障损害,从而减轻脑组织损伤,其具体机制有待进一步阐明。
4 总结及展望脑出血是一种常见急症,过度的无菌性炎症反应是引起脑出血继发性损害的主要因素,而NLRP3炎性体在无菌性炎症反应中起重要作用。尽管对NLRP3炎性体研究较多,但其在脑出血疾病中具体机制尚未阐明。P2X7R的活化可能仅为NLRP3炎性体激活的众多机制之一。微小RNA (miR-223) 是否可以通过其他分子,对NLRP3炎性体产生进一步影响尚不清楚。除NLRP3炎性体通路外,miR-223也可能通过其他途径对脑出血后炎症反应起调控作用。尽管Ac-YVAD-CMK为caspase-1选择性抑制剂,但也对其他caspase蛋白起一定作用。对于阻断NLRP3炎性体通路而减轻炎症反应,是否影响坏死组织清除或降低免疫力,有待更长期的实验观察。同时,在胶原酶诱导的脑出血模型中,其本身所引起的炎症反应无法避免。我们推测,适度控制炎症反应能减轻脑出血后继发性损伤并改善预后,过度的抑制炎症反应可能会影响坏死组织清除或增加感染的可能。在脑出血疾病中,针对NLRP3炎性体不同靶点的研究有待完善及进一步验证,为临床治疗提供理论依据。
| [1] | Al-khaled M, Eggers J. Prognosis of intracerebral hemorrhage after conservative treatment[J]. J Stroke Cerebrovasc Dis, 2014, 23(2): 230–234. DOI:10.1016/j.jstrokecerebrovasdis.2012.12.018 |
| [2] | Zhou Y, Wang Y, Wang J, et al. Inflammation in intracerebral hemorrhage:from mechanisms to clinical translation[J]. Prog Neurobiol, 2014, 115: 25–44. DOI:10.1016/j.pneurobio.2013.11.003 |
| [3] | Ransohoff, R M, Brown, M A. Innate immunity in the central nervous system[J]. J Clin Invest, 2012, 122(4): 1164–1171. DOI:10.1172/JCI58644 |
| [4] | Yang Z, Liu B, Zhong L, et al. Toll-like receptor-4-mediated autophagy contributes to microglial activation and inflammatory injury in mouse models of intracerebral haemorrhage[J]. Neuropathol Appl Neurobiol, 2015, 41(4): e95–106. DOI:10.1111/nan.12177 |
| [5] | Walsh JG, Muruve DA, Power C. Inflammasomes in the CNS[J]. Nat Rev Neurosci, 2014, 15(2): 84–97. DOI:10.1038/nrn3638 |
| [6] | Strowig T, Henao-Mejia J, Elinav E, et al. Inflammasomes in health and disease[J]. Nature, 2012, 481(7381): 278–286. DOI:10.1038/nature10759 |
| [7] | Schroder K, Tschopp J. The inflammasomes[J]. Cell, 2010, 140: 821–832. DOI:10.1016/j.cell.2010.01.040 |
| [8] | Kastbom A, Ärlestig L, Rantapää-Dahlqvist S. Genetic variants of the NLRP3 inflammasome are associated with stroke in patients with rheumatoid arthritis[J]. J Rheumatol, 2015, 42(10): 1740–1745. DOI:10.3899/jrheum.141529 |
| [9] | Rathinam VA, Vanaja SK, Fitzgerald KA. Regulation of inflammasome signaling[J]. Nat Immunol, 2012, 13(4): 333–342. DOI:10.1038/ni.2237 |
| [10] | Vanaja SK, Rathinam VA, Fitzgerald KA. Mechanisms of inflammasome activation:recent advances and novel insights[J]. Trends Cell Biol, 2015, 25(5): 308–315. DOI:10.1016/j.tcb.2014.12.009 |
| [11] | Lamkanfi M, Dixit VM. Mechanisms and functions of inflammasomes[J]. Cell, 2014, 157(5): 1013–1022. DOI:10.1016/j.cell.2014.04.007 |
| [12] | Shimada K, Crother TR, Karlin J, et al. Oxidized mitochondrial DNA activates the NLRP3 inflammasome during apoptosis[J]. Immunity, 2012, 36(3): 401–414. DOI:10.1016/j.immuni.2012.01.009 |
| [13] | Ermler ME, Traylor Z, Patel K, et al. Rift Valley fever virus infection induces activation of the NLRP3 inflammasome[J]. Virology, 2014, 449: 174–180. DOI:10.1016/j.virol.2013.11.015 |
| [14] | He Y, Franchi L, Núñez G. The protein kinase PKR is critical for LPS-induced iNOS production but dispensable for inflammasome activation in macrophages[J]. Eur J Immunol, 2013, 43(5): 1147–1152. DOI:10.1002/eji.201243187 |
| [15] | Kailasan Vanaja S, Rathinam VA, Atianand MK, et al. Bacterial RNA:DNA hybrids are activators of the NLRP3 inflammasome[J]. Proc Natl Acad Sci USA, 2014, 111(21): 7765–7770. DOI:10.1073/pnas.1400075111 |
| [16] | Gurung P, Anand PK, Malireddi RK, et al. FADD and caspase-8 mediate priming and activation of the canonical and noncanonical Nlrp3 inflammasomes[J]. J Immunol, 2014, 192(4): 1835–1846. DOI:10.4049/jimmunol.1302839 |
| [17] | Sheedy FJ, Grebe A, Rayner KJ, et al. CD36 coordinates NLRP3 inflammasome activation by facilitating intracellular nucleation of soluble ligands into particulate ligands in sterile inflammation[J]. Nat Immunol, 2013, 14(8): 812–820. DOI:10.1038/ni.2639 |
| [18] | Py BF, Kim MS, Vakifahmetoglu-Norberg H, et al. Deubiquitination of NLRP3 by BRCC3 critically regulates inflammasome activity[J]. Mol Cell, 2013, 49(2): 331–338. DOI:10.1016/j.molcel.2012.11.009 |
| [19] | Wang X, Jiang W, Yan Y, et al. RNA viruses promote activation of the NLRP3 inflammasome through a RIP1-RIP3-DRP1 signaling pathway[J]. Nat Immunol, 2014, 15(12): 1126–1133. DOI:10.1038/ni.3015 |
| [20] | Aachoui Y, Leaf IA, Hagar JA, et al. Caspase-11 protects against bacteria that escape the vacuole[J]. Science, 2013, 339(6122): 975–978. DOI:10.1126/science.1230751 |
| [21] | Kayagaki N, Wong MT, Stowe IB, et al. Noncanonical inflammasome activation by intracellular LPS independent of TLR4[J]. Science, 2013, 341(6151): 1246–1249. DOI:10.1126/science.1240248 |
| [22] | Casson CN, Copenhaver AM, Zwack EE, et al. Caspase-11 activation in response to bacterial secretion systems that access the host cytosol[J]. PLoS Pathog, 2013, 9(6): e1003400. DOI:10.1371/journal.ppat.1003400 |
| [23] | Wang J. Preclinical and clinical research on inflammation after intracerebral hemorrhage[J]. Prog Neurobiol, 2010, 92(4): 463–477. DOI:10.1016/j.pneurobio.2010.08.001 |
| [24] | Patterson SL. Immune dysregulation and cognitive vulnerability in the aging brain:Interactions of microglia, IL-1β, BDNF and synaptic plasticity[J]. Neuropharmacology, 2015, 96(PtA): 11–18. |
| [25] | Feng L, Chen Y, Ding R, et al. P2X7R blockade prevents NLRP3 inflammasome activation and brain injury in a rat model of intracerebral hemorrhage:involvement of peroxynitrite[J]. J Neuroinflammation, 2015, 12: 190. DOI:10.1186/s12974-015-0409-2 |
| [26] | Tang J, Chen S, Hu Q, et al. NLRP3 Inflammasome Contributes to Inflammation after Intracerebral Hemorrhage[J]. Ann Neurol, 2014, 75(2): 209–219. DOI:10.1002/ana.24070 |
| [27] | Weng X, Tan Y, Chu X, et al. N-methyl-D-aspartic acid receptor 1(NMDAR1) aggravates secondary inflammatory damage induced by hemin-NLRP3 pathway after intracerebral hemorrhage[J]. Chin J Traumatol, 2015, 18(5): 254–258. DOI:10.1016/j.cjtee.2015.11.010 |
| [28] | Yuan B, Zhong L, Xian R, et al. MicroRNA-223 regulates inflammation and brain injury via feedback to NLRP3 inflammasome after intracerebral hemorrhage[J]. Mol Immunol, 2015, 65(2): 267–276. DOI:10.1016/j.molimm.2014.12.018 |
| [29] | Su T, Zhong S, Yang Z, et al. Recombinant adenovirus encoding NLRP3 RNAi attenuate inflammation and brain injury after intracerebral hemorrhage[J]. J Neuroimmunol, 2015, 287: 71–75. DOI:10.1016/j.jneuroim.2015.08.002 |
| [30] | Sozen T, Cheng O, Tang J, et al. Ac-YVAD-CMK Decreases Blood-Brain Barrier Degradation by Inhibiting Caspase-1 Activation of Interleukin-1β in Intracerebral Hemorrhage Mouse Model[J]. Transl Stroke Res, 2010, 1(1): 57–64. DOI:10.1007/s12975-009-0002-z |
| [31] | Cabarcas SM, Thomas S, Zhang X, et al. The role of upregulated miRNAs and the identification of novel mRNA targets in prostatospheres[J]. Genomics, 2012, 99(2): 108–117. DOI:10.1016/j.ygeno.2011.11.007 |
 2017, Vol. 44
2017, Vol. 44



 ,
,