扩展功能
文章信息
- 邓娜, 周瑾瑕, 廖迪, 廖巧, 毕方方
- DENG Na, ZHOU Jin-Xia, LIAO Di, LIAO Qiao, BI Fang-Fang
- 铜/锌超氧化物岐化物1突变致肌萎缩侧索硬化一家系分析并文献复习
- An analysis of a family with amyotrophic lateral sclerosis caused by Cu/Zn superoxide dismutase 1 mutation and a literature review
- 国际神经病学神经外科学杂志, 2017, 44(1): 49-53
- Journal of International Neurology and Neurosurgery, 2017, 44(1): 49-53
-
文章历史
收稿日期: 2016-11-16
修回日期: 2017-01-08
肌萎缩侧索硬化 (amyotrophic lateral sclerosis, ALS) 是一种成人起病的以上下运动神经元同时受损为特征的神经系统退行性疾病。大部分患者以肢体症状起病,约20%的患者以延髓症状起病。多数患者于发病后的3~5年内死于呼吸衰竭[1]。5%~10%的ALS患者具有家族遗传史,被称为家族性ALS (familial ALS, fALS),其余约90%~95%的患者为散发性ALS (sporadic ALS, sALS)。fALS可为常染色体显性遗传或隐性遗传。当fALS患者为常染色体显性遗传而外显率较低时,可能被误诊为sALS[2]。铜/锌超氧化物岐化物 (superoxide dismutase, SOD1) 是最早发现的ALS致病基因[3]。研究表明,约20%的fALS患者可检测到SOD1突变。在过去的数十年内,国内关于SOD1基因突变的报道较少[4, 5]。近年来随着二代测序的飞速发展,国内关于ALS患者SOD1突变的报道较前明显增加。本研究报道一个SOD1基因D102G突变ALS家系,并复习国内SOD1基因突变型ALS相关文献。
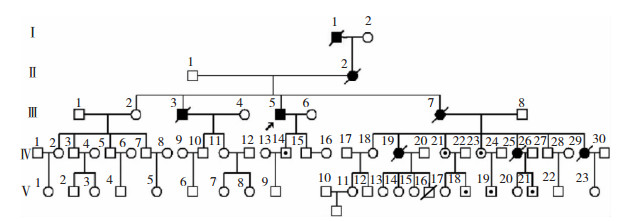
1 对象和方法 1.1 对象研究对象为来自黑龙江齐齐哈尔市的一家系 (图 1),根据国际EI Escrial ALS诊断标准该家族部分成员符合的ALS诊断。
1.2 基因检测向患者家属交代基因检测的必要性及意义并签署知情同意书,使用EDTA抗凝管抽取外周血5 ml并提取DNA (Ⅲ5,Ⅳ10,Ⅳ11,Ⅳ14,Ⅳ15,Ⅳ18,Ⅳ21,Ⅳ23,Ⅳ28,Ⅴ6,Ⅴ7,Ⅴ14,Ⅴ16,Ⅴ18,Ⅴ19,Ⅴ20,Ⅴ21,Ⅴ22)。DNA标本送公司进行ALS常见致病基因 (SOD1、TARBP、FUS、C90RF72、OPTN、VCP和UBQLN2D) 检测。
1.3 文献分析使用知网 (CNKI) 和pubmed检索2005年~2016年我国报道的SOD1基因突变相关文献,并进行文献复习。总结国内SOD1基因突变的类型,临床表现和外显率等特点。
2 结果 2.1 临床资料先证者Ⅲ5(图 1),62岁,男性,因“进行性四肢乏力6月”入院。患者6月前出现右上肢近端无力,逐渐向远端发展,随后累及右下肢和左侧肢体。入院查体:颅神经 (-),右上肢近端肌力3-级,远端肌力3级,右下肢肌力3级,左上肢近端肌力4-级,远端肌力4级,左下肢近端肌力4-级,远端肌力4级。大小鱼际肌、肱二头肌及股四头肌萎缩,四肢腱反射活跃,双侧霍夫曼征及病理征阳性,感觉正常。
|
| 图 1 ALS患者家系图 注:方框代表男性,圆圈代表女性。左下角箭头表示为先证者;斜线代表已去世;黑色全部填充代表患病者;方框或圆圈中一点代表突变基因携带者。 |
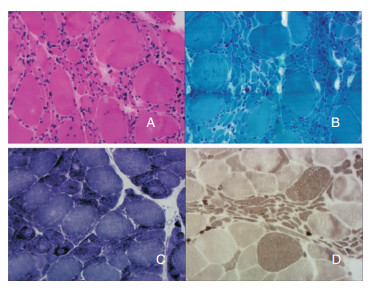
肌电图示广泛神经源性损害。肌活检可见散在小角化纤维、核聚集和小群萎缩,提示神经源性损害 (图 2)。
|
| 图 2 先证者Ⅲ5肌活检所见 (×100倍) 注:A:ATP;B:GMT;C:NADH;D:ATP11.1。A、B、C和D染色上均可见三角形的小角化纤维、核聚集和群萎缩。NADH染色可见靶状纤维;ATP11.1示群萎缩以Ⅱ型纤维为主。 |
予以对症治疗后患者病情逐渐加重,起病7月后出现饮水呛咳、吞咽困难,8月后因呼吸衰竭死亡。
该家系平均起病年龄为 (37.8±11.6) 岁 (30~62岁);平均病程为1.3年,病程最短者8个月,最长者2年。患者临床表现类似,均以一侧肢体起病,逐渐累及对侧,死于呼吸衰竭 (表 1)。其中Ⅴ16患Down’s综合征,死于营养不良。
| 编号 | 性别 | 起病年龄 (岁) | 死亡年龄 (岁) | 病程 (年) | 起病部位 | 共患病 |
| Ⅰ1 | 男 | 28 | 30 | 2 | 左上肢 | 无 |
| Ⅱ2 | 女 | 31 | 32 | 1 | 左上肢 | 无 |
| Ⅲ3 | 男 | 39 | 41 | 2 | 右上肢 | 无 |
| Ⅲ5 | 男 | 62 | 62 | 0.7 | 右上肢 | 无 |
| Ⅲ7 | 女 | 46 | 47 | 1 | 右上肢 | 无 |
| Ⅳ19 | 女 | 37 | 38 | 1 | 左上肢 | 无 |
| Ⅳ25 | 女 | 31 | 32 | 1.5 | 左上肢 | 无 |
| Ⅳ29 | 女 | 28 | 30 | 1.5 | 右上肢 | 无 |
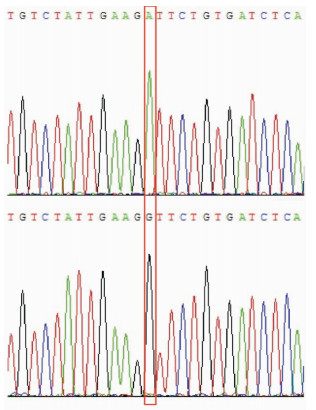
DNA测序结果显示家族成员Ⅲ5、Ⅳ14、Ⅳ21、Ⅳ23、Ⅴ16、Ⅴ18、Ⅴ19及Ⅴ21的SOD1基因序列4号外显子第305位点由A突变成G,致102号的氨基酸由天冬氨酸转换为甘氨酸,即D102G为杂合突变 (测序图谱见图 3),而TARBP、FUS、C90RF72、OPTN、VCP和UBQLN2D基因测序未发现突变。
|
| 图 3 测序图谱 注:上图为健康对照者SOD1基因序列4号外显子305位点为A;下图为ALS患者305位点上为G。 |
目前我国报道的ALS患者SOD1基因突变共26种,其中错义突变23种,插入突变2种,无义突变1种 (表 2)。SOD1突变型ALS年龄最大者为67岁,最年轻者仅为20岁。病程最短者仅1月,最长者达14年。1例 (4.5%) 患者以延髓症状起病,2例 (9.1%) 以肢体和延髓症状同时起病,19例 (86.4%) 以肢体症状起病 (4例因具体临床资料未给出除外)。患者可表现为完全外显或不完全外显。
| 突变位点 | 平均起病年龄 (岁) | 平均病程 (年) | 外显率 | 中国最先报道 | 起病部位 |
| S105L | 52 | 2.9 | 不完全外显 | 否 | 肢体 |
| Cys146X | 35.3 | 2.1 | 完全外显 | 是 | 肢体 |
| S134T | 47 | - | 不完全外显 | 否 | 肢体 |
| N132Qfs*5 | 34 | 2 | 外显 | 是 | 肢体 |
| Cys111Tyr | 约50 | 约4 | 外显 | 否 | 肢体 |
| Gly147Asp | 34 | 12 | 外显 | 否 | 肢体+延髓 |
| C7W | 67 | 1.92 | 外显 | 是 | 肢体 |
| C6F | 50.6 | 约1 | 外显 | 否 | 肢体 |
| L84F | 45 | 4.3 | 外显 | 否 | 肢体 |
| H46R | 42.7 | - | 外显 | 否 | 肢体 |
| G72C | 20 | 约2 | 不完全外显 | 否 | 肢体 |
| E133Ⅴ | 48.7 | 4 | 不完全外显 | 是 | 肢体 |
| Ⅰ149T | 39.7 | 1 | 不完全外显 | 否 | 肢体+延髓 |
| Val29insA | 30.3 | 12.2 | 不完全外显 | 是 | 肢体 |
| F21C | 63.5 | 2.5 | 不完全外显 | 否 | 肢体 |
| G148D | 45.5 | 3 | 外显 | 否 | 肢体 |
| C147R | ? | 3-4 | 外显 | 否 | 肢体 |
| T137R | 42.5 | 1.2 | 不完全外显 | 是 | 延髓 |
| G138E | 41 | 1.5 | 外显 | 是 | 肢体 |
| G85R | - | - | 外显 | 否 | 肢体 |
| L8Ⅴ | - | - | - | 否 | - |
| G10A | - | - | - | 否 | 肢体 |
| G16S | - | - | - | 否 | - |
| G37R | - | - | - | 否 | - |
| D83N | - | - | - | 否 | 肢体 |
| L106F | - | - | - | 否 | - |
SOD1位于21号染色体长臂2区2带 (21q22.11),含有5个外显子,全长约11Kb,其编码的SOD1蛋白含153个氨基酸[6]。生理状况下,SOD1可拮抗超氧阴离子的毒性作用,保护细胞免受自由基的损害,而突变型SOD1不仅失去这一保护作用还可对神经细胞产生毒性作用从而导致疾病的发生[7]。SOD1是最早发现的与ALS相关的基因,国外研究表明约20%的fALS患者及1%~3%的sALS与SOD1基因突变有关[8]。目前已报道约160种SOD1错义突变和12种SOD1截断突变 (位移突变和无义突变) 可导致ALS的发生[3]。近年来随着测序技术的飞速发展,国内ALS患者SOD1基因突变的研究较前明显增多。本研究首次验证了国内SOD1基因D102G突变,扩大了我国ALS患者的SOD1基因突变谱。
SOD1基因D102G突变最早是由De Belleroche于1995年报道[9]。该突变致第102号密码子编码的极性、带负电荷的酸性天冬氨酸转换为极性、不带电荷的中性甘氨酸。D102G突变不仅造成负电荷的减少,还可改变SOD1蛋白的空间结构,导致蛋白质的错误折叠和聚集,从而对神经细胞产生毒性作用[10]。既往文献报道,D102G突变的ALS患者病程进展较快,平均生存期仅2.4年 (ALS平均生存期3~5年)[10]。本研究家系中ALS患者均以肢体受累起病,最后累及延髓,患者的临床表现类似,年龄跨度较大,平均发病年龄为 (37.8±11.6) 岁 (30~62岁),平均病程为1.3年,较文献报道明显缩短,这与地域差异和接受治疗的时间相关。此外,102位的天冬氨酸还可突变为天冬酰胺,酪氨酸和组氨酸,其中研究较多的是天冬酰胺[11]。该家系中Ⅴ16为Down’s综合征患者。既往有文献报道,ALS合并Down’s综合征的患者发病较其上一代明显提前[12]。Down’s综合征合并ALS患者由于有3条21号染色体,其SOD1的表达更趋向于正常,但其发病年龄较上一代提前[13]这也证实了ALS患者SOD1突变不仅可通过下调酶的活性,还可以通过产生毒性作用导致疾病的发生。虽然此前国际上有过D102G突变的报道,但是均缺乏详细的临床资料。该家系为第一例临床资料详细的D102G突变型ALS,且该突变为国内首次报道,拓展了中国ALS患者SOD1基因突变谱,为更深入的了解D102G突变提供了客观依据。
近年来,关于ALS患者SOD1基因的研究越来越深入。目前已发现26种SOD1突变基因 (包含错义突变23种,插入突变2种,无义突变1种) 与ALS的发病有关,其中7种为首次报道[5, 14-24]。40SOD1致ALS发病年龄最年轻者仅20岁,发病年龄最大者为67岁。我国ALS患者多以肢体症状起病 (86.4%),约4.5%的患者以延髓症状起病,上述临床表现与其他基因突变所致ALS相似,其中以延髓症状起病者中位生存期约1.2年,较文献报道的2年中位生存期短,这可能与病例数较少,接受治疗情况,突变类型及地域差异等因素有关,2例 (9.1%) 以延髓症状和肢体症状同时起病,病程跨度较大 (1~12年)。比较不同SOD1基因突变位点患者,发现其起病年龄,临床表现和外显率等均可存在一定的差异,如C7W突变发病年龄较晚为67岁,病程约1.92年,而Val29insA突变患者起病年龄较早约30.3岁,病程较长约12.2年[18, 21]。不同突变位点,患者临床表现可不相同,即使同一位点突变,患者临床表现也可以存在一定的异质性。以Ⅰ149T为例,同一家系中患者的病情进展不同,最快者仅1月,最慢者可达14年[20]。外显率是指某一基因型 (通常在杂合子状态下) 表现出相应表型的百分率。外显率为100%时被称为完全外显,而其低于100%时则为不完全外显。部分SOD1基因,如H46R/L84F和Cys146X等为完全外显,而S105L、S134T/G72CHE E133V等为不完全外显。ALS多为散发性,仅5%~10%的患者有家族遗传史为fALS。当fALS基因不完全外显率时可被误诊为sALS。既往认为S134T突变为sALS,国内的一项研究表明对S134T突变的家属行SOD1基因检测发现其下一代为S134T基因突变携带者[16]。因此,许多临床上诊断的sALS可能是由于突变基因的外显率较低,而非真正意义上的sALS。对ALS患者及其亲属行基因检查有利于发现突变的基因。总之,ALS患者SOD1基因突变位点不同,患者临床表现可存在一定的差异,即使同一位点的突变,临床表现亦可不同,因此对ALS患者进行基因检测有利于ALS的早期诊断。
随着精准医学这个概念的逐渐深入及测序技术的普及,ALS患者基因检测日益成熟,各种新发和已知突变的报道越来越多,为国内外ALS基因研究提供了方向。我们应建议ALS患者及其直系亲属行基因检测,为患者的病情进展、预后评估及亲属是否会患病提供有利的指导;分析不同基因突变的临床特征,以利于针对性的个体化治疗。同时针对新发的SOD1基因突变,进行功能研究,更深入的了解ALS的发病机制,为治疗提供靶点。
| [1] | Swinnen B, Robberecht W. The phenotypic variability of amyotrophic lateral sclerosis[J]. Nat Rev Neurol, 2014, 10(11): 661–670. DOI:10.1038/nrneurol.2014.184 |
| [2] | Vucic S, Rothstein JD, Kiernan MC. Advances in treating amyotrophic lateral sclerosis:insights from pathophysiological studies[J]. Trends Neurosci, 2014, 37(8): 433–442. DOI:10.1016/j.tins.2014.05.006 |
| [3] | Radunovic A, Leigh PN. ALSO Database:database of SOD1(and other) gene mutations in ALS on the Internet. European FALS Group and ALSOD Consortium[J]. Amyotroph Lateral Scler Other Motor Neuron Disord, 1999, 1(1): 45–49. |
| [4] | Cudkowicz ME, Mckenna-Yasek D, Sapp PE, et al. Epidemiology of mutations in superoxide dismutase in amyotrophic lateral sclerosis[J]. Ann Neurol, 1997, 41(2): 210–221. DOI:10.1002/(ISSN)1531-8249 |
| [5] | Niu YF, Xiong HL, Wu JJ, et al. Screening of mutations in SOD1 gene and analysis of genotype-phenotype correlation in Chinese patients with amyotrophic lateral sclerosis[J]. Yi Chuan, 2011, 33(7): 720–724. DOI:10.3724/SP.J.1005.2011.00720 |
| [6] | Bali T, Self W, Liu J, et al. Defining SOD1 ALS natural history to guide therapeutic clinical trial design[J]. J Neurol Neurosurg Psychiatry, 2017, 88(2): 99–105. DOI:10.1136/jnnp-2016-313521 |
| [7] | Bruijn LI, Houseweart MK, Kato S, et al. Aggregation and motor neuron toxicity of an ALS-linked SOD1 mutant independent from wild-type SOD1[J]. Science, 1998, 281(5384): 1851–1854. DOI:10.1126/science.281.5384.1851 |
| [8] | Battistini S, Ricci C, Giannini F, et al. G41S SOD1 mutation:A common ancestor for six ALS Italian families with an aggressive phenotype[J]. Amyotroph Lateral Scler, 2010, 11(1-2): 210–215. DOI:10.3109/17482960902995592 |
| [9] | Orrell RW, Habgood JJ, Malaspina A, et al. Clinical characteristics of SOD1 gene mutations in UK families with ALS[J]. J Neurol Sci, 1999, 169(1-2): 56–60. DOI:10.1016/S0022-510X(99)00216-6 |
| [10] | Prudencio M, Hart PJ, Borchelt DR, et al. Variation in aggregation propensities among ALS-associated variants of SOD1:correlation to human disease[J]. Hum Mol Genet, 2009, 18(17): 3217–3226. DOI:10.1093/hmg/ddp260 |
| [11] | Kaur SJ, Mckeown SR, Rashid S. Mutant SOD1 mediated pathogenesis of Amyotrophic Lateral Sclerosis[J]. Gene, 2016, 577(2): 109–118. DOI:10.1016/j.gene.2015.11.049 |
| [12] | Marucci G, Morandi L, Bartolomei I, et al. Amyotrophic lateral sclerosis with mutation of the Cu/Zn superoxide dismutase gene (SOD1) in a patient with Down syndrome[J]. Neuromuscul Disord, 2007, 17(9-10): 673–676. DOI:10.1016/j.nmd.2007.06.003 |
| [13] | Schupf N, Lee A, Park N, et al. Candidate genes for Alzheimer's disease are associated with individual differences in plasma levels of beta amyloid peptides in adults with Down syndrome[J]. Neurobiol Aging, 2015, 36(10): 2907. |
| [14] | Zhang H, Zhao H, Lu M, et al. A rare Cu/Zn superoxide dismutase mutation causing familial amyotrophic lateral sclerosis with variable age of onset and incomplete penetrance in China[J]. Amyotroph Lateral Scler Other Motor Neuron Disord, 2005, 6(4): 234–238. DOI:10.1080/14660820510044478 |
| [15] | Wu J, Shen E, Shi D, et al. Identification of a novel Cys146X mutation of SOD1 in familial amyotrophic lateral sclerosis by whole-exome sequencing[J]. Genet Med, 2012, 14(9): 823–826. DOI:10.1038/gim.2012.50 |
| [16] | Cui F, Cai W, Wang Z, et al. New mutation in the SOD1(copper/zinc superoxide dismutase-1) gene in a Chinese amyotrophic lateral sclerosis (ALS) patient[J]. Amyotroph Lateral Scler Frontotemporal Degener, 2013, 14(7-8): 635–637. DOI:10.3109/21678421.2013.817589 |
| [17] | Chen S, Li M, Zhu W, et al. A novel 10-base pair insertion mutation in exon 5 of the SOD1 gene in a Chinese family with amyotrophic lateral sclerosis[J]. Neurobiol Aging, 2016, 45: 211–212. |
| [18] | Wang Z, Cai W, Cui F, et al. Identification of a novel missense (C7W) mutation of SOD1 in a large familial amyotrophic lateral sclerosis pedigree[J]. Neurobiol Aging, 2014, 35(3): 711–725. |
| [19] | Zhao G, Yin X, Wu D, et al. Clinical features and Cu/Zn superoxide dismutase gene mutations in two mainland Chinese families with amyotrophic lateral sclerosis[J]. Int J Neurosci, 2011, 121(4): 191–195. DOI:10.3109/00207454.2010.542841 |
| [20] | Fong GC, Kwok KH, Song YQ, et al. Clinical phenotypes of a large Chinese multigenerational kindred with autosomal dominant familial ALS due to Ile149Thr SOD1 gene mutation[J]. Amyotroph Lateral Scler, 2006, 7(3): 142–149. DOI:10.1080/17482960600732412 |
| [21] | Hu J, Chen K, Ni B, et al. A novel SOD1 mutation in amyotrophic lateral sclerosis with a distinct clinical phenotype[J]. Amyotroph Lateral Scler, 2012, 13(1): 149–154. DOI:10.3109/17482968.2011.621437 |
| [22] | Liu ZJ, Li HF, Tan GH, et al. Identify mutation in amyotrophic lateral sclerosis cases using Halo Plex target enrichment system[J]. Neurobiol Aging, 2014, 35(12): 2811–2881. |
| [23] | Tsai CP, Soong BW, Lin KP, et al. FUS, TARDBP, and SOD1 mutations in a Taiwanese cohort with familial ALS[J]. Neurobiol Aging, 2011, 32(3): 513–553. |
| [24] | Soong BW, Lin KP, Guo YC, et al. Extensive molecular genetic survey of Taiwanese patients with amyotrophic lateral sclerosis[J]. Neurobiol Aging, 2014, 35(10): 2421–2423. |
 2017, Vol. 44
2017, Vol. 44




