扩展功能
文章信息
- 崔新新, 董素艳, 郭彦杰, 赵文娟, 吴云成
- CUI Xin-Xin, DONG Su-Yan, GUO Yan-Jie, ZHAO Wen-Juan, WU Yun-Cheng
- MPTP小鼠脑沉默信息调节因子1和缺氧诱导因子-1α的表达及行为学检测
- Expression of silent information regulator 1 and hypoxia-inducible factor 1α and behavioral changes in MPTP mice
- 国际神经病学神经外科学杂志, 2017, 44(1): 28-34
- Journal of International Neurology and Neurosurgery, 2017, 44(1): 28-34
-
文章历史
收稿日期: 2016-10-10
修回日期: 2016-12-30
2. 新乡医学院第三附属医院神经内科, 河南省新乡市 453003;
3. 上海交通大学药学院, 上海市 200240
帕金森病 (Parkinson’s disease, PD) 是中老年人中第二大常见的神经退行性疾病,在大于65岁的人群中,PD发病率接近1%[1]。尸检和致病基因的生物学效应等研究发现,线粒体功能异常、氧化应激、炎症及蛋白质处理异常等可能参与了PD的细胞功能异常和死亡机制[2]。但其具体发病机制尚未完全阐明。
沉默信息调节因子 (silent information regulation 2 homolog, SIRT),是NAD+依赖性的Ⅲ型组蛋白去乙酰化酶 (HDACs),包括SIRT1-7[3]。研究发现,SIRT1在大脑中高度表达,而PD细胞模型中其表达受损[4],而SIRT1激活物可缓解多巴胺能神经元的损伤[5];深入的机制研究发现,过表达SIRT1可通过激活分子伴侣,抑制α-突触核蛋白的聚集[6]。
缺氧诱导因子-1(hypoxia inducible factor-1, HIF-1) 由HIF-1α和HIF-1β两个亚基组成,其中,HIF-1α含量受氧浓度调节[7],缺氧状态下,HIF-1α的降解受抑制,与靶基因的缺氧反应元件 (hypoxia response element, HRE) 结合,促进靶基因转录[8]。研究发现多巴胺 (dopamine, DA) 合成关键酶酪氨酸羟化酶 (tyrosine hydroxylase, TH) 的启动子区域存在HRE可与HIF-1结合;条件性敲除小鼠的HIF-1α基因,可致黑质区域TH表达下调;低氧及去铁胺可以通过上调HIF-1,增加大鼠中脑TH的表达;而增加HIF-1的活性,可增加中脑黑质区域DA的合成和分泌[9]。之前研究显示,HIF-1α的稳定性和功能受翻译后修饰调控[9],但具体机制尚未明确。
蛋白质的乙酰化修饰是机体中一种重要的翻译后修饰方式,可能参与HIF-1α的修饰调控。而SIRT1的保护作用,主要是通过对组蛋白和非组蛋白类转录因子的去乙酰化作用实现的,其中包括p53、FOXO和HIF-1α等[10, 11]。有研究显示,SIRT1可直接作用于HIF-1α 674位点赖氨酸、使其去乙酰化,减少含量及转录活性[12]。低氧抑制糖酵解时,发现HIF-1α和HIF-2α可以导致SIRT1表达上调[13]。肝癌细胞系内,下调SIRT1蛋白表达或抑制其活性后,则严重损害HIF-1α蛋白的积聚及其转录活性[14]。以上研究多集中在细胞水平,少见活体水平研究。本实验在动物活体水平探讨SIRT1与HIF1α在MPTP处理的小鼠中变化,探讨二者在PD发病过程中的变化,为阐明SIRT1/HIF-1α信号通路参与PD的发病机制提供实验依据。
1 材料与方法 1.1 实验动物雄性C57BL/6小鼠,8~10周龄,体重24~28 g,由上海斯莱克实验动物有限责任公司提供 (生产许可证编号:SCXK (沪) 2012-0002)。小鼠每笼4~5只,自由进食和饮水,室温20~25℃,相对湿度40%~50%,12 h昼夜节律,饲养于上海交通大学实验动物中心 (使用许可证编号:SYXK (沪)2013-0052)。
1.2 实验动物分组给药雄性C57BL/6小鼠适应1周后,进行行为学训练1周,随机分为对照组和模型组,各10只。模型组小鼠腹腔注射MPTP (30 mg/kg, Sigma, USA),对照组腹腔注射等量生理盐水,连续注射5 d。最后一次给药后21 d处死小鼠,取材,进行后续实验。
1.3 行为学实验在首次给药前1 d、及末次给药后第1、7、14、21 d分别进行行为学测试。各行为学测试重复一次,两次间隔1 h。
1.3.1 开场实验开场实验 (open field) 主要用于评价小鼠自发行为活动情况。将小鼠置于实验箱预订位置,摄像机连续拍摄5 min全程记录活动情况,开场实验视频分析系统 (上海移数信息科技有限公司) 分析其行走的总路程 (total distance)、中央活动路程 (center distence) 及运动轨迹等。同时,观察并计数小鼠全程中竖立次数 (rearing)。
1.3.2 足迹实验足迹实验 (stride length) 根据文献[15]实验装置是长55 cm,宽10 cm,高10 cm木制走道,一边盲端,另一边接黑色的鼠笼。实验时将小鼠放于盲端,光源照射走道,小鼠自然爬向鼠笼端。分别测量3个最长的前肢步长 (fore limb)、后肢 (hind limb),取平均值。
1.3.3 爬杆实验爬杆实验 (pole test) 的装置[16]是长60 cm,直径约1 cm,上端覆以直径约2.5 cm的球形突起。实验时将小鼠头朝上置于球形突起,记录其自放置于杆顶到头转向下的时间 (T-turn) 和自放置杆顶至爬至杆底后肢着地的总时间 (T-total)。每只小鼠测试3次取平均值,每次间隔10 min以上。
1.4 小鼠心脏灌注及取材末次行为学检测结束后,小鼠心脏灌注取全脑用于组织病理学检测。按40 mg/kg腹腔注射10%水合氯醛进行麻醉,之后心脏灌流操作,断头,小心剥离全脑,置于4% PFA进行后固定24 h后,石蜡包埋,冠状位切6 μm切片,切片需包括完整的黑质致密部,用于免疫组织化学分析。每组另外5只颈椎脱臼处死,冰上迅速解剖黑质纹状体,液氮和-80℃储存,用于高效液相色谱或其他后续处理。
1.5 高效液相色谱检测神经递质取剥离纹状体称重,按10 μl/mg加入含有10 mM EDTA的PBS。冰上15 min,超声破碎组织。4℃,15000 rpm,离心10 min,取上清,记录样品上清量。上清中加入等体积含10 mM EDTA的0.4 M的冷冻HCLO4混匀。冰上避光静置15 min后,4℃,15000 rpm,离心15 min,取中间层进行高效液相色谱 (high performance liquid chromatography, HPLC) 电化学检测,检测DA及其代谢产物。
1.6 免疫组化脑组织的免疫组织化学检测酪氨酸羟化酶 (TH)、多巴胺转运体 (DAT)、SIRT1和HIF-1α。脑组织石蜡切片室温下0.3%过氧化氢孵育10 min,再放于封闭液 (含10%山羊血清、0.2% Triton X-100的0.01M PBS (pH 7.2))37 ℃封闭30min。切片用0.01 M PBS清洗3次,每次5 min。小鼠源性的一抗anti-TH、anti-DAT、anti-SIRT1 (Cell Signaling Technology, Inc. Danvers, MA, USA),anti-HIF1α(Abcam, San Francisco, USA) 按抗体说明书稀释,4℃孵育过夜。第二日,生物素标记的抗小鼠IgG处理30 min,然后加亲和素-过氧化物酶复合物 (ABC kit, Vector, USA)。0.05%DAB (含0.03%H2O2的Tris-Hcl缓冲液) 显色。
1.7 蛋白质免疫印迹组织总蛋白分离和提取方法按照试剂 (sigma-Aldrich, St.Louis, MO, USA) 说明书进行,相同含量的蛋白质用SDS-PAGE进行分离,转移至PVDF膜上,经5%脱脂奶粉室温封闭45 min。PVDF膜分别置于特定一抗anti-SIRT1、anti-TH、anti-βActin (Cell Signaling Technology, Inc.Danvers, MA, USA)、anti-HIF-1α(abcom, San Francisco, USA) 稀释液中孵育,4℃过夜。第二日,PVDF膜用TBST漂洗3次,孵育二抗,孵育结束后TBST洗膜。NIR扫描设备 (Odyssey scanner, I-COR Bioscience) 检测免疫活性,Image J软件分析蛋白条带的灰度值。
1.8 RNA提取、反转录和qRT-PCR用Trizol reagent (Invitrogen Life Technologies, Carlsbad, CA, USA) 提取样品总RNA,测定提取RNA浓度。逆转录反应根据ReverTra Ace-α First Strand cDNA Synthesis Kit (TOYOBA CO, LTD) 的说明进行,反转录RNA样品为cDNA。利用SYBR-Green real-time PCR Master Mix (Toyobo Co., Ltd., Osaka, Japan),以各组样品cDNA为模板,进行qRT-PCR反应。以18sRNA为内参,反应结束后,采用△△ CT法计算目的基因的相对含量。用于扩增的每个基因的引物序列如下:
HIF1α-F: GCGCGAACGACAAGAAA
HIF1α-R: GAAGTGGCAACTGATGAGCA
18s rRNA-F: CAGCCACCCGAGATTGAGCA
18s rRNA-R: TAGTAGCGACGGGCGGTGTG
1.9 统计学分析所有数据均用均数±标准差 (x±s) 表示。行为学数据的比较使用重复测量数据的方差分析 (one-way repeated measures ANOVA),组间比较用单因素方差分析 (one-way ANOVA),组内两两比较采用Dunnett’s T3检测或LSD法。P < 0.05为差异有统计学意义。
2 结果 2.1 MPTP处理小鼠表现出行为学异常为了检测MPTP对完整脑回路中多巴胺能神经元的影响,我们检测开场实验、足迹实验、爬杆实验,检测MPTP处理后小鼠运动功能改变。实验结果显示,模型组小鼠运动的总路程 (total distance)、中央路程 (center distence) 及竖立次数 (rearing) 在给予MPTP处理后第1、7、14、21天均较对照组小鼠显著下降 (图 1A~图 1C)。给予MPTP处理后,模型组小鼠前肢及后肢步长均较对照组小鼠显著缩短 (图 1F~图 1G)。模型组的转向时间 (T-turn) 及爬杆总时间 (T-total) 均较对照组小鼠显著延长 (图 1D~图 1E)。以上行为学的实验结果表明,MPTP能够明显诱导小鼠行为学损伤。
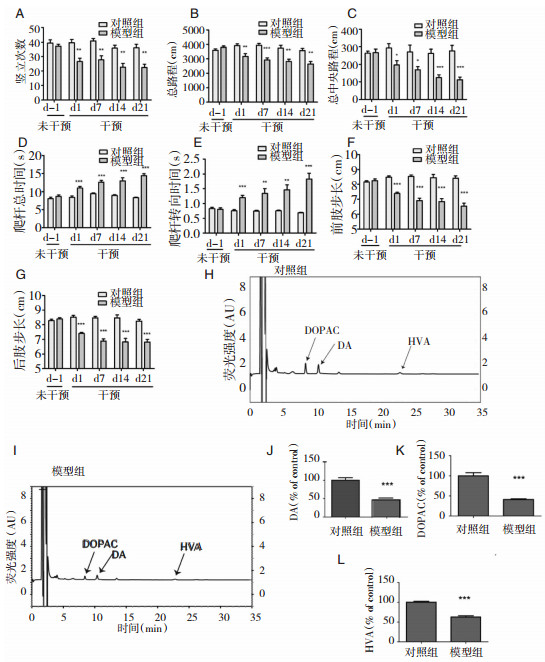
|
| 图 1 MPTP对小鼠行为学、多巴胺及其代谢产物的影响 开场实验 (n=10):检测竖立次数 (A)、总路程 (B)、中央路程 (C);爬杆实验:检测爬杆总时间 (D),转向时间 (E);足迹实验 (n=10):前肢步长 (F),后肢步长 (G)。HPLC检测 (H-I) 纹状体中DA (J)、DOPAC (K) 和HVA (L) 的表达情况,即荧光强度 (fluorescence intensity)(n=5)。*P < 0.05;**P < 0.01;***P < 0.001均为与对照组比较。 |
为了明确MPTP对小鼠纹状体DA及其代谢产物的影响,我们选用HPLC检测小鼠纹状体多巴胺 (DA)、二羟基苯乙酸 (DOPAC) 及高香草酸 (HVA) 的含量 (图 1H~图 1L)。MPTP处理可以导致纹状体中DA含量显著下降 (对照组:100.00%±7.06%;模型组:47.83%±4.99%;P=0.0003; n=5);多巴胺的代谢产物DOPAC (对照组:100.00%±8.02%;模型组:40.96%±1.97%;P < 0.0001; n=5) 以及HVA (对照组:100.00%±2.58%;模型组:62.62%±3.08%;P < 0.0001; n=5) 在MPTP处理21 d后同样显著下降。为了进一步检测MPTP对多巴胺能神经元的神经毒性损害,我们检测黑质致密部中TH和DAT阳性神经元含量。从图 2A~图 2D中我们发现,与对照组相比,MPTP降低了黑质中TH (对照组:17.26%±0.28%;模型组:10.82%±0.36%;P=0.0048, n=5) 和DAT (对照组:19.25%±0.34%;模型组:10.83%±0.16%;P=0.0020, n=5) 阳性神经元含量。
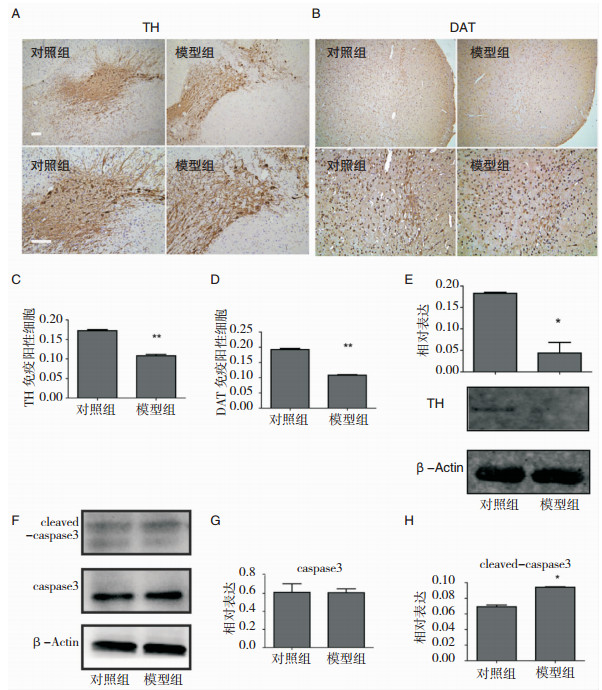
|
| 图 2 MPTP对纹状体区域TH和DAT阳性神经元及TH蛋白表达的影响 纹状体区DA神经元TH (A和C) 和DAT (B和D) 染色的典型图片及相应的阳性神经元 (immupositive cells) 计数统计图。Scale bars: 20 μm。纹状体区TH蛋白免疫印迹图及灰度统计图 (E),caspase 3和cleaved caspase 3蛋白免疫印迹图及相对表达 (relative expression) 灰度统计图 (G和H)。*P < 0.05;**P < 0.01;***P < 0.001均为与对照组比较 (n=5)。 |
采用免疫组织化学检测实验动物脑组织中SIRT1和HIF-1α的表达情况。如图 3A和图 3C,与对照组相比,模型组SIRT1阳性细胞明显下降 (对照组:5.10%±0.06%;模型组:3.12%±0.01%;P=0.0011; n=5);相反的是,HIF1α阳性细胞数量较对照组增加 (对照组:5.17%±0.15%;模型组:8.06%±0.27%;P=0.0120; n=5)(图 3B和图 3D)。为进一步验证结果,采用蛋白印迹和qRT-PCR分别检测SIRT1和HIF-1α的蛋白质和HIF-1α mRNA的含量 (图 3E~图 3H)。与上述结果相一致,SIRT1蛋白表达下降,HIF1α的水平增加,同时,HIF-1α mRNA显著增加 (图 3H)。纹状体蛋白印迹分析结果显示,MPTP组中TH的蛋白质含量下降,凋亡相关的蛋白剪切形式的caspase3被激活,而总的caspase3未见明显变化 (图 2E~图 2H)。
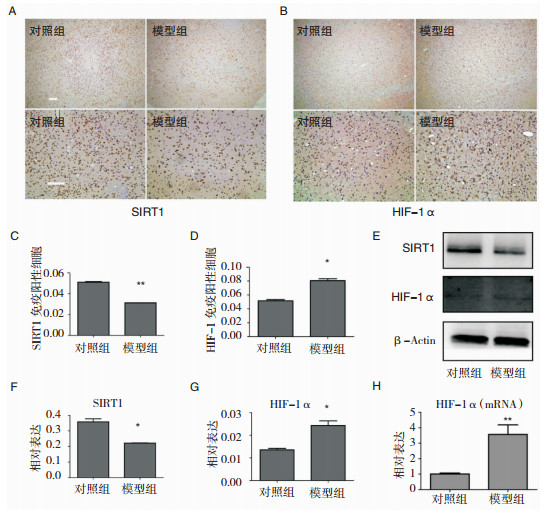
|
| 图 3 MPTP处理小鼠对SIRT1和HIF1-α表达影响 SIRT1(A和C) 和HIF-1α (B和D) 免疫组化染色的典型图片及相应的免疫阳性细胞 (immupositive cells) 定量统计图。Scale bars: 20 μm。纹状体区SIRT1和HIF-1α蛋白的免疫印迹分析 (E) 及相对表达 (relative expression) 灰度统计图 (F和G)。纹状体区HIF-1α mRNA qRT-PCR相对表达 (relative expression) 分析图 (H)。*P < 0.05;**P < 0.01;***P < 0.001均为与对照组比较 (n=5)。 |
目前有多种PD动物模型的建立方法。小鼠一般采用腹腔注射造模剂构建模型。常用药物有MPTP (30 mg/kg) 和百草枯 (10 mg/kg) 等。对于MPTP造模又分为急性、亚急性和慢性模型。慢性小鼠PD模型更适于研究药物的治疗效果[7]而急性模型多用于神经炎性和神经保护研究[17]。本研究中采用了亚急性造模方法,避免了急性造模时大剂量易致死的弊端,又避开了慢性造模时间过长混杂因素过多结果不稳定。PD病人主要临床特点为静止性震颤、运动迟缓、肌强直等[18]。本研究中,检测多种行为学指标:开场实验用于评估小鼠的自主活动状态,是检测MPTP损伤后小鼠少动的常用指标;足迹试验检测步态异常,爬杆试验用于评价运动迟缓。综合各指标证实MPTP模型小鼠表现出明显的自主运动异常,步态异常,运动缓慢。
最近研究表明,SIRT1和HIF-1α可能参与了PD的发生和发展。SIRT1在大脑中高度表达,PD细胞模型中其表达受损[4],SIRT1激活物可对抗多巴胺能神经元的损伤[8];其机制可能是激活分子伴侣,抑制α-共核蛋白的聚集[6]。HIF-1参与PD疾病发生主要涉及TH,因其启动子区域存在HRE可与HIF-1结合;条件性敲除HIF-1α基因,可致黑质区域TH表达受损;而条件性上调HIF-1,能增加大鼠中脑TH的表达;另外增加HIF-1的活性,也能增加中脑黑质区域DA的合成和分泌[9]。但两者间具体的调控机制尚不清楚。
有研究显示,在HT1080细胞中,SIRT1可直接作用于HIF-1α赖氨酸674位点、促进HIF-1α去乙酰化,增加其降解,降低其转录活性[12]。对多个细胞系的研究发现,低氧抑制糖酵解时,HIF-1α和HIF-2α可以导致SIRT1表达上调[13]。另有研究提示,SIRT1可以促进PHD去乙酰化,间接减少HIF-1α降解。有研究者发现,肝癌细胞系内,缺氧未改变SIRT1 mRNA或蛋白的表达,但可引起HIF-1α蛋白累积并上调其靶基因的表达,但下调SIRT1蛋白表达或抑制其活性后,则严重损害HIF-1α蛋白的积聚及其转录活性[14]。因此认为HIF-1α是SIRT1去乙酰化调控的下游靶标;缺氧条件下,SIRT1是HIF-1α蛋白积聚和激活其靶基因的必需条件[14]。另有研究对心肌细胞给予低氧预处理后,得出类似结论,SIRT1也可以通过去乙酰化PHD下调其表达最终升高HIF-1α水平[19]。最新报道,MPP+处理SHSY-5Y后,SIRT1表达下降,导致与HIF-1α启动子区域结合的组蛋白H3K14的乙酰化升高,激活HIF-1α的转录使其表达水平上调[20]。Lim等人发现SIRT1可结合并去乙酰化HIF-1α的第674位氨基酸,进而干扰其靶基因启动子区域招募辅因子p300,进一步抑制后者的转录活性[9]。SIRT1可以通过去乙酰化修饰下调脯氨酸羟化酶PHD2的表达,而抑制SIRT1后PHD2的表达上调,进而使HIF-1α降解增多,含量减少[21]。在几个不同的肿瘤细胞系中的研究均发现,SIRT1可以抑制HIF-1的活性[22]。以上研究揭示SIRT1和HIF-1间存在相互作用,可能涉及多种调控机制,但多数研究局限于体外实验,本研究在体内水平,探讨了二者在PD模型中的变化。为进一步深入了解二者间联系打下基础。
| [1] | Driver JA, Logroscino G, Gaziano JM, et al. Incidence and remaining lifetime risk of Parkinson disease in advanced age[J]. Neurology, 2009, 72: 432–438. DOI:10.1212/01.wnl.0000341769.50075.bb |
| [2] | Schapira AH, Olanow CW, Greenamyre JT, et al. Slowing of neurodegeneration in Parkinson's disease and Huntington's disease:future therapeutic perspectives[J]. Lancet, 2014, 384: 545–555. DOI:10.1016/S0140-6736(14)61010-2 |
| [3] | Finkel T, Deng CX, Mostoslavsky R. Recent progress in the biology and physiology of sirtuins[J]. Nature, 2009, 460: 587–591. DOI:10.1038/nature08197 |
| [4] | Feng Y, Liu T, Dong SY, et al. Rotenone affects p53 transcriptional activity and apoptosis via targeting SIRT1 and H3K9 acetylation in SH-SY5Y cells[J]. J Neurochem, 2015, 134: 668–676. DOI:10.1111/jnc.2015.134.issue-4 |
| [5] | Ferretta A, Gaballo A, Tanzarella P, et al. Effect of resveratrol on mitochondrial function:implications in parkin-associated familiar Parkinson's disease[J]. Biochim Biophys Acta, 2014, 1842: 902–915. DOI:10.1016/j.bbadis.2014.02.010 |
| [6] | Donmez G, Outeiro TF. SIRT1 and SIRT2:emerging targets in neurodegeneration[J]. EMBO Mol Med, 2013, 5: 344–352. DOI:10.1002/emmm.201302451 |
| [7] | Sarkar S, Chigurupati S, Raymick J, et al. Neuroprotective effect of the chemical chaperone, trehalose in a chronic MPTP-induced Parkinson's disease mouse model[J]. Neurotoxicology, 2014, 44: 250–262. DOI:10.1016/j.neuro.2014.07.006 |
| [8] | 崔新新, 吴云成. 缺氧诱导因子-1在帕金森病发病机制中的研究进展[J]. 国际神经病学神经外科学杂志, 2015, 42: 294–298. |
| [9] | Ke Q, Costa M. Hypoxia-inducible factor-1(HIF-1)[J]. Mol Pharmacol, 2006, 70: 1469–1480. DOI:10.1124/mol.106.027029 |
| [10] | Zhang F, Wang S, Gan L, et al. Protective effects and mechanisms of sirtuins in the nervous system[J]. Prog Neurobiol, 2011, 95: 373–395. DOI:10.1016/j.pneurobio.2011.09.001 |
| [11] | Herskovits AZ, Guarente L. SIRT1 in neurodevelopment and brain senescence[J]. Neuron, 2014, 81: 471–483. DOI:10.1016/j.neuron.2014.01.028 |
| [12] | Lim JH, Lee YM, Chun YS, et al. Sirtuin 1 modulates cellular responses to hypoxia by deacetylating hypoxia-inducible factor 1alpha[J]. Mol Cell, 2010, 38: 864–878. DOI:10.1016/j.molcel.2010.05.023 |
| [13] | Chen R, Dioum EM, Hogg RT, et al. Hypoxia increases sirtuin 1 expression in a hypoxia-inducible factor-dependent manner[J]. J Biol Chem, 2011, 286: 13869–13878. DOI:10.1074/jbc.M110.175414 |
| [14] | Laemmle A, Lechleiter A, Roh V, et al. Inhibition of SIRT1 impairs the accumulation and transcriptional activity of HIF-1alpha protein under hypoxic conditions[J]. PLoS One, 2012, 7: e33433. DOI:10.1371/journal.pone.0033433 |
| [15] | Fernagut PO, Diguet E, Labattu B, et al. A simple method to measure stride length as an index of nigrostriatal dysfunction in mice[J]. J Neurosci Methods, 2002, 113: 123–130. DOI:10.1016/S0165-0270(01)00485-X |
| [16] | Drucker-Colin R, Garcia-Hernandez F. A new motor test sensitive to aging and dopaminergic function[J]. J Neurosci Methods, 1991, 39: 153–161. DOI:10.1016/0165-0270(91)90081-A |
| [17] | Gordon R, Singh N, Lawana V, et al. Protein kinase Cdelta upregulation in microglia drives neuroinflammatory responses and dopaminergic neurodegeneration in experimental models of Parkinson's disease[J]. Neurobiol Dis, 2016, 93: 96–114. DOI:10.1016/j.nbd.2016.04.008 |
| [18] | Feng Y, Jankovic J, Wu YC. Epigenetic mechanisms in Parkinson's disease[J]. J Neurol Sci, 2015, 349: 3–9. DOI:10.1016/j.jns.2014.12.017 |
| [19] | Hong KS, Park JI, Kim MJ, et al. Involvement of SIRT1 in hypoxic down-regulation of c-Myc and beta-catenin and hypoxic preconditioning effect of polyphenols[J]. Toxicol Appl Pharmacol, 2012, 259: 210–218. DOI:10.1016/j.taap.2011.12.025 |
| [20] | Dong SY, Guo YJ, Feng Y, et al. The epigenetic regulation of HIF-1alpha by SIRT1 in MPP (+) treated SH-SY5Y cells[J]. Biochem Biophys Res Commun, 2016, 470: 453–459. DOI:10.1016/j.bbrc.2016.01.013 |
| [21] | Rane S, He M, Sayed D, et al. Downregulation of miR-199a derepresses hypoxia-inducible factor-1alpha and Sirtuin 1 and recapitulates hypoxia preconditioning in cardiac myocytes[J]. Circ Res, 2009, 104: 879–886. DOI:10.1161/CIRCRESAHA.108.193102 |
| [22] | Yoon H, Shin SH, Shin DH, et al. Differential roles of Sirt1 in HIF-1 alpha and HIF-2 alpha mediated hypoxic responses[J]. Biochem Biophys Res Commun, 2014, 444: 36–43. DOI:10.1016/j.bbrc.2014.01.001 |
 2017, Vol. 44
2017, Vol. 44




