扩展功能
文章信息
- 龚旋, 邓征浩, 李春涛, 周鸿书, 杨增, 李杰, 李炜, 李臻琰
- GONG Xuan, DENG Zheng-hao, Li CHUN-tao, ZHOU Hong-shu, YANG Zeng, LI Jie, LI Wei, Li Zhenyan
- HIF-1及NGB, VEGF在脑挫裂伤后促脑血管生成的作用机制
- Mechanism of action of hypoxia-inducible factor-1, neuroglobin, and vascular endothelial growth factor in promoting cerebral angiogenesis after cerebral contusion and laceration
- 国际神经病学神经外科学杂志, 2017, 44(1): 10-14
- Journal of International Neurology and Neurosurgery, 2017, 44(1): 10-14
-
文章历史
收稿日期: 2016-12-18
修回日期: 2017-02-07
2. 中南大学湘雅医院病理科, 湖南 长沙 410008;
3. 中南大学湘雅医院中西医结合研究所, 湖南 长沙 410008
2. Department of pathology, Xiangya hospital, Central South University, Changsha, China, 410008;
3. Institute of Integration of Traditional Chinese and Western Medicine, Xiangya hospital, Central South University, Changsha, China, 410008
脑挫裂伤是多发病、常见病。研究显示,脑挫裂伤可引发基因及蛋白质表达变化,导致神经细胞损伤或死亡。目前脑挫裂伤的实验研究己经取很大进展但尚不能令人满意。深入探讨脑挫裂伤的病理生理变化,及其在诊断、治疗和疗效评估中的作用,逐渐成为学者们关注的热点。
本研究采用脑挫裂伤患者和非颅脑创伤患者作为研究对象,分别取两组的脑组织及血清为样本,采用二维凝胶电泳和质谱技术分离、鉴定2种样本的差异蛋白。随后使用酶联免疫法与免疫组化法检测差异蛋白——HIF-1及Ngb,VEGF在正常人和脑挫裂伤患者的脑组织及血清中表达水平的动态变化,从而探讨三者在脑挫裂伤后促进脑血管的生成作用,为进一步从蛋白质整体水平筛选人类脑挫裂伤的靶标打下良好基础。
1 资料和方法 1.1 一般资料所有纳入研究的脑挫裂伤患者均为重型颅脑创伤,GCS评分为5~8分、通过CT检查证实。组织经手术切除后30 min内,置液氮中保存。实验组:选择10例患者 (其中男6、女4),年龄在18~70岁之间,平均年龄39.14±2.8岁,术中所取脑挫裂伤组织均位于右额叶。对照组:2例癫痫患者及3例脑室肿瘤患者术中取得少量非颅脑创伤额叶组织为对照。用于酶联免疫分析的10例脑挫裂伤患者血清均为手术前、未经任何治疗患者的血清。标本的获取均履行告知并获得书面同意。正常人血清由年龄和性别匹配的10例志愿者提供。
1.1.1 试剂酶联免疫检测试剂盒;SP免疫组化试剂盒;PVDF膜;2D Quant蛋白质定量试剂盒;ECL发光试剂盒;辣根过氧化物酶偶联的羊抗大鼠,大鼠抗VEGF及HIF-1多克隆抗体; DAB显色试剂盒等。
1.1.2 仪器等电聚焦仪、垂直电泳槽、水平式电泳仪、扫描仪、质谱仪、酶标仪等。
1.2 方法 1.2.1 质谱分析将处理过的脑挫裂伤灶及非颅脑创伤额叶组织标本先后取出、研磨、离心;按IPGphor等电聚焦系统使用指南进行二维电泳;结束后,对2-DE胶进行染色;随后进行凝胶图像分析,软件比较分析脑外伤患者和非颅脑创伤患者2-DE电泳图谱差异,取表达水平相差2倍以上的蛋白质点行质谱分析;利用Mascot软件检索NCBI数据库鉴定蛋白质。
1.2.2 血清样品分析采集实验组患者和对照组正常人空腹静脉血各5 mL,采用酶联免疫方法,按照相关试剂盒说明进行操作。绘制标准曲线、分别计算各样本的HIF-1、Ngb、VEGF浓度。随后采用SP法,按照试剂盒说明书分别进行免疫组织化学染色,染色结果判定:HIF-1蛋白的表达以细胞浆内出现棕黄色颗粒为阳性细胞,参照试剂盒说明书,采用双盲法,稍加改进做半定量分析:分为阴性、弱阳性、阳性、强阳性。用已知阳性表达的脑外伤组织作阳性对照,另取PBS溶液代替HIF-1抗体作阴性对照。
1.3 统计学分析应用SPSS 19.0统计软件包进行统计学分析。各组数据采用均数±标准差 (χ±s) 表示,组间比较采取方差分析,P<0.05认为差异有统计学意义。
2 结果 2.1 脑组织双向凝胶电泳图谱及分析 2.1.1 脑组织双向凝胶电泳图谱在同等条件下对同一标本的总蛋白质样品分别进行了3次双向凝胶电泳,其总蛋白质的分布模式非常相似,以pI4~8和Mr20~75kD范围的蛋白质斑点分布最多。经过优化的2-DE条件获得了分辨率高、背景清晰的双向凝胶参考图谱 (见图 1-2)。

|
| 图 1 正常对照组脑组织2-DE图 |

|
| 图 2 脑挫裂伤组脑组织2-DE图 |
利用分析软件选择最强点及最弱点进行分析。与对照组比较分析,实验组中蛋白质点表达差异点共31个。随机选取其中9个点进行质谱分析。
2.3 脑组织质谱鉴定结果上述差异蛋白质点进行质谱分析和数据库查询,搜寻到7个有意义的蛋白质点,而Ngb、VEGF、和HIF-1位列其中。
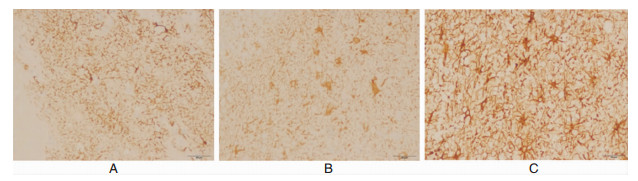
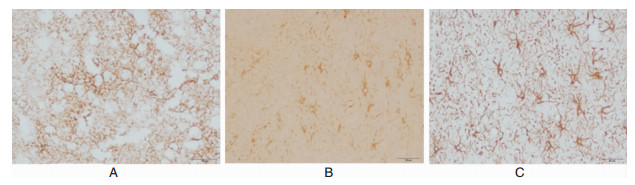
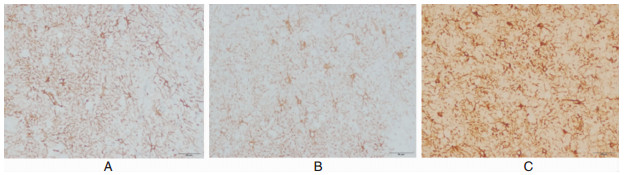
2.4 脑组织中HIF-1,NGb及VEGF的表达经免疫组化检测,提示脑组织中HIF-1、Ngb、VEGF表达均位于胞浆内。在非颅脑创伤脑组织中,HIF-1、Ngb、VEGF表达均呈弱阳性;在脑挫裂伤灶脑组织中,三者表达呈阳性;而挫裂伤灶周围水肿带脑组织中,三者表达呈强阳性,与对照组比较有显著性统计学意义 (P < 0.05),见图 3-5。
|
| 图 3 HIF-1的表达变化情况。 A. HIF-1在非颅脑创伤脑组织中的表达;B. HIF-1在挫裂伤灶脑组织的表达;C. HIF-1在挫裂伤灶周围水肿带脑组织中的表达 |
|
| 图 4 Ngb的表达变化情况。 A. Ngb在非颅脑创伤脑组织中的表达;B. Ngb在挫裂伤灶脑组织中的表达;C. Ngb在挫裂伤灶周围水肿带脑组织中的表达 |
|
| 图 5 VEGF的表达变化情况。 A.VEGF在非颅脑创伤脑组织中的表达;B. VEGF在挫裂伤灶脑组织中的表达;C. VEGF在挫裂伤灶周围水肿带脑组织中的表达 |
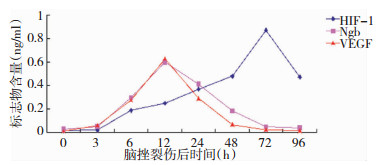
酶联免疫检测,HIF-1、Ngb、VEGF在正常人血清中呈低表达;脑挫裂伤后3小时三者表达均呈现逐渐增高趋势,Ngb、VEGF于12小时后达到峰值,其后表达逐渐下降,72小时后恢复至正常;而HIF-1直到72小时后达到峰值 (图 6);其后逐渐下降,于96小时后降至48 h水平。脑挫裂伤后6 h、12 h、24 h、36 h、48 h、72 h及96 h,三者表达与对照组比较有显著性统计学差异 (P < 0.05)。
|
| 图 6 Ngb、VEGF和HIF-1在脑挫裂伤后的表达变化情况 |
为了探讨脑挫裂伤后脑组织中蛋白质的变化,本研究找到7个认为有意义的蛋白质。
其中HIF-1作为细胞适应低氧环境的关键性调节因子, 在缺血缺氧相关性脑损伤的发生、发展过程中发挥着重要的双向调节作用[1-2]。Ngb是主要位于神经元内、能够可逆性结合氧的球蛋白,它能转运氧通过血脑屏障,提高代谢活跃的神经组织的氧供和利用率[3]。VEGF及其受体能促进内皮细胞增殖,加速新生血管形成,增加血管通透性,抗血栓,促进组织愈合[4]。HIF-1、Ngb和VEGF与其它4个经质谱鉴定的蛋白质比较,更具有从实验和临床深入研究的价值[3, 5]。因此本文将HIF-1、Ngb及VEGF列为重点研究对象。
经免疫组化检测发现,HIF-1、Ngb和VEGF表达均定位于胞浆内[6-8]。在非颅脑创伤脑组织中,HIF-1,Ngb和VEGF均呈弱阳性表达,在脑挫裂伤灶脑组织中则呈阳性表达,而脑挫裂伤灶周围水肿带脑组织中的HIF-1,Ngb和VEGF表达均呈强阳性。上述变化的机制可能是神经细胞受到外在暴力作用造成损伤,出现原发性神经元死亡及诱导迟发性神经元死亡如细胞凋亡等[9],致HIF-1的合成明显减弱或维持在低水准。在HIF-1的调控下,Ngb和VEGF的合成明显减弱;而在脑挫裂伤灶周围水肿带脑组织中,由于继发脑缺血缺氧,诱导HIF-1在创伤早期的反应性合成增加,从而促进神经元内线粒体内部的氧含量不断增加,以保持线粒体的正常功能并满足线粒体的产能,因而在这个时期可见HIF-1表达明显增强。其靶基因Ngb和VEGF表达也明显增强;随着时间的推移,脑挫裂伤进入后期,脑组织的缺血缺氧及水肿逐渐减轻,HIF-1及Ngb和VEGF的表达也就逐渐恢复至正常。
HIF-1和VEGF均参与缺血缺氧所致脑损伤的病理进展过程,对维持神经细胞功能和脑内环境稳定状态起到重要作用[10-11]。VEGF作为HIF-1的靶蛋白,参与脑缺血中神经血管重塑,促进血管形成及神经细胞保护[12-14]。HIF-1的诱导因子能增强Ngb的表达,HIF-1可介导Ngb的表达,推测Ngb可能为HIF-1的靶基因之一[15-18]。梁孟亚的研究结果亦证实了HIF-1和Ngb的这一功能联系[19]。本文推测,脑挫裂伤后HIF-1可能介导了Ngb和VEGF,而Ngb和VEGF均是HIF-1的靶基因。
本研究发现:在非脑挫裂伤人脑组织及血清中,HIF-1,Ngb和VEGF均呈现低表达;而在脑挫裂伤后,三者在脑组织中及与血清中表达水平均升高,且在时间上亦基本一致。提示HIF-1、Ngb和VEGF的表达可能与缺氧时间呈正相关 (图 1-6)。
研究表明[20],细胞内氧含量下降可导致HIF-1增加,后者通过羧基端侧的有效转录激活结构域,通过低氧反应元件结合,进一步调控下游基因,促进Ngb生成。Mones[21]等报道:Ngb的5’端非编码区存在数个能与HIF-1结合的碱基序列5’-RCGTG-3’片段,其可能促进Ngb基因的转录,使Ngb得以高表达,从而诱导Ngb的产生,直接协助氧透过血脑屏障进入脑细胞; 这个机制可以解释为什么神经细胞在此类缺氧环境中仍能摄取足够的氧分子,满足自身功能需求[22]。在缺氧情况下,HIF-1被激活后分别参与新生血管形成、细胞内压调节以及细胞凋亡、葡萄糖的转换和代谢。HIF-1,VEGF二者在脑缺血状态中,在体内某些激酶刺激下,表达具有很好相关性[23-24]。提示脑挫裂伤后酶体被激活,通过上调HIF-1进而调控VEGF的表达[25],介导了大脑缺血后的脑损伤[26-27]。
本研究还发现,正常人血清中HIF-1,Ngb和VEGF均呈低表达,在脑挫裂伤后3 h血清中三者的表达均逐渐升高,后两者12 h后达到峰值,前者72 h后表达才到峰值。其后Ngb和VEGF表达逐渐下降,并于72 h后基本恢复正常,而HIF-1于72 h后表达才逐渐下降 (图 6)。提示脑挫裂伤后,在HIF-1的调控下,Ngb和VEGF的表达水平随着脑挫裂伤患者脑组织的缺血缺氧由早期的加重至中晚期的减轻而发生变化。Ngb和VEGF在表达的时间上亦基本一致,提示两者的表达可能与缺氧时间呈正相关。由此推测,Ngb和VEGF的这种相关性,可能是:①由于HIF-1的介导作用而产生的;②其它信号转导通路使Ngb和VEGF两者相互作用而实现的。以上论点还有待进一步的研究论证。
总之, HIF-1,Ngb和VEGF的血清学变化有可能在一定程度上反映出脑细胞的损伤和修复情况从而直接体现患者脑外伤的严重程度。血清中三者的变化有可能作为评价脑挫裂伤的一种生物标记物,也可能作为评估缺血缺氧性脑病严重程度的潜在参考指标。对脑挫裂伤的诊断、治疗以及疾病的转归具有重要意义,值得深入研究。
| [1] | Khan M, Dhammu TS, Baarine M, et al. GSNO promotes functional recovery in experimental TBI by stabilizing HIF-1α[J]. Behav Brain Res, 2016. |
| [2] | Khan M, Dhammu TS, Matsuda F, et al. Promoting endothelial function by S-nitrosoglutathione through the HIF-1α/VEGF pathway stimulates neurorepair and functional recovery following experimental stroke in rats[J]. Drug Des Devel Ther, 2015, 9: 2233–47. |
| [3] | 李臻琰, 邓征浩, 李春涛, 等. 脑红蛋白在小儿脑挫裂伤病理过程中变化的初步研究[J]. 中国当代儿科杂志, 2012, 14(9): 697–702. |
| [4] | Qin X, You H, Cao F, et al. Apolipoprotein E Mimetic Peptide Increases Cerebral Glucose Uptake by Reducing Blood-Brain Barrier Disruption after Controlled Cortical Impact in Mice:An 18F-Fluorodeoxyglucose PET/CT Study[J]. J Neurotrauma. 2016 Sep 27.[Epub ahead of print] |
| [5] | Sen T, Sen N. Treatment with an activator of hypoxia-inducible factor 1, DMOG provides neuroprotection after traumatic brain injury[J]. Neuropharmacology, 2016, 107: 79–88. DOI:10.1016/j.neuropharm.2016.03.009 |
| [6] | Semenza GL, Wang GL. A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation[J]. Mol Cell Biol, 1992, 12(12): 5447–54. DOI:10.1128/MCB.12.12.5447 |
| [7] | Burmester T, Weich B, Reinhardt S, Hankeln T. A vertebrate globin expressed in the brain[J]. Nature, 2000, 407(6803): 520–523. DOI:10.1038/35035093 |
| [8] | Chodobski A, Chung I, Kozniewska E, et al. Early neurophilic expression of vascular endothelial growth factor after traumatic brain injury[J]. Neuroscience, 2003, 122(4): 853–867. DOI:10.1016/j.neuroscience.2003.08.055 |
| [9] | Pierce WM, Cai J. Applications of mass spectrometry in proteomics[J]. Contrib Nephrol, 2004, 141: 40–58. |
| [10] | 陈忠余, 赵世巧, 李蔚, 等. 睡眠呼吸暂停低通气综合征患者血清HIF-1α、VEGF、sVCM1水平的变化及意义[J]. 重庆医学, 2013, 42(5): 484–486. |
| [11] | 刘永年, 俞科贤, 马祁生, 等. 间歇性低压缺氧预处理对大鼠全脑缺血/再灌注海马CAI区Ngb和Bcl-2蛋白表达的影响[J]. 中国病理生理杂志, 2013, 29(12): 2240–2244. |
| [12] | Ding Y H, Luan X D, Li J, et al. Exercise-induced overexpression of angiogenic factors and reduction of ischemia/reperfusion injury in stroke[J]. Curr Neurovasc Res, 2004, 1(5): 411–20. DOI:10.2174/1567202043361875 |
| [13] | Ma Y, Liu W, Wang Y, et al. VEGF protects rat cortical neurons from mechanical trauma injury induced apoptosis via the MEK/ERK pathway[J]. Brain Res Bull, 2011, 86(5-6): 441–446. DOI:10.1016/j.brainresbull.2011.07.007 |
| [14] | Lu KT, Huang TC, Wang JY. NKCC1 mediates traumatic brain injury-induced hippocampal neurogenesis through CREB phosphorylation and HIF-1α expression[J]. Pflugers Arch, 2015, 467(8): 1651–1661. DOI:10.1007/s00424-014-1588-x |
| [15] | Sun Y, Jin K, Mao XO, et al. Neuroglobin is up-regulated by and protects neurons from hypoxic-ischemic injury[J]. Proc Natl Acad Sci USA, 2001, 98(26): 15306–15311. DOI:10.1073/pnas.251466698 |
| [16] | 贺建勋, 魏洪涛, 高武. 颅脑损伤患者血清中脑红蛋白表达变化的研究[J]. 中华神经外科疾病研究杂志, 2015, 14(1): 65–67. |
| [17] | Hota KB, Hota SK, Srivastava RB, et al. Neuroglobin regulates hypoxic response of neuronal cells through HIF-1α-and Nrf2-mediated mechanism[J]. J Cereb Blood Flow Metab, 2012, 32(6): 1046–1060. DOI:10.1038/jcbfm.2012.21 |
| [18] | 史少阳, 刘岌虹, 冯雪梅, 等. 脑红蛋白与神经系统缺氧缺血性损伤[J]. 中华医学杂志, 2008, 88(6): 430–432. |
| [19] | 梁孟亚, 唐志贤, 陈光献, 等. 深低温停循环下幼猪脑皮质HIF-1与NGB的表达及作用[J]. 中国病理生理杂志, 2015, 31(5): 823–827. |
| [20] | Ran R, Xu H, Lu A, et al. Hypoxia preconditioning in the brain[J]. Dev Neurosci, 2005, 27(2-4): 87–92. DOI:10.1159/000085979 |
| [21] | Mones L, Dewilde S. Globins in the brain[J]. Nature, 2000, 407(2): 461–462. |
| [22] | 黄生炫, 刘窗溪, 熊云彪. 缺氧诱导因子-1在缺血缺氧性脑损伤中的作用[J]. 中风与神经疾病杂志, 2012, 29(4): 375–376. |
| [23] | Schmidt-Kastner R, van Os J, WM Steinbusch H, et al. Generegulation by hypoxia and the neurodevelopmental origin of schizophrenia[J]. Schizophr Res, 2006, 84(2-3): 253–271. DOI:10.1016/j.schres.2006.02.022 |
| [24] | Lee HY, Lee T, Lee N, et al. Src activates HIF-1α not through direct phosphorylation of HIF-1α-specific prolyl-4hydroxylase 2 but through activation of the NADPH oxidase/Rac pathway.2011, 32(5):703-712. |
| [25] | Wu W, Tian R, Hao S, et al. A pre-injury high ethanol intake in rats promotes brain edema following traumatic brain injury[J]. Br J Neurosurg, 2014, 28(6): 739–745. DOI:10.3109/02688697.2014.915007 |
| [26] | 张磊, 刘家传, 杨艳艳, 等. 缺氧预处理对创伤性脑损伤大鼠脑组织HIF-1α、VEGF表达的影响[J]. 安徽医科大学学报, 2014, 49(4): 447–450. |
| [27] | 李永金, 杨开勇, 张谊, 等. 低氧诱导因子-1在脑损伤中的双向调节作用[J]. 中国细胞生物学学报, 2015, 37(6): 906–910. |
 2017, Vol. 44
2017, Vol. 44




