扩展功能
文章信息
- 陈远兵, 陈风华, 何芳, 刘宏伟, 谭泽明, 程全, 彭康, 唐云红, 王君宇, 梁银华
- CHEN Yuan-bing, CHEN Feng-hua, HE Fang, LIU Hong-wei, TAN Ze-ming, CHENG Quan, PENG Kang, TANG Yun-hong, WANG Jun-yu, LIANG Yin-hua
- 蛛网膜对儿童缺血型烟雾病间接颅内外血管重建术疗效的影响
- Impact of arachnoid on the clinical effect of indirect revascularization in treatment of ischemic-type moyamoya disease in children
- 国际神经病学神经外科学杂志, 2017, 44(1): 5-9
- Journal of International Neurology and Neurosurgery, 2017, 44(1): 5-9
-
文章历史
收稿日期: 2016-12-20
修回日期: 2017-02-16
2. 中南大学湘雅医院儿科, 湖南 长沙 410008;
3. 中南大学湘雅医院手术室, 湖南 长沙 410008
2. Department of Pediatric, Xiangya Hospital, Central South University, Changsha, Hunan 410008, China;
3. Department of Operation, Xiangya Hospital, Central South University, Changsha, Hunan 410008, China
烟雾病是一种以双侧颈内动脉末端、大脑中动脉起始端及 (或) 大脑前动脉起始端的慢性、进行性狭窄或闭塞为特征,同时伴有颅底异常血管网形成的疾病[1, 2]。烟雾病的发病特点在年龄中呈“双峰”分布,目前公认的第一个高峰期是10岁以下儿童,且以缺血型烟雾病多见[2-4]。手术是目前治疗烟雾病的有效途径,手术方式主要有直接和间接颅内外血管重建术;间接颅内外血管重建术是儿童烟雾病中最常用的手术方式[2, 5-7]。在间接颅内外血管重建术中,有学者认为蛛网膜是一层屏障,可能阻碍血管向脑内的生长[8];也有学者认为术中打开蛛网膜并不能改善预后[9],反而易导致脑脊液外漏,增加术后皮下积液的发生率[10];而近年来更多学者在文献报道的手术方式中提倡术中打开蛛网膜[11-13]。这两种意见目前尚缺乏疗效差异的文献报道。本文回顾2010年8月至2015年11月中南大学湘雅医院神经外科21例 (28侧) 儿童烟雾病手术患者临床资料,根据围手术期的并发症,随访临床症状、DSA、MRI-PWI (灌注) 检查来分析两组手术患者的疗效。
1 资料与方法 1.1 一般资料21例儿童缺血型烟雾病患者,共实施手术28侧 (其中7例患者分期实施双侧手术治疗),均采用EDAMS手术方式;将患者一侧手术作为一个统计样本进行两组手术临床基本资料统计分析, 两组男女分布、年龄分布、术前临床症状分型、术前DSA的Suzuki分期均无统计学差异。
1.2 纳入标准(1) 均有DSA检查且符合2012年日本烟雾病诊断与治疗指南的诊断标准[2];(2) 年龄小于16周岁;(3) 术前均完善MRI (DWI+PWI) 检查;(4) 完善相关检查排除继发性病变;(5) 手术方式均采用EDAMS (脑-硬脑膜-动脉-颞肌贴敷术)。
1.3 手术方法患者全麻后气管插管,取仰卧位,头向手术对侧偏70°,根据徒手触摸或多普勒探查,沿颞浅动脉顶支设计手术切口,常规消毒铺单后在显微镜下分离出颞浅动脉长约10~12cm,沿颞浅动脉走形切开颞肌,然后游离颞肌,铣刀行约5×5cm2大小骨瓣,放射状剪开硬膜,术中打开蛛网膜组则将手术视野内沿皮层动脉打开脑表面蛛网膜 (术中未打开蛛网膜组则不打开蛛网膜),用4-0慕丝线将颞浅动脉翻转缝合固定于两端硬膜上,翻转硬膜,将颞肌缝合于翻转的硬膜边缘,再还纳骨瓣,缝合切口 (如图 1)。
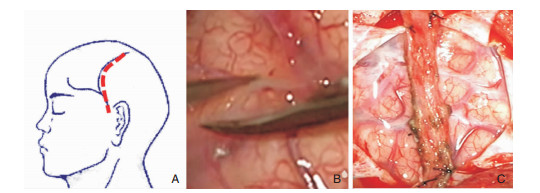
|
| 图 1 A手术切口示意图;B术中剪开蛛网膜;C翻转贴附颞浅动脉并用慕丝线缝合固定。 |
术后1年时临床症状采用Kim等[14]提出的治疗效果评价:a.优秀:术前症状完全消失;b.良好:临床症状完全消失,但是神经功能缺损仍有;c.一般:临床症状仍有,但是发作次数减少;d.差:症状无明显好转甚至加重。
1.4.2 DSA评估术后1年时复查DSA,采用Matsushima等[15]提出的标准进行分级:a.良好:血管重建的范围超过大脑中动脉分布区的2/3。b.一般:血管重建的范围介于大脑中动脉分布区的1/3-2/3之间。c.差:血管重建的范围小于大脑中动脉分布区的1/3(图 2)。
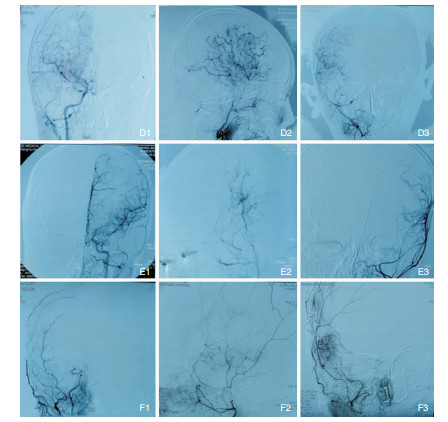
|
| 图 2 根据Matsushima等人提出的标准进行术后DSA分级:D组属于良好级别 (D1术前正位,D2术后侧位,D3术后正位);E组属于一般级别 (E1术前正位,E2术后侧位,E3术后正位);F组属于差级别 (F1术前正位,F2术后侧位,F3术后正位)。 |
术后1年时复查磁共振PWI,根据CBV、CBF、MTT、TTP的变化进行定性分析 (图 3)。
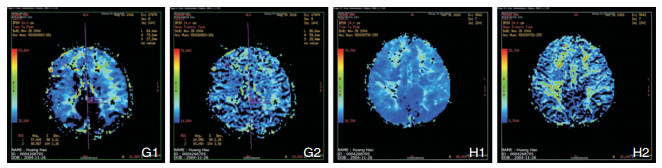
|
| 图 3 G1术前TTP;G2术前MTT; H1术后1年TTP;H2术后1年MTT |
随访12~78个月,为统一术后随访时间点,均采取术后1年时复查的相关随访内容进行对比;随访的主要内容:a.临床症状改善情况;b.DSA示颈外系统向颅内供血的情况;c.磁共振PWI改善状况。
1.6 统计分析应用SPSS 19软件进行分析,对计量资料采用t检验,计数资料采用Fisher确切概率法,以P < 0.05为有统计学意义。
2 结果本组共21例患者,均为儿童缺血型烟雾病 (年龄 < 16岁),其中7例患者分期行双侧手术治疗,间隔时间9~12个月;术中打开蛛网膜组12例 (18侧), 术中未打开蛛网膜组9例 (10侧)。
2.1 手术12个月后临床症状治疗效果评价 (表 1) 术中蛛网膜打开组的优秀及良好率达88.89%高于未打开组的60%。采用Fisher确切概率法计算出χ2=5.273,P=0.143,尚不能确认术中打开蛛网膜组、术中未打开蛛网膜组两组临床症状,治疗效果评价构成结构差异有统计学意义。
| 组别 | 优秀 | 良好 | 一般 | 差 | 总数 | χ2 | P |
| 术中打开蛛网膜组 | 11 | 5 | 1 | 1 | 18 | 5.273 | 0.143 |
| 术中未打开蛛网膜组 | 2 | 4 | 2 | 2 | 10 | ||
| 总数 | 13 | 9 | 3 | 3 | 28 |
术后1年时复查DSA分级 (表 2、图 2) 术中蛛网膜打开组的良好及一般率达94.44%明显高于未剪开组的60%。
| 组别 | 良好 | 一般 | 差 | 合计 | χ2 | P |
| 术中打开蛛网膜组 | 11 | 6 | 1 | 18 | 6.276 | 0.038 |
| 术中未打开蛛网膜组 | 2 | 4 | 4 | 10 | ||
| 合计 | 13 | 10 | 5 | 28 |
采用Fisher确切概率法计算出χ2=6.276,P=0.038,提示术中打开蛛网膜组、术中未打开蛛网膜两组DSA分级 (侧) 构成结构差异有统计学意义。
术后1年复查磁共振PWI (图 3) 术后1年复查磁共振PWI与术前PWI对比,结合DSA检查发现,DSA分级良好及一般且围手术期未发生并发症的患者PWI均有改善,围手术期发生脑梗塞并发症的2例患者术后PWI均发生恶化。
2.3 并发症两组患者术后围手术期并发症均为脑梗塞,有典型的临床症状表现以及影像学改变 (表 3)。
采用Fisher确切概率法计算出χ2=0.191,P=0.662,术中打开蛛网膜组、术中未打开蛛网膜组两组的并发症构成结构差异无统计学意义。
3 讨论目前烟雾病病因尚不明确,其治疗的主要方式有药物治疗和手术治疗,相关学者研究发现抗凝药物及钙离子拮抗剂等能够短暂改善症状,但是不能有效逆转或者稳定病情;大多学者认为颅内外血管重建术能够有效减少缺血型脑卒中及TIA的发生,在儿童烟雾病手术治疗中目前首选间接颅内外血管重建术[2, 3, 7, 16, 17]。
间接颅内外血管重建术运用于治疗烟雾病的启发来自于神经外科学者发现患者行STA-MAC (颞浅动脉-大脑中动脉搭桥) 术后,颅骨缺损未修补处与脑组织接触的头皮、肌肉、硬膜以及颞浅动脉有新生血管向颅内供血[11, 18];但是在临床大量DSA检查中发现未行颅脑手术破坏颅骨以及硬膜的病人中,很少有颈外血管系统向颅内脑组织新生血管供血的现象;有学者认为蛛网膜是一层屏障能够阻碍颈外血管向颅内生长[8],也有学者认为硬脑膜的内层也是具有屏障作用,对此主张术中剥掉硬脑膜的内层后再贴敷硬膜且术后有良好的血管重建效果[11]。然而Kim等人发现在打开蛛网膜时,牵拉可能导致桥静脉断裂出血的现象,从此就不再打开蛛网膜,在后期随访中发现两组预后无明显差异[9];也有学者认为打开蛛网膜后会导致脑脊液外漏至皮下容易形成皮下积液,故主张在STA-MAC术后应缝合蛛网膜尽量减少脑脊液外漏,但是未对比预后[10]。
Nakamura等[19]学者在动物实验研究发现中认为间接颅内外血管重建术后,在颅内外血管重建吻合初步形成的血管来源于伤口愈合与修复过程中炎症反应的新生结缔组织中;功能性血管再生还需要一个适合的环境和刺激诱导血管扩张,其环境和刺激主要是考虑来自脑缺血环境下诱导生成的相关促血管生长因子。Takahashi等[20]发现儿童患者行间接颅内外血管重建术后疗效优于成人患者行间接颅内外血管重建术,且儿童脑脊液中成纤维细胞生长因子明显高于成人,认为间接颅内外血管重建术后侧枝循环的建立可能与脑脊液中成纤维细胞因子升高有关;目前普遍认同VEGF在血管生成时起重要的作用,在相关研究中也证实烟雾病患者血液及脑脊液中VEGF含量较正常人高[21]。对此相关基础研究表明,烟雾病患者行颅内外血管重建术后有效侧枝循环的建立来自于炎症反应的新生血管以及需要相关血管生长因子的刺激参与,这些因子的产生大多来自于脑组织在缺血环境诱导下产生,其脑脊液中含量较正常人高,同时脑脊液主要位于蛛网膜下腔及脑室内;因此认为蛛网膜的打开可能更有利于提供新生血管形成所需要的相关炎症和因子环境。
本研究通过回顾性分析发现术中蛛网膜打开组与未打开组术后并发症差异无统计学意义,可以认为术中打开蛛网膜并没有增加术后并发症的风险。且蛛网膜打开组与未打开组术后12个月时复查DSA的评价分级差异有统计学意义,说明术中打开蛛网膜组术后侧枝循环的形成优于未打开组。结合PWI与DSA检查发现,DSA复查时分级越好其PWI改善就越明显,说明PWI的改善与颅内外血管重建后的侧枝循环形成相关。
综上所述,打开蛛网膜可以有利于直接打开“屏障”,增加脑组织表面与颞肌、硬膜及颞浅动脉直接接触;增加“创面”利于炎症修复过程中包含血管的相关修复结缔组织增生,进而新生血管增多。而在打开蛛网膜时脑脊液的外流便于颞肌、硬膜及颞浅动脉接触,使其处于一种高成纤维细胞因子、血管内皮生长因子等与血管生成有关细胞因子环境中,这样可能更有利于血管的生成;也有相关研究表发现间接颅内外血管重建术后血管增生最为活跃的时间是3.7个月左右,而在6.3个月时趋向稳定[22],由此表明间接颅内外血管重建术后血管的生成是有时间限制的,而新生血管生成以及融合时需要通过一系列病理生理过程穿越各层组织才能够达到大脑皮层,其中就包括穿越蛛网膜,同样在术中人为的打开蛛网膜可能更利于节省经过病理生理变化来穿越蛛网膜所需的时间,这样在有限的时间内能够有利于更多的新生血管与大脑皮层血管形成融合,因此认为间接颅内外血管重建术中蛛网膜的打开是有必要的。结合本研究随访的临床症状治疗效果、DSA复查的评价以及PWI等,认为术中打开蛛网膜可能有利于改善儿童缺血型烟雾病间接颅脑外血管重建术的疗效。但是本研究尚需在今后的临床研究中增加样本数量,同时对比长期预后的差异,以便于得出更完善的结论。
| [1] | Suzuki J, Takaku A. Cerebrovascular "moyamoya" disease. Disease showing abnormal net-like vessels in base of brain[J]. Arch Neurol, 1969, 20(3): 288–299. DOI:10.1001/archneur.1969.00480090076012 |
| [2] | Research Committee on the P, Treatment of Spontaneous Occlusion of the Circle of W, Health Labour Sciences Research Grant for Research on Measures for Infractable D. Guidelines for diagnosis and treatment of moyamoya disease (spontaneous occlusion of the circle of Willis)[J]. Neurol Med Chir (Tokyo), 2012, 52(5): 245–266. DOI:10.2176/nmc.52.245 |
| [3] | Takanashi J. Moyamoya disease in children[J]. Brain Dev, 2011, 33(3): 229–334. DOI:10.1016/j.braindev.2010.09.003 |
| [4] | Baba T, Houkin K, Kuroda S. Novel epidemiological features of moyamoya disease[J]. J Neurol Neurosurg Psychiatry, 2008, 79(8): 900–904. DOI:10.1136/jnnp.2007.130666 |
| [5] | Choi JU, Kim DS, Kim EY, et al. Natural history of moyamoya disease:comparison of activity of daily living in surgery and non surgery groups[J]. Clin Neurol Neurosurg, 1997, 99(Suppl 2): S11–18. |
| [6] | Ibrahimi DM, Tamargo RJ, Ahn ES. Moyamoya disease in children[J]. Childs Nerv Syst, 2010, 26(10): 1297–1308. DOI:10.1007/s00381-010-1209-8 |
| [7] | Ng J, Thompson D, Lumley JP, et al. Surgical revascularisation for childhood moyamoya[J]. Childs Nerv Syst, 2012, 28(7): 1041–1048. DOI:10.1007/s00381-012-1743-7 |
| [8] | Adelson PD, Scott RM. Pial synangiosis for moyamoya syndrome in children[J]. Pediatr Neurosurg, 1995, 23(1): 26–33. |
| [9] | Kim CY, Wang KC, Kim SK, et al. Encephaloduroarterio-synangiosis with bifrontal encephalogaleo (periosteal) synangiosis in the pediatric moyamoya disease:the surgical technique and its outcomes[J]. Childs Nerv Syst, 2003, 19(5-6): 316–324. DOI:10.1007/s00381-003-0742-0 |
| [10] | Houkin K, Kamiyama H, Takahashi A, et al. Combined revascularization surgery for childhood moyamoya disease:STA-MCA and encephalo-duro-arterio-myo-synangiosis[J]. Childs Nerv Syst, 1997, 13(1): 24–29. DOI:10.1007/s003810050034 |
| [11] | McLaughlin N, Martin NA. Meningeal management for optimal revascularization from middle meningeal artery[J]. J Neurosurg, 2013, 118(1): 104–108. DOI:10.3171/2012.9.JNS112354 |
| [12] | Kapu R, Symss NP, Cugati G, et al. Multiple burr hole surgery as a treatment modality for pediatric moyamoya disease[J]. J Pediatr Neurosci, 2010, 5(2): 115–120. DOI:10.4103/1817-1745.76102 |
| [13] | Sainte-Rose C, Oliveira R, Puget S, et al. Multiple bur hole surgery for the treatment of moyamoya disease in children[J]. J Neurosurg, 2006, 105(6 Suppl): 437–443. |
| [14] | Kim SK, Wang KC, Kim IO, et al. Combined encephalodu-roarteriosynangiosis and bifrontal encephalogaleo (periosteal) synangiosis in pediatric moyamoya disease[J]. Neurosurgery, 2008, 62(6 Suppl 3): 1456–1464. |
| [15] | Matsushima T, Inoue T, Suzuki SO, et al. Surgical treatment of moyamoya disease in pediatric patients-comparison between the results of indirect and direct revascularization procedures[J]. Neurosurgery, 1992, 31(3): 401–405. DOI:10.1227/00006123-199209000-00003 |
| [16] | Kim JS. Moyamoya Disease:Epidemiology, Clinical Features, and Diagnosis[J]. J Stroke, 2016, 18(1): 2–11. DOI:10.5853/jos.2015.01627 |
| [17] | Kawabori M, Kuroda S, Nakayama N, et al. Effective surgical revascularization improves cerebral hemodynamics and resolves headache in pediatric Moyamoya disease[J]. World Neurosurg, 2013, 80(5): 612–619. DOI:10.1016/j.wneu.2012.08.005 |
| [18] | Matsushima Y, Fukai N, Tanaka K, et al. A new surgical treatment of moyamoya disease in children:a preliminary report[J]. Surg Neurol, 1981, 15(4): 313–320. DOI:10.1016/S0090-3019(81)80017-1 |
| [19] | Nakamura M, Imai H, Konno K, et al. Experimental investigation of encephalomyosynangiosis using gyrencephalic brain of the miniature pig:histopathological evaluation of dynamic reconstruction of vessels for functional anastomosis[J]. J Neurosurg Pediatr, 2009, 3(6): 488–495. DOI:10.3171/2008.6.PEDS0834 |
| [20] | Takahashi A, Sawamura Y, Houkin K, et al. The cerebrospinal fluid in patients with moyamoya disease (spontaneous occlusion of the circle of Willis) contains high level of basic fibroblast growth factor[J]. Neurosci Lett, 1993, 160(2): 214–216. DOI:10.1016/0304-3940(93)90416-I |
| [21] | Weinberg DG, Arnaout OM, Rahme RJ, et al. Moyamoya disease:a review of histopathology, biochemistry, and genetics[J]. Neurosurg Focus, 2011, 30(6): E20. DOI:10.3171/2011.3.FOCUS1151 |
| [22] | Kim YI, Phi JH, Paeng JC, et al. In vivo evaluation of angiogenic activity and its correlation with efficacy of indirect revascularization surgery in pediatric moyamoya disease[J]. J Nucl Med, 2014, 55(9): 1467–1472. DOI:10.2967/jnumed.114.142430 |
 2017, Vol. 44
2017, Vol. 44



 ,
,