扩展功能
文章信息
- 牛万祥, 周晨旭, 牛朝诗
- NIU Wan-Xiang, ZHOU Chen-Xu, NIU Chao-Shi
- CYP17A1和AR在脑胶质瘤中的表达及意义
- Expression of CYP17A1 and androgen receptor in glioma and its clinical significance
- 国际神经病学神经外科学杂志, 2017, 44(1): 1-4
- Journal of International Neurology and Neurosurgery, 2017, 44(1): 1-4
-
文章历史
收稿日期: 2016-12-19
修回日期: 2017-02-07
2. 脑功能与脑疾病安徽省重点实验室, 安徽 合肥 230001;
3. 安徽省脑立体定向神经外科研究所, 安徽 合肥 230001
胶质瘤是神经系统发病率最高的肿瘤,约占神经系统肿瘤的40%~50%。由于其恶性增殖和侵袭性生长,复发率高,预后差、死亡率高。无论是手术治疗,还是放疗、化疗,都难以彻底治愈。因此,胶质瘤的治疗仍为医学难题之一。流行病学研究表明,脑胶质瘤患者中男女发病率的比例达到1.5~2:1[1-3],有明显的性别差异。近年来,在有性别差异的恶性肿瘤研究中,发现雄激素轴发挥了重要的作用。细胞色素P450c17a酶 (CYP17A1) 和雄激素受体 (androgen receptor,AR) 是雄激素轴的重要组成部分。本课题组前期就胶质瘤患者血清睾酮浓度进行了相关研究,结果表明男女胶质瘤患者术前明显高于对照组,术后相对于对照组血清睾酮浓度降低更为明显,且女性胶质瘤患者血清睾酮浓度变化更为明显[4]。为进一步探讨雄激素合成关键酶CYP17A1及其受体AR在胶质瘤中作用,本研究通过免疫组化的方法检测CYP17A1蛋白和AR蛋白在胶质瘤中表达情况,并分析三者之间的关系,探讨雄激素轴在胶质瘤中的作用。
1 材料与方法 1.1 一般材料收集2014年6月~2015年12月间安徽医科大学附属省立医院收治的55例脑胶质瘤手术切除标本,术前均未行放、化治疗,经病理确诊,有详细的临床和病理资料。根据WHO2007中枢神经系统肿瘤分类标准进行组织学分类及分级:WHOⅠ级2例,WHOⅡ24例,WHOⅢ11例,WHOⅣ18例,另外10列正常脑组织标本取自颅脑损伤行内减压术的患者,术后病理检查证实为正常脑组织无胶质细胞增生及坏死。本研究所用组织标本为经10%中性福尔马林标本固定液固定,常规石蜡包埋,4 μm厚连续切片5张,编码。
1.2 主要试剂山羊抗人CYP17A1多克隆抗体 (美国Santa Cruz公司CYP17A1抗体N-17: sc-46084),小鼠抗人AR单克隆抗体 (美国Santa Cruz公司AR抗体441: sc-7305),山羊超敏二步法免疫组化检测试剂盒 (PV-9003),小鼠超敏二步法免疫组化检测试剂盒 (PV-9002),二氨基联苯胺 (diaminobenzidine,DAB) 显色试剂盒 (北京中杉金桥生物技术有限公司)。
1.3 免疫组织化学染色二步法石蜡切片经脱蜡、水化。抗原修复采用微波修复 (高火5分钟至沸腾,室温冷却),进行3% H2O2去离子水孵育10分钟,以阻断内源性过氧化物酶。PBS冲洗2分钟×3次,滴加CYP17A1/AR一抗 (1:300稀释),4℃过夜。PBS冲洗2分钟×3次,滴加聚合物辅助剂,室温孵育10~20分钟。PBS冲洗2分钟×3次,滴加辣根酶标记抗山羊/小鼠IgG聚合物,室温孵育10~20分钟。PBS冲洗2分钟×3次,应用DAB溶液显色2~5 min。自来水充分冲洗,苏木素复染1~2 min,脱水,透明,封片。阴性对照组以PBS代替一抗。
1.4 结果判断400倍光镜下观察,随机选取切片5个视野,计数1000个细胞中阳性染色细胞,阳性细胞率=(阳性表达细胞数/1000)×100%。无阳性细胞或阳性细胞数 < 1%为阴性 (-),1 %~25%为弱阳性 (+),26 %~50%为阳性 (++),> 50%强阳性 (+++) [5]。
1.5 统计方法使用SPSS 22.0软件进行统计学处理。采用卡方检验进行数据分析,等级资料的相关性采用Spearman秩和检验,P < 0.05为差异有统计学意义。
2 结果 2.1 CYP17A1蛋白在胶质瘤组织中表达情况免疫组化检测CYP17A1蛋白表达,显示在胶质瘤各病理级别标本均呈阳性表达,正常脑组织不表达。且CYP17A1蛋白的表达在高级别胶质瘤标本 (WHOⅢ级和WHOⅣ级) 和低级别胶质瘤标本 (WHOⅠ级和WHOⅡ级) 间有统计学差异 (χ2=12.034,P < 0.05)。经Spearman相关分析,CYP17A1蛋白的表达与病理级别呈正相关 (r=0.705,P < 0.05),具体内容见图 1,表 1、2。
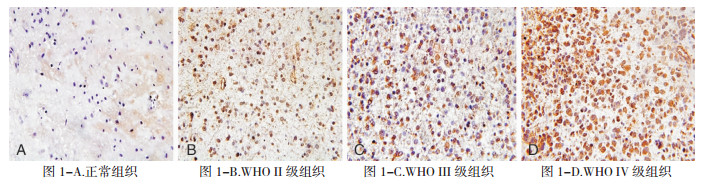
|
| 图 1 CYP17A1蛋白在正常及脑胶质瘤组织中的表达 (免疫组化,×400)。 |
| 病理级别 | n | CYP17A1蛋白的表达 | ||||
| 阴性 | 弱阳性 | 阳性 | 强阳性 | 阳性细胞率 (%) | ||
| 正常 | 10 | 10 | 0 | 0 | 0 | - |
| Ⅰ级 | 2 | 0 | 1 | 1 | 0 | 27±5.7 |
| Ⅱ级 | 24 | 0 | 8 | 11 | 5 | 38.2±19.3 |
| Ⅲ级 | 11 | 0 | 0 | 7 | 4 | 58.2±14.1 |
| Ⅳ级 | 18 | 0 | 1 | 5 | 12 | 50.2±18.6 |
| 病理级别 | n | CYP17A1蛋白的表达 | ||||
| 阴性 | 弱阳性 | 阳性 | 强阳性 | 阳性细胞率 (%) | ||
| 低级别 | 26 | 0 | 9 | 12 | 5 | 36.5±17.8 |
| 高级别 | 29 | 0 | 1 | 12 | 16 | 51.5±17.7 |
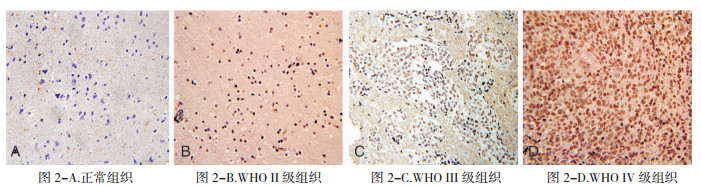
|
| 图 2 AR蛋白在正常及脑胶质瘤组织中的表达 (免疫组化,×400)。 |
免疫组化检测AR蛋白在胶质瘤各病理级别标本均呈阳性表达,正常脑组织不表达。且AR蛋白的表达在高级别 (WHOⅢ级和WHOⅣ级) 胶质瘤标本和低级别 (WHOⅠ级和WHOⅡ级) 胶质瘤标本间有统计学差异 (χ2=19.509,P < 0.05)。经Spearman相关分析,AR蛋白的表达与病理级别呈正相关 (r=0.73,P < 0.05),具体内容见图 2,表 3、4。
| 病理级别 | n | CYP17A1蛋白的表达 | ||||
| 阴性 | 弱阳性 | 阳性 | 强阳性 | 阳性细胞率 (%) | ||
| 正常 | 10 | 10 | 0 | 0 | 0 | - |
| Ⅰ级 | 2 | 1 | 1 | 0 | 0 | 6.3±3.4 |
| Ⅱ级 | 24 | 5 | 8 | 11 | 0 | 15.4±11.3 |
| Ⅲ级 | 11 | 0 | 1 | 7 | 3 | 46.5±16.1 |
| Ⅳ级 | 18 | 1 | 2 | 5 | 10 | 57.4±21.6 |
| 病理级别 | n | CYP17A1蛋白的表达 | ||||
| 阴性 | 弱阳性 | 阳性 | 强阳性 | 阳性细胞率 (%) | ||
| 低级别 | 26 | 6 | 9 | 11 | 0 | 13.5±10.8 |
| 高级别 | 29 | 1 | 3 | 12 | 13 | 53.3±19.5 |
CYP17A1全称为cytochrome P450, family 17, subfamily A, Polypeptide 1(细胞色素P450c17),基因位于第10号染色体 (10q24.3),也被称为17α-羟化酶,17、20-裂解酶。主要定位于细胞内质网及微粒体,是胆固醇合成睾酮过程中的两个关键酶。研究表明CYP17A1的多态性与一些性别相关恶性肿瘤的发生发展密切相关[6]。
AR是雄激素轴中重要的受体,主要表达于细胞核内。AR基因定位于X染色体 (Xql1.2-12),并通过与靶基因结构上特殊的序列结合,即与雄激素反应元件 (androgen response element,ARE) 结合,进一步调控靶基因的表达[7]。在一些恶性肿瘤的研究中,AR的表达是这些恶性肿瘤的发生发展及性别差异的重要原因[8, 9]。Ceccarelli等[10]研究发现加入雄激素的培养基能促进胶质瘤细胞的增殖。Hopewell等[11]应用3,4-苯芘并诱导脑胶质瘤大鼠模型的研究中发现,雄性大鼠胶质瘤诱导成功率为77.8%,而对照组去势雄性大鼠胶质瘤诱导率明显低下,仅为50%,且对照组的中位生存期也明显延长。裸鼠皮下胶质瘤模型研究[12]也得出相似的结果,雄性裸鼠肿块生长速度明显快于雌性裸鼠。本课题组前期研究发现胶质瘤患者血清睾酮浓度明显高于对照组[4],雄激素受体在胶质瘤组织中呈过表达状态,且睾酮受体的表达与胶质瘤的级别呈正相关[13]。
本研究发现CYP17A1蛋白和AR蛋白在脑胶质瘤组织中表达明显高于正常组织,且CYP17A1蛋白和AR蛋白表达情况随着胶质瘤病理级别的增高而增强。说明胶质瘤能通过过表达CYP17A1蛋白等睾酮合成过程中的关键酶,增加的睾酮底物向睾酮的转化,从一个方面解释了胶质瘤患者血清睾酮水平高于正常人平均水平[4]。而在一些性别相关恶性肿瘤的研究中发现,雄激素能促进AR蛋白的表达[14]。由此推测胶质瘤细胞过量转化的睾酮等雄激素可能进一步促进了AR等雄激素受体的表达。而过表达的AR等雄激素受体,可能又增强了雄激素对胶质瘤细胞的多种生物学作用。在前列腺癌的研究中发现,雄激素与AR结合,进一步激活了Src/Raf/ERK信号传导通路,有效的维持了前列腺癌细胞的致瘤性[15]。本课题研究结果发现胶质瘤组织内雄激素合成的关键酶CYP17A1与雄激素受体AR二者均呈阳性表达,且表达与病理级别密切相关,提示胶质瘤组织内存在着睾酮-睾酮受体自分泌环路,并与胶质瘤的发生发展及预后有着密切的联系。
综上所述,CYP17A1蛋白和AR蛋白在胶质瘤组织中的表达明显升高,且随病理级别升高而表达增强,表明胶质瘤内部的雄激素轴与胶质瘤的发生有着密切的联系。但是,雄激素轴在脑胶质瘤中的作用通路仍需进一步研究。这将为胶质瘤的内分泌治疗与临床诊断展开了新的道路。
| [1] | Lönn S, Klaeboe L, Hall P, et al. Incidence trends of adult primary intracerebral tumors in four Nordic countries[J]. Int J Cancer, 2004, 108(3): 450–455. DOI:10.1002/ijc.v108:3 |
| [2] | Mckinley BP, Michalek AM, Fenstermaker RA, et al. The impact of age and sex on the incidence of glial tumors in New York state from 1976 to 1995[J]. J Neurosurgery, 2000, 93(6): 932–939. DOI:10.3171/jns.2000.93.6.0932 |
| [3] | Cowppli-Bony A, Bouvier G, Rué M, et al. Brain tumors and hormonal factors:review of the epidemiological literature[J]. J Cancer Causes Control, 2011, 22(5): 697–714. DOI:10.1007/s10552-011-9742-7 |
| [4] | 周敏, 牛朝诗, 鲍得俊, 等. 脑胶质瘤患者手术前后血清睾酮水平的变化[J]. 中华实验外科杂志, 2015(6): 1429–1431. |
| [5] | 秦国强, 王淳良, 梅金红, 等. 性激素受体在良恶性脑膜瘤中的表达及意义[J]. 南昌大学学报, 2009, 49(6): 65–67. |
| [6] | Hamada A, Danesi R, Price D K, et al. Association of a CYP17 polymorphism with overall survival in Caucasian patients with androgen-independent prostate cancer[J]. J Urology, 2007, 70(2): 217–220. DOI:10.1016/j.urology.2007.06.1097 |
| [7] | Kanda T, Xia J, Yokosuka O. Androgen receptor signaling in hepatocellular carcinoma and pancreatic cancers[J]. World J Gastroenterol, 2014, 20(28): 9229–9236. |
| [8] | Yeh SH, Chen PJ. Gender disparity of hepatocellular carcinoma:the roles of sex hormones[J]. J Oncology, 2010, 78 Suppl 1(1): 172–179. |
| [9] | Culig Z. Androgen Receptor Coactivators in Regulation of Growth and Differentiation in Prostate Cancer[J]. J Cell Physiol, 2016, 231(2): 270–274. DOI:10.1002/jcp.v231.2 |
| [10] | Ceccarelli I, Rossi A, Maddalena M, et al. Effects of morphine on testosterone levels in rat C6 glioma cells:Modulation by anastrozole[J]. J Cell Physiol, 2009, 221(1): 1–4. DOI:10.1002/jcp.v221:1 |
| [11] | Hopewell J W. The Effects of Castration on the Induction of Experimental Gliomas in Male Rats[J]. Br J Cancer, 1970, 24(1): 187–190. DOI:10.1038/bjc.1970.21 |
| [12] | Kabat GC, Etgen AM, Rohan TE. Do steroid hormones play a role in the etiology of glioma?[J]. Cancer Epidemiol Biomarkers Prev, 2010, 19(19): 2421–2427. |
| [13] | 鲍得俊, 牛朝诗, 程传东, 等. 雄激素受体在脑胶质瘤中的表达及意义[J]. 中国微侵袭神经外科杂志, 2014(6): 277–279. |
| [14] | Takeda H, Nakamoto T, Kokontis J, et al. Autoregulation of androgen receptor expression in rodent prostate:Immunohistochemical and in situ hybridization analysis[J]. Biochem Biophys Res Commun, 1991, 177(1): 488–496. DOI:10.1016/0006-291X(91)92010-H |
| [15] | Heinlein CA, Chang C. Androgen receptor in prostate cancer[J]. Endocr Rev, 2004, 25(2): 276–308. DOI:10.1210/er.2002-0032 |
 2017, Vol. 44
2017, Vol. 44




