扩展功能
文章信息
- 卞育婕, 刘俊杰, 付程凯, 赵雅宁, 刘仁杰, 刘胜冬, 徐继伟, 李建民, 田景瑞
- BIAN Yu-Jie, LIU Jun-Jie, FU Cheng-Kai, ZHAO Ya-Ning, LIU Ren-Jie, LIU Sheng-Dong, XU Ji-Wei, LI Jian-Min, TIAN Jing-Rui
- 依达拉奉对SAH大鼠JNK信号通路及海马区神经细胞自噬的影响
- Effects of Edaravone on JNK signaling pathway and neuronal autophagy in the hippocampus in SAH rats
- 国际神经病学神经外科学杂志, 2016, 43(6): 531-535
- Journal of International Neurology and Neurosurgery, 2016, 43(6): 531-535
-
文章历史
收稿日期: 2016-09-25
修回日期: 2016-11-23
2. 华北理工大学护理与康复学院, 河北唐山 063000;
3. 华北理工大学, 附属医院神经外科, 河北唐山 063000;
4. 华北理工大学基础医学院, 河北省慢性疾病重点实验室, 唐山市慢性病临床基础研究重点实验室, 河北唐山 063000
2. Nursing and Rehabilitation Institute of North China University of Science and Technology, HeBei TangShan 063000;
3. Department of Neurosurgery, the Affilated Hospital, HeBei TangShan 063000;
4. Basical Medicine Institute of North China University of Science and Technology, Key laboratory of chronic disease in HeBei province, TangShan chronic disease clinical basic research key laboratory; HeBei TangShan 063000
蛛网膜下腔出血(Subarachnoid hemorrahge, SAH) 具有极高的病死率、致残率[1]。最新文献报道,SAH后早期存在自噬的异常激活[2]。自噬在调控SAH神经元生与死的平衡中发挥重要作用,适度的自噬可以保护神经元,而过度的自噬导致神经元发生Ⅱ型程序性死亡[3-4]。因此,目前针对SAH后自噬的早期药物干预逐渐受到重视。依达拉奉(Edaravone) 是一种强效的自由基清除剂,2004年在日本上市,目前已应用于SAH的临床治疗。前期研究发现,依达拉奉治疗后可弱化SAH后神经元自噬的激活,但其具体作用机制尚未阐明。自噬的激活涉及多种复杂的分子机制,例如,MAPK、ERK、P38、JNK等均与自噬的激活存在一定关系[5], 其中JNK通路与自噬联系最为密切,现正逐渐成为研究热点[6]。本实验拟选定JNK信号通路,观察Edaravone是否可以通过调节JNK信号通路影响SAH大鼠海马区神经元自噬的活性,从而进一步明确依达拉奉的药理学机制。
1 材料与方法 1.1 实验动物及分组雄性清洁级健康SD大鼠(体重范围350~450g)40只,购于北京维通利华公司,许可证号SCXK (京)2012-0001。随机等分为假手术组(Sham组)、蛛网膜下腔出血模型组(SAH组)、依达拉奉治疗组(Edaravone组)、JNK抑制剂组(SP600125组),术前禁食水12h。
1.2 试剂与仪器兔抗Beclin-1、LC3-Ⅱ、p-JNK单克隆抗体(美国Abcam公司);PBS缓冲液、枸橼酸盐缓冲液、DAB显色试剂盒(北京中杉金桥生物技术有限公司);二甲亚砜溶剂(DMSO)(美国Sigma公司);GADPH (武汉博士德生物工程有限公司);OLYMPUS摄像显微镜(日本奥林巴斯公司);图像采集及分析系统(北京航空航天大学);Gel-Doc凝胶成像分析系统(美国Bio-Rad公司)。
1.3 SAH大鼠模型制作及给药方法动物模型的制备:采用Bederson等[7]报道的血管内穿刺法并加以改良制作SAH模型[8],大鼠10%水合氯醛麻醉(350 mg/kg体重),取颈部正中切口,显微镜下暴露右侧颈总动脉主干及其分叉处,分离颈外动脉后切断结扎。动脉夹分别夹闭颈总动脉和颈内动脉,将4-0穿刺线经颈外动脉残端插入颈内动脉,松开颈总动脉上的动脉夹,将尼龙线向颅内插入造成SAH大鼠模型。Sham组在当穿刺线刺入感到阻力时退出,不刺破大脑前动脉与大脑中动脉分叉,其余步骤同实验组。麻醉清醒后,单笼饲养。Edaravone组腹腔给药干预,SAH造模后5 mg/kg腹腔注射,12 h后重复给药一次直至24 h处死。SP600125组使用大鼠脑立体定位仪,在造模前30 min给予脑室3 μg/μl SP600125溶液10 μl。
1.4 HE染色每组取5只大鼠,于造模成功后24小时处死,4%多聚甲醛灌注取脑,常规石蜡包埋,切片;梯度酒精水化,行HE染色,脱水、封片。每只大鼠海马CA1区取6个不完全重叠的视野,在光学显微镜(40×10倍) 下观察细胞形态。应用Motic-6.0图像采集及图像分析系统观察计数高位视野下的存活与坏死神经细胞数。
1.5 免疫组化切片常规脱蜡至水,高压热修复90S,3%H2O2封闭内源性过氧化氢酶,分别滴加p-JNK、LC3-Ⅱ、Beclin-1(均1:200稀释),4 ℃过夜,滴加二抗(1 :400),37 ℃孵育30min,DAB显色,苏木素复染细胞核,梯度酒精脱水、透明、中性树胶封片。PBS代替一抗做阴性对照。每只大鼠每个因子取出5张切片待测,其中每张切片定位海马CA1区在该区域用400倍光镜下随机抽取5个不完全重叠视野,在Olymapus显微镜(400×10) 中观察海马CA1区阳性细胞的变化,以胞核、胞浆或胞膜呈浅褐色为入选标准。并计数(40×10) 倍视野下的阳性细胞数量。
1.6 Western-blot实验24小时后断头,冰上取脑, 液氮研磨总提取蛋白, BCA法测定总蛋白浓度,计算待测品蛋白浓度的上样量。制备分离胶(12%) 浓缩胶(5%), 电泳:浓缩胶80 MV 30 min,分离胶100 mV 60 min。电泳之后再100 mA 45 min冰浴转膜。10%脱脂牛奶抗原封闭,一抗(1 :1000)4度冰箱过夜。次日1xTBST室温摇床5 min 3次,二抗(1 :3000) 室内摇床孵育2 h。TBST洗膜,采用增强化学发光法(ECL) 法显影目标条带。测定每个因子各时间点对应条带的灰度值,GAPDH做内参照,用Image Lab 5.0测对条带进行分析,将目标蛋白与GAPDH的灰度值的比值作为对各因子各时间点相对的表达量做分析数据。
1.7 统计学分析采用Excel建立数据库,SPSS统计软件进行数据分析,各项数据均以均数±标准差(x±s) 表示,组间比较采用单因素方差分析(one way, ANOVA), SNK法(student newman kenults, SNK) 进行两两比较,P < 0.05表示差异有统计学意义。
2 结果 2.1 HE染色结果Sham组大鼠脑组织结构规整,海马区神经细胞形态正常,数目多、排列有序、细胞核无固缩碎裂溶解,核仁明显。与Sham组相比,SAH组海马区神经细胞数量明显减少,形态不规则(P < 0.05);核固缩、碎裂、溶解;神经元细胞肿胀坏死形成空泡状结构,最终导致神经细胞大量损伤;与SAH组相比,Edaravone组神经细胞数量均较SAH明显增多、形态接近正常(P < 0.05), SP600125组神经元细胞损伤有所改善,细胞形态较规整、数量增多, (P < 0.05)。见图 1。细胞计数分析见表 1。
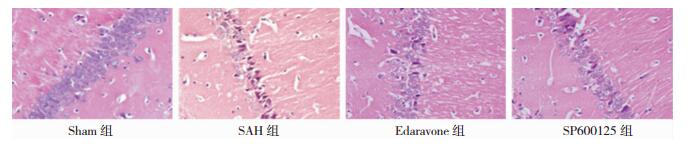
|
| 图 1 各组大鼠海马区神经元形态(HE×400) |
| 分组 | n | 存活细胞数量 |
| Sham组 | 5 | 132.74±2.18 |
| SAH组 | 5 | 70.52±2.78* |
| Edaravone组 | 5 | 76.87±2.56# |
| SP600125组 | 5 | 79.55±2.48# |
| F值 | 790.239 | |
| P | 0.000 | |
| 注:*P < 0.05,与Sham组相比;#P < 0.05,与SAH相比; | ||
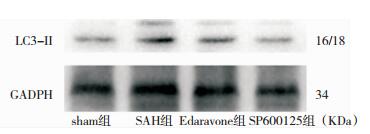
免疫组化分析:Beclin-1、LC3-Ⅱ蛋白主要表达于细胞胞质,阳性细胞胞质中可见大量棕褐色颗粒。与Sham组比较,SAH组阳性细胞数量明显增多(P < 0.05);与SAH组比较,Edaravone组和SP600125组阳性细胞数量显著降低(P < 0.05),但仍高于Sham组。见图 2、图 3、表 2。Western-Blot定量分析:与Sham组比较,SAH组Beclin-1表达量明显增高(P < 0.05);与SAH组相比,Edaravone组、SP600125组其表达量显著下降,但表达量仍高于Sham组(P < 0.05)。与Sham组比较,SAH组LC3-Ⅱ表达量明显增高(P < 0.05);与SAH组相比,Edaravone组、SP600125组表达量显著下降,表达量高于Sham组(P < 0.05)。见图 4、图 5、表 3。
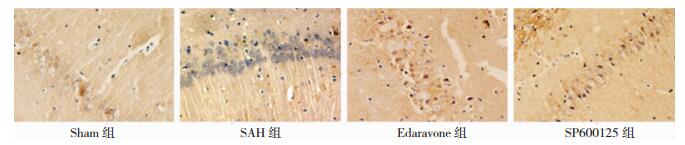
|
| 图 2 各组SD大鼠海马区神经元Beclin-1的表达(免疫组化×400) |
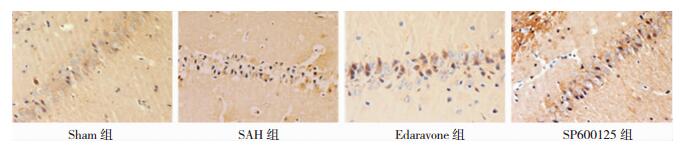
|
| 图 3 各组SD大鼠海马区神经元LC3Ⅱ的表达(免疫组化×400) |
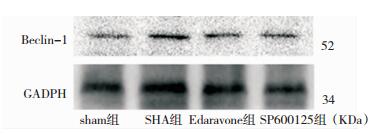
|
| 图 4 各组SD大鼠海马Beclin-1蛋白Western blotting表达结果(24h) |
|
| 图 5 各组SD大鼠海马LC3-Ⅱ蛋白Western blotting表达结果(24h) |
| 分组 | Beclin-1 | LC3Ⅱ | p-JNK |
| Sham组 | 23.86±1.51 | 13.15±0.76 | 0.71±0.35 |
| SAH组 | 47.73±2.48* | 42.13±3.26* | 28.55±3.05* |
| Edaravone组 | 40.05±2.58# | 35.23±3.59# | 24.80±3.17# |
| SP600125组 | 42.33±2.42# | 34.55±2.75# | 20.12±2.55# |
| F值 | 120.934 | 119.463 | 155.104 |
| P | 0.000 | 0.000 | 0.000 |
| 注:*P < 0.05,与Sham组相比;#P < 0.05,与SAH相比; | |||
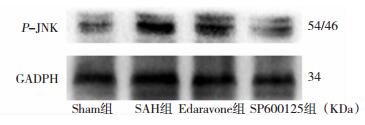
| Group | Beclin-1 | LC3-Ⅱ | p-JNK |
| Sham组 | 0.0713±0.0053 | 0.0716±0.0062 | 0.0612±0.0065 |
| SAH组 | 0.6426±0.0410* | 0.5619±0.0325* | 0.5618±0.0425* |
| Edaravone组 | 0.5412±0.0539# | 0.4326±0.0621# | 0.4415±0.0563# |
| SP600125组 | 0.5117±0.0558# | 0.4516±0.0528# | 0.4283±0.0494# |
| F值 | 199.129 | 140.681 | 150.823 |
| P值 | 0.000 | 0.000 | 0.000 |
| 注:*P < 0.05,与Sham组相比;#P < 0.05,与SAH相比 | |||
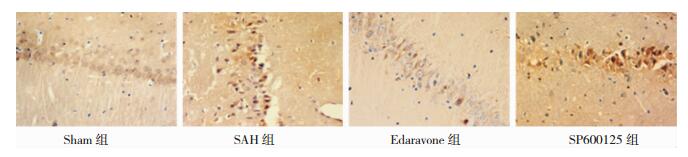
阳性磷酸化JNK主要定位于细胞核,少数表达在细胞浆。阳性细胞可见浅褐色颗粒。Sham组大鼠阳性细胞数目较少,与Sham组比较,SAH组p-JNK蛋白阳性细胞数量较多,(P < 0.05)。与SAH组比较,Edaravone组、SP600125组p-JNK蛋白阳性细胞表达量均减少,(P < 0.05)。见图 6、表 2.Western-blot定量分析:Sham组p-JNK蛋白微弱表达,(P < 0.05);与Sham组相比,SAH组p-JNK蛋白表达量明显增加,差异有统计学意义(P < 0.05);与SAH组相比,Edaravone组、SP600125组p-JNK蛋白表达量均降低,但仍维持较高水平表达,高于Sham组,(P < 0.05)。图 7、表 3。
|
| 图 6 各组SD大鼠海马区神经元P-JNK的表达(免疫组化×400) |
|
| 图 7 各组SD大鼠海马P-JNK蛋白Western blotting表达结果(24h) |
本研究结果发现,Edaravone治疗后可明显增加SAH大鼠海马区神经元存活数量, Edaravone可能起到一定的神经保护作用。彭秉纲等[9, 10]应用Edaravone对脑出血患者治疗后发现神经功能有较好的改善;蔡谋善等[11]应用Edaravone联合丹参川芎嗪治疗急性脑梗死患者发现,其神经功能缺损程度和日常生活能力均有明显改善。近年来Edaravone在SAH的治疗中也有一定的应用, 并取得良好疗效。我们的研究与此一致,依达拉奉可减少神经元的损伤,起到一定的神经保护与神经修复作用。
自噬(Autophagy),又叫做Ⅱ型程序性细胞死亡,研究显示多种疾病的病理生理过程均有自噬的激活,但是自噬的作用尚未完全统一,目前学术界一致认为自噬是一把双刃剑,适度的自噬可以促进细胞的存活,而过度的自噬则加速细胞的死亡[3-4]。本实验前期发现,自噬途径在SAH早期即被激活,并在24h时最强。
本实验选择于SAH后24h处死大鼠并发现,而应用Edaravone干预后,自噬蛋白的水平显著下降,结合病理学结果分析, SAH早期病理生理学过程可能存在自噬的过度激活,Edaravone治疗后可能把自噬抑制在适度的水平,从而起到神经保护作用。周波等[12]构建帕金森小鼠模型, 应用Edaravone治疗发现小鼠海马区细胞内Beclin-1、LC3-Ⅱ蛋白表达水平明显降低,神经细胞死亡数量减少,有效抑制自噬、发挥神经保护的作用, 本实验结果与此一致,因此,我们认为Edaravone能够有效抑制自噬的活性,从而保护脑部神经元。自噬的激活涉及到细胞内外复杂的分子调控机制。有文献报道,JNK通路与自噬关系密切[13]。本研究结果发现,Edaravone干预后p-JNK的含量明显下降,而与SP600125干预后无显著差异,提示Edaravone可能对JNK信号通路起到一定的抑制作用。大量的氧自由基可能激活JNK通路,诱导细胞自噬、凋亡系统紊乱,最终导致神经细胞死亡。如前所述,Edaravone可以抑制体内的脂质过氧化反应,清除氧自由基抑制炎症介质的形成,进而抑制了JNK信号通路的激活,下调自噬水平,减少SAH后自噬带来的神经元损伤。我们的结果认为,这可能是Edaravone的神经保护机制。
综上述,Edaravone可能通过抑制JNK信号通路,降低神经细胞自噬的活性,从而起到一定的神经保护作用。但是Edaravone不仅仅依赖于此途径发挥保护作用,我们的研究只是冰山一角,Edaravone更为广泛的药理学机制有待同仁更加深入的研究。
| [1] | Gao Y, Ding XS, Xu S, et al. Neuroprotective effects of edaravone on early brain injury in rats after subarachnoid hemorrhage. Chin Med J (Engl), 2009, 122(16): 1935–1940. |
| [2] | 郝小可, 史继新. 蛛网膜下腔出血后早期脑损伤机制研究进展. 医学研究生学报, 2015, 12(7): 767–770. |
| [3] | Uekawa K, Hasegawa Y, Ma M, et al. Rosuvastatin ameliorates early brain injury after subarachnoid hemorrhage via suppression of superoxide formation and nuclear factor-kappa B activation in rats. J Stroke Cerebrovasc Dis, 2014, 23(6): 1429–1439. DOI:10.1016/j.jstrokecerebrovasdis.2013.12.004 |
| [4] | Wang Z, Shi XY, Yin J, et al. Role of autophagy in early brain injury after experimental subarachnoid hemorrhage. J Mol Neurosci, 2012, 46(1): 192–202. DOI:10.1007/s12031-011-9575-6 |
| [5] | 覃芳, 张智博. JNK信号通路与自噬的研究进展. 中南大学学报(医学版), 2015, 40(9): 1035–1038. |
| [6] | Lee S, Lee SJ, Coronata AA, et al. Carbon monoxide confers protection in sepsis by enhancing beclin-1 dependent autophagy and phagocytosis. Antioxid Redox Signal, 2014, 20(3): 432–442. DOI:10.1089/ars.2013.5368 |
| [7] | Bederson JB, Germano IM, Guarino L. Cortical blood flow and cerebral perfusion pressure in a new noncraniotomy model of subarachnoid hemorrhage in the rat. Stroke, 1995, 26(6): 1086–1091. DOI:10.1161/01.STR.26.6.1086 |
| [8] | 尹风任, 史学芳, 扈玉华, 等. 改良血管穿刺法大鼠蛛网膜下腔出血模型的制作及评价. 中华实验外科杂志, 2008, 25(8): 975–977. |
| [9] | 彭秉纲, 苏赤, 肖彧, 等. 依达拉奉对急性脑出血患者自由及含量的影响及临床效果探讨. 临床医学工程, 2016, 2(35): 633–634. |
| [10] | 滕秀涵. 依达拉奉治疗脑出血患者的临床疗效. 中国药物经济学, 2016, 11(4): 62–63. |
| [11] | 蔡谋善, 黄肖群, 沈春林, 等. 依达拉奉联合丹参川芎嗪注射液治疗急性脑梗死的疗效及对C-反应蛋白的影响. 中国医药导报, 2012, 9(7): 95–96. |
| [12] | 周波, 文敏, 王赟, 等. 依达拉奉对帕金森病小鼠模型中脑细胞自噬的影响. 山东大学学报(医学版), 2012, 50(8): 1–4. |
| [13] | Luo S, Rubinsztein DC. BCL2L11/BIM:a novel molecular link between autophagy and apoptosis. Autophagy, 2013, 9(1): 104–105. DOI:10.4161/auto.22399 |
 2016, Vol. 43
2016, Vol. 43



 ,
,