扩展功能
文章信息
- 吴海权, 王进钢
- WU Hai-Quan, WANG Jing-Gang
- H19在多形性胶质母细胞瘤中的表达及对细胞系增殖、侵袭的影响
- Expression of H19 in glioblastoma multiforme and its effect on cell proliferation and invasion
- 国际神经病学神经外科学杂志, 2016, 43(6): 521-525
- Journal of International Neurology and Neurosurgery, 2016, 43(6): 521-525
-
文章历史
收稿日期: 2016-10-20
修回日期: 2016-12-12
胶质瘤是颅内发病率最高的原发性恶性肿瘤,约占中枢神经系统肿瘤的44%[1]。很多胶质瘤病灶位于功能区,手术容易引起偏瘫甚至昏迷,肿瘤细胞侵袭性强,即算在高倍显微镜下全切除肿瘤,肿瘤细胞也难免遗留,复发难以避免。因为血脑屏障的存在,即算抗癌药对正常脑组织产生不可逆损害的剂量仍难以杀灭肿瘤细胞[2]。而多形性胶质母细胞瘤(GBM) 又是恶性程度最高的胶质细胞瘤,预后更差。肿瘤分子标记物的研究对胶质瘤的诊断、治疗和预后以及靶向治疗治疗非常有益[3]。所以,探索GBM的基因治疗意义重大。研究认为, 异常的microRNA表达是人类胶质细胞瘤的一个特点[4]。H19位于染色体11P15.5,H19基因已证明对人类肿瘤的生长起重要作用[5, 6]。但是, H19在胶质细胞瘤的发病机理尚不十分清楚, 有待进一步研究[7]。我们发现上调H19能促进GBM的增殖、侵袭、迁移,抑制凋亡,增加了细胞S期细胞比例。H19的致癌基因可以作为潜在的GBM治疗的目标基因。
1 材料和方法 1.1 材料标本及细胞株来源于广州医科大学附属第二医院,平均年龄40.75岁,男10例,女8例。均经石蜡病理确诊GBM。另18例正常的脑组织标本源自颅脑损伤内减压术患者。人GBM细胞系U87-MG、U87-GFP、U87-H19购自中国医学科学院上海分院。(生物学研究获得患者或家属签字同意,并获得广州医科大学附属第二医院伦理委员会批准)
1.2 qPCR array技术检测GBM基因表达从GBM细胞中提取RNA, 使用试剂盒(表达载体) 转染后, 检测细胞, 逆转录(RT) 用ABI StepOne来放大反应, 实时荧光定量PCR, PCR数据分析。
1.3 CCK-8法检测U87细胞增殖1) U87-MG、U87-GFP、U87-H19 GBM细胞接种在96孔板,在接种后的12、24、36、48、60小时后加入CCK-8试剂,孵育4小时.在酶标仪上测吸光度。
1.4 Transwell侵袭试验检测GBM细胞的侵袭能力和迁移能力在Transwell小室上层铺Matrigal,将对数生长期U87-MG、U87-GFP、U87-H19GBM细胞滴入上层,为5×104,细胞在37℃下孵化24小时,移除非侵入性细胞,用托马斯亮蓝对小室下层染色,拍照,并随机取5个视野,计算平均值并作比较。
1.5 流式检测U87细胞周期和凋亡U87-MG、U87-GFP、U87-H19GBM细胞用PBS培养、EDTA胰酶,孵化,小心吹击、离心,用冷PBS和重悬细胞洗两次,在室温下黑暗中孵化30分钟,Propidium Iodide染色,收集到缓冲管, 用流式细胞仪检测,计数2~3万个细胞,细胞用流式细胞仪进行分析。
1.6 Western BlottingWestern blot法检测U87-MG、U87-GFP、U87-H19GBM细胞的蛋白表达水平。培养液调整细胞数(2×106) 洗两次冰冷的PBS, 细胞溶解在0.5毫升的裂解缓冲。电泳, 转膜,TBST洗膜,辣根的过氧化物酶标记的二抗于37℃孵化1小时。与TBST洗涤后, 记录X射线图象,用β-actin作内参照。
1.7 统计学分析所有实验数据均采用SPSS 13.0统计软件进行分析处理。比较采用单因素方差分析的方法(one-way ANOVA)。P < 0.05具有统计学的意义。
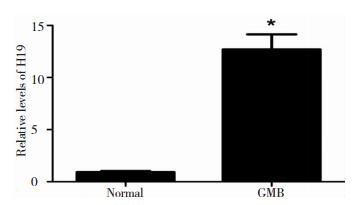
2 结果 2.1 H19在GBM和正常细胞的表达qPCR检测H19在GBM表达:H19在GBM高表达,P < 0.05, 有显著性差异。如图 1所示
|
| 图 1 H19在GBM和正常细胞的表达所绘制生成柱状图。 |
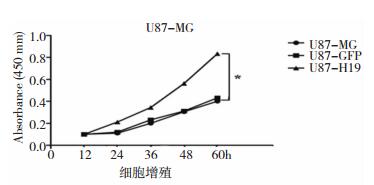
CCK-8检测U87 GBM增殖:过表达H19的U87 GBM细胞增殖24 h、48 h较对照组细胞的增殖明显增高,P < 0.05,有显著性差异。如图 2.1所示
|
| 图 2.1 各组细胞在GBM增殖影响所绘制生成曲线图 |
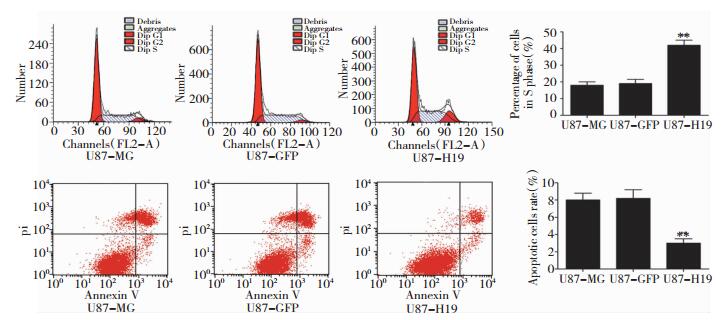
流式细胞技术检测U87细胞凋亡及细胞周期:过表达H19降低GBM细胞凋亡率,P < 0.01, 有非常显著性差异;过表达H19的U87GBM的S期细胞比例较对照组细胞的S期细胞比例明显增高,P < 0.01,差异有统计学意义。如图 2.2所示。
|
| 图 2.2 各组细胞在GBM细胞周期s期(上) 及凋亡(下) 影响所绘制生成图 |
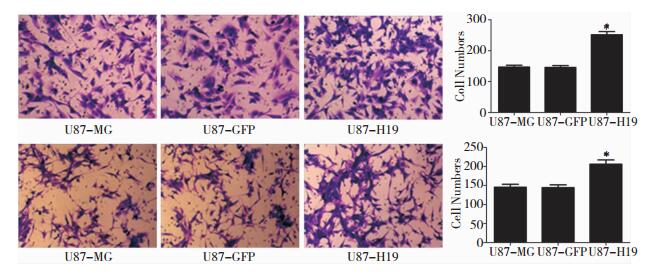
侵袭小室检测U87细胞迁移及侵袭:过表达H19的U87GBM的迁移较对照组细胞的迁移明显增高,H19增加细胞迁移率,P < 0.05, 有显著性差异;过表达H19的U87GBM的侵袭率较对照组细胞的侵袭率明显增高,H19增加细胞侵袭率,P < 0.05, 有显著性差异。如图 2.3所示。
|
| 图 2.3 H19在GBM迁移(上)、侵袭(下) 影响所绘制生成图 |
Western blot法检测P53表达, 过表达H19的U87胶质瘤细胞的P53的表达较对照组细胞的P53的表达明显抑制,P < 0.01,差异有统计学意义。如图 3所示。
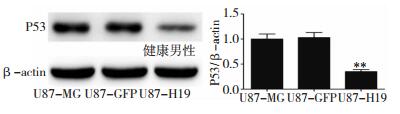
|
| 图 3 Western blot法检测P53表达所绘制生成图 |
LncRNAs, 被定义为内生细胞RNA的长度和超过200个核苷酸涉及大量的分子功能, 如调制可变剪接, 染色质重塑和RNA代谢[8-10]。LncRNAs功能以及在结构上不同于已知的内源性小RNA, 研究认为异常的microRNA的表达是人类胶质细胞瘤的一个特征[3]。少量LncRNAs基因的内部编码小RNA和某些LncRNAs可能通过扮演小RNA的前导的获得管理功能, 如小分子的核糖核酸[8]。目前的研究认为不正常的microRNA的表达是人类神经胶质细胞瘤的一个特征[11]。H19在胚胎期间呈明显的高表达,在出生后大多数组织中显著的低表达,而当组织再生或者异常增殖的情况下形成肿瘤可以重新再被激活[12],在大多数人类癌症中常常过度表达, 通常认为, H19的功能像一个致癌基因[13]。H19是原癌基因转录的一个目标,明确的证据证实H19有肿瘤的原癌基因、致癌基因的行为[14]。以上的基础研究认为LncRNAs与肿瘤关系密切,H19有致癌性。
临床上,H19与膀胱癌表达、肿瘤的性质及早期复发有显著关系。异常H19表达增强了肝细胞的细胞体内致癌的潜能[11]。文国容等研究发现在小鼠原发性肝癌IGF2和H19在癌细胞表达显著的增加[15]。尤梁惠等发现胃癌组织H19表达异常增高,推断H19可能参与了胃癌的产生和发展[16]。Tsang等报导结肠、直肠癌肿瘤H19和miR-675表达较正常组织明显增高[17]。mir-675是一个23-nt RNA来自核苷酸H19 RNA。研究表明H19编码mir-675可能导致人类胎盘滋养层细胞和结肠直肠癌细胞重要原因之一[18]。Ma等认为H19异常表达提高了胰腺癌细胞侵袭性[19]。Yang等通过对胃癌组织研究发现,H19在胃癌组织的表达均有明显升高,通过siRNA干扰技术降低H19基因在胃癌肿瘤组织的表达,可使肿瘤组织的侵袭性明显减弱,另外他还观察到P53低表达的胃癌细胞组织其H19表达异常增高,考虑H19可能通过抑制P53的表达引起肿瘤的产生[20]。以上多种颅外肿瘤的研究证实H19的致癌性,与我们的研究结果相符。
p53是抑制的肿瘤生长抑癌基因[21],研究发现p53和低氧诱导因子1-α(HIF1-α) 及H19表达关系密切。在一定程度上,p53抑制H19的可能, 包括干扰HIF1-α活动[11]。我们的研究也发现H19通过抑制p53促GBM增殖侵袭。H19相关基因与信号通路的KEGG分析(如下图)
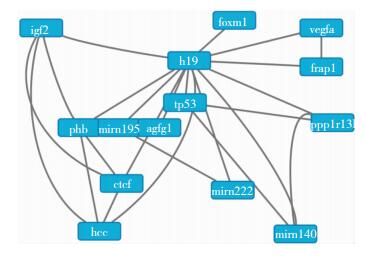
|
| 图 H19相关基因与信号通路的KEGG分析图 |
在胶质瘤方面,Shi[7]发现在高表达的H19增加神经胶质瘤的级别。其发现H19与其衍生物mir-675表达呈正相关,废除mir-675可抑制胶质瘤细胞入侵正常细胞。通过耗损H19抑制神经胶质瘤细胞的侵袭。与我们的研究结果一致。但H19的基础作用和机制及参与GBM的发病机理尚不清楚。H19在GBM中的研究鲜有报道。在本研究中, 为探讨神经GBM临床特征、生物功能和H19的潜在机制,我们收集GBM H19数据,探讨H19在GBM中的表达及对细胞系增殖、侵袭的影响。
实验结果显示:H19在GBM呈高表达,P < 0.05,差异有显著性。H19抑制GBM细胞凋亡率,P < 0.01, 有显著性差异;H19增加GBM细胞侵袭率,P < 0.05, 差异有显著性;H19增加GBM细胞迁移率,P < 0.05, 差异有显著性;H19增加GBM细胞周期s期比例,P < 0.01, 差异有非常显著性。H19抑制P53的表达,p53是人类重要的抑制癌症的基因, H19可能通过抑制P53的表达增进其致癌性。本研究结果与上述基础及临床研究结果相符。
H19增加GBM细胞侵袭率、增加GBM细胞迁移率、增加GBM细胞周期s期比例,抑制其凋亡率,抑制抑癌基因P53的表达,从而增加了其恶性程度。总之, H19能促进GBM的致癌性,H19致癌基因可以作为潜在的GBM治疗的目标基因。H19的基础作用和机制及参与GBM的发病机理十分复杂,具体的机理有待深入的实验研究。
湘雅医院神经外科李学军教授对论文给予指导,在此表示衷心感谢!| [1] | Chen J, McKay RM, Parada LF. Malignant glioma:lessons from genomics, mouse models, and stem cells. Cell, 2012, 149(1): 36–47. DOI:10.1016/j.cell.2012.03.009 |
| [2] | 陈加贝, 漆松涛, 欧阳辉, 等. 影响胶质母细胞瘤患者预后的多因素分析. 中华神经外科杂志, 2015, 31(1): 48–53. |
| [3] | 孙红军, 荔志云, 谢守嫔, 等. 胶质瘤基于组学方法的分子标记物的研究进展. 国际神经病学神经外科学杂志, 2014, 41(5): 446. |
| [4] | Wapinski O., Chang H.Y.. Long noncoding RNAs and human disease. Trends Cell Biol., 2011, 21: 354–361. DOI:10.1016/j.tcb.2011.04.001 |
| [5] | Luo M, Li Z, Wang W, et al. Upregulated H19 contributes to bladder cancer cell proliferation by regulating ID2 expression. FEBS J, 2013, 280(7): 1709–1716. DOI:10.1111/febs.2013.280.issue-7 |
| [6] | Sorin V, Ohana P, Gallula J, et al. H19-promoter-targeted Therapy combined with gemcitabine in the treatment of pancreatic cancer. ISRN Oncol, 2012, 35(1): 750. |
| [7] | Shi Y, Wang Y, Luan W, et al. Long non-coding RNA H19 promotes glioma cell invasion by deriving miR-675. PLoSOne, 2014, 9(1): e86295. DOI:10.1371/journal.pone.0086295 |
| [8] | Gutschner T, Diederichs S. The hallmarks of cancer:a long non-codingRNA point of view. RNA Biol, 2012, 9(6): 703–719. DOI:10.4161/rna.20481 |
| [9] | Gupta RA, Shah N, Wang KC, et al. Long noncoding RNA HOTAIR reprograms chromatin state to promote cancer metastasis. Nature, 2010, 464(7291): 1071–1076. DOI:10.1038/nature08975 |
| [10] | Kotake Y, Nakagawa T, Kitagawa K, et al. Long noncoding RNA ANRIL is required for the PRC2 recruitment to and silencing ofp15(INK4B) tumor suppressor gene. Oncogene, 2011, 30(16): 1956–1962. DOI:10.1038/onc.2010.568 |
| [11] | Matouk IJ, DeGroot N, Mezan S, et al. The H19 non-codingRNA is essential for human tumor growth. PLoS One, 2007, 2(9): e845. DOI:10.1371/journal.pone.0000845 |
| [12] | Yoshimizu T, Miroglio A, Ripoche MA., et al. The H19 locus acts in vivo as a tumor suppressor. Proc. Natl. Acad. Sci. U. S. A., 2008, 105(34): 12417–12422. DOI:10.1073/pnas.0801540105 |
| [13] | Thorvaldsen JL, Duran KL, Bartolomei MS, et al. Deletion of the H19 differentially methylated domain results in loss of imprinted expression of H19 and Igf2. Genes De, 1998, 12(23): 3693–3702. DOI:10.1101/gad.12.23.3693 |
| [14] | Barsyte-Lovejoy D, Lau SK, Boutros PC. et al. Thec-Myconcogene directly induces the H19 noncoding RNA by allele-specific binding to potentiate tumorigenesis, Cancer Res, 2006, 66(10): 5330–5337. |
| [15] | 文国容, 金海, 徐尚福, 等. 小鼠原发性肝癌中胰岛素样生长因子2和H19的表达及意义. 遵义医学院学报, 2013, 36(10): 422–424. |
| [16] | 尤梁惠, 刘志军, 德伟, 等. 长链非编码RNA H19促进人胃癌MGC-803细胞增殖的实验研究. 临床肿瘤学杂志, 2014, 19(9): 774. |
| [17] | Tsang WP, Ng EK, Ng SS, et al. Oncofetal H19-derivedmiR-675 regulates tumor suppressor RB in human colorectal cancer. Carcinogenesis, 2010, 316(3): 350–358. |
| [18] | Gao WL, Liu M, Yang Y, et al. The imprinted H19 gene regulates human placental trophoblast cell proliferation via encoding mi8-675 that targets Nodal Modulator 1(NOMO1). RNA Biol, 2012, 9(7): 1002–1010. DOI:10.4161/rna.20807 |
| [19] | Ma C, Nong K, Zhu H, et al. H19 promotes pancreatic cancer metastasis by derepressinglet-7's suppression on its target HMGA2-mediated EMT. [DOI:10.1007/s13277-014-2185-5], 2014, 35(9):9163-9169. |
| [20] | Yang F, Bi J, Xue X, et al. Up-regulated long non-codingRNA H19 contributes to proliferation of gastric cancer cells. FEBS J, 2012, 279(17): 3159–3165. DOI:10.1111/j.1742-4658.2012.08694.x |
| [21] | Matouk IJ, Mezan S, Mizrahi A, et al. The oncofetal H19 RNA connection:hypoxia, p53 and cancer, Biochim. Biophys.Acta, 2010, 1803(4): 443–451. DOI:10.1016/j.bbamcr.2010.01.010 |
 2016, Vol. 43
2016, Vol. 43



