扩展功能
文章信息
- 傅增辉, 孙洪英, 刘松, 贺淑慧
- FU Zeng-Hui, SUN Hong-Ying, LIU Song, HE Shu-Hui
- 血管性认知功能障碍与雄激素受体基因启动子区甲基化状态、同型半胱氨酸水平的相关性研究
- Association of vascular cognitive impairment with methylation status of the promoter region of androgen receptor gene and homocysteine level
- 国际神经病学神经外科学杂志, 2016, 43(6): 511-515
- Journal of International Neurology and Neurosurgery, 2016, 43(6): 511-515
-
文章历史
收稿日期: 2016-08-05
修回日期: 2016-11-21
2. 包头医学院研究生学院, 内蒙古包头市 014010
血管性认知功能障碍(vascular cognitive impairment, VCI) 是最常见的认知功能障碍类型之一,是指由于各种血管性因素引起的不同程度认知功能障碍综合征,是在对血管性痴呆不断研究的基础上提出来的,其内涵比血管性痴呆更为广泛[1]。血管性认知功能障碍是由于血管性因素引起的认知功能损害,其损害的程度还没有达到痴呆的标准,是界于正常和痴呆之间的一种状态。目前普遍认为VCI的发病机制为急性缺血使脑组织软化坏死、慢性缺血引起脑白质的损伤、小血管病变、脑血流量下降[2]。研究发现,雌激素受体与VCI的发生密切相关[3]。雌激素受体与雄激素(androgen receptor, AR) 同属于性激素受体,AR基因的低表达是否与VCI相关?本课题组研究发现脑梗死患者AR基因启动子存在高甲基化状态,而脑梗死是VCI的重要病因之一[4]。同时,Hainsworth等[5]研究发现同型半胱氨酸(homocysteine, HCY) 与VCI直接相关。故本研究旨在探明VCI与AR基因启动子高甲基化、HCY的关系。
1 材料与方法 1.1 研究对象随机选取2014年8月至2016年6月期间就诊于包头医学院第一附属医院神经内科的脑卒中慢性期的患者46例作为病例组,脑卒中发病时间为(412.31±220.26) d,所有入选对象需经颅脑MRI确诊,并经简易智能状态检查量表(Mini-Mental State Examination, MMSE) 及蒙特利尔认知评估量表(Montreal Cognitive Assessment, MoCA) 评定符合认知功能障碍的诊断标准[6]。排除标准:① 既往有抑郁症、精神分裂、帕金森病、癫痫病史;② 近1个月来服用可影响同型半肌氨酸水平的各种类型的药物,如多巴胺类药物、叶酸、维生素B类、避孕药和抗癫病药等;③ 因年龄、低文化或失明、聋哑等其他因素不能配合行量表检查者;④ 严重心肝肾功能障碍;⑤妊娠期或哺乳期妇女。在病例组中按卒中性质划分,脑梗死病例30例,脑出血病例为16例;根据病变部位划分,基底节卒中19例,皮质卒中18例,大面积脑卒中9例。
选取经头MRI诊断无明显异常的健康人92例作为对照组。
两组间性别、年龄、BMI等基本资料进行统计学检验,差异不具有统计学意义(P > 0.05)。
1.2 采集标本空腹12 h后采集全血并分离淋巴细胞、采用酶转换免疫法测定法检测HCY水平。
1.3 基因组DNA提取DNA的提取使用试剂盒Tiangen DNA Mini Kit (Tiangen, 北京天为时代),按产品说明书提供的方法提取细胞DNA,用30 μl无菌双蒸水溶解。用核酸蛋白仪监测其浓度及纯度。
1.4 亚硫酸氢钠修饰基因组DNA取每份基因组DNA样品约1 μg, 按修饰试剂盒Zymo DNA Methylation K it (ZYMO, 美国) 说明书进行修饰,主要步骤:加含氢氧化钠的稀释缓冲液使DNA变性,使其保持单链状态,再在含亚硫酸氢钠的修饰试剂50℃水浴16 h,使用试剂盒中纯化试剂进行DNA脱硫,清洗回收,最后溶于10 μl TE缓冲液(pH 8.0) 中,将搜集的修饰DNA于-20℃保存或立即进行甲基化特异性PCR (MSP) 反应。
1.5 甲基化特异性PCR 1.5.1 引物设计实验中使用甲基化PCR引物设计软件MethPrimer设计2对引物M、U,扩增目的片段位于AR基因启动子5’端360~518序列,引物M、U的设计均用于经修饰试剂处理后的DNA模板扩增,其中M引物用于扩增甲基化DNA,引物U用于扩增未甲基化DNA,野生型引物W以设计M、U引物的相应位点设计,用于未经修饰试剂处理的DNA序列的扩增,以检测AR基因启动子序列是否发生改变或突变。引物相关数据见表 1。引物核苷酸由北京赛百盛公司合成。
| 引物名称 | 序列(5’>3’) | 变性 | 退火 | 延伸 | 周期 |
| AR-Nf | AGCAAGCCCACAGGCAGAGGAGGC | 94℃, 5 min | 64℃, 30 s | 72℃, 60 s | 40 |
| AR-Nr | CGGGCGGCGGCTTCGAAGC | ||||
| AR-Uf | AGTAAGTTTATAGGTAGAGGAGGTG | 94℃, 30 s | 55℃, 30 s | 72℃, 60 s | 40 |
| AR-Ur | CAAACAACAACTTCAAAACCACCAC | ||||
| AR-Mf | AGTAAGTTTATAGGTAGAGGAGGCG | 94℃, 30 s | 57℃, 45 s | 72℃, 60 s | 40 |
| AR-Mr | CGAACGACGACTTCGAAACCG | ||||
| RT-AR-Af | AAGGCTATGAATGTCAGCCCA | 95℃, 30 s | 95℃, 5 s | 60℃, 30 s | 40 |
| RT-AR-Ar | CATTGAGGCTAGAGAGCAAGGC | ||||
| β-Actin-f | AAGGCCAACCGCGAGAAGAT | 95℃, 30 s | 95℃, 5 s | 60℃, 30 s | 40 |
| β-Actin-r | TCGGTGAGGATCTTCATGAG |
在25 μl MSP反应体系中,含1 μl亚硫酸氢钠修饰基因组DNA模板,10×缓冲液2.5 μl,上、下游引物各10 pmol,250 μmol/L的4种dNTP 2.5 μl,1 U TaqHS DNA聚合酶。于PCR仪上扩增,反应循环条件为:95℃预变性5 min,94℃变性30 s,相应退火温度退火40 s,72℃延伸60 s,扩增40个循环,然后72℃延伸5 min。反应结束后取上述PCR产物6 μl经2.0%琼脂糖凝胶100 V电泳40 min,凝胶图像分析系统记录图像。
1.6 组织RNA的提取及cDNA合成组织总RNA按照TRIZOL试剂盒(Invitrogen公司) 操作说明书进行,用紫外分光光度计检测其含量和纯度。以提取的总RNA为模版,按照PrimeScript RT reagent Kit试剂盒(TAKARA公司) 操作说明合成单链cDNA。
反应条件:37℃ 15 min,85℃ 5 s,1个循环。反应体系为:5×PrimeScript Buffer (for Real Time)2 μl,PrimeScript RT Enzyme Mix I 0.5 μl,Oligo dT Primer (50 μM)0.5 μl,Random 6 mers (100 μM)0.5 μl,Total RNA,RNase Free dH2O up to 10 μl。
1.7 Real-Time PCR检测mRNA基因表达所需引物均由上海英俊生物技术有限公司提供,PCR反应试剂盒为Premix Ex Taq Ⅱ (大连宝生公司),所需引物见表 1。分别制备AR和β-Actin的反应体系,具体为12.5 SYBR ® Premix Ex Taq Ⅱ μl,取cDNA 2 μl,上下游引物各1 μl (10 pmol/μl)。PCR扩增条件为:95 ℃预变性30 s,95℃变性5 s,60℃退火30 s,循环40个周期。每个样品3个复孔,取CT平均值,采用2-△△CT法进行结果分析。
1.8 统计学处理采用SPSS13.0统计软件。经正态性检验及方差齐性检验后,计数资料比较用卡方检验,计量资料应用两组均数的t检验。Spearman等级相关分析甲基化程度与HCY水平的相关关系。以P < 0.05为具有统计学意义。
2 实验结果 2.1 AR基因启动子甲基化分析扩增产物中出现甲基化条带,表明该位点发生甲基化,未出现甲基化条带则表明该位点未发生甲基化,均出现甲基化条带表明该位点发生半甲基化(图 1)。46例VCI患者中,33例AR基因启动子发生甲基化,甲基化率为71.74%;92例对照组患者中,18例AR基因启动子甲基化,甲基化率为19.57%。病例组与对照组甲基化率比较,差异有统计学意义(P < 0.05)。
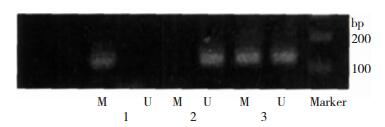
|
| 图 1 nMSP法检测AR基因甲基化电泳图。 注:M:用AR-pM特异性引物进行扩增;U:用AR-pU特异性引物进行扩增;1:甲基化血标本;2:非甲基化血标本;3:半甲基化血标本。 |
计算各组的相对△Ct值(△Ct=Avg.AR-Avg.β-Actin) 和△△Ct值(△△Ct=Avg.△CtVCI组一Avg△Ct对照组)。AR在46例病例组患者中,ΔCt值为10.73±1.29;92例对照组健康人中,ΔCt值为13.12±1.56。运用Livak方法计算出病例组患者基因表达缺失为对照组的5.24倍,且两组患者AR基因mRNA表达缺失率间差异有统计学意义(P < 0.05)。见表 2。
| 组别 | 例数 | β-Actin | AR | ΔCt | ΔΔCt | 2-ΔΔCt |
| 病例组 | 46 | 8.78±0.74 | 19.91±0.84 | 10.73±1.29 | -2.39±1.29 | 5.24 |
| 对照组 | 92 | 9.69±0.81 | 20.68±1.03 | 13.12±1.56 | 0.00±1.56 | 1 |
病例组HCY水平为14.73±5.31,对照组为7.12±4.19,病例组显著高于对照组,差异具有统计学意义(P < 0.05)。经spearman等级相关分析,AR基因启动子区甲基化程度与HCY相关系数为r=0.534,差异具有统计学意义,并且随HCY升高,病例组甲基化程度亦递次升高。
3 讨论以往研究认为,性激素受体变化主要与一些肿瘤的发生相关,如乳腺肿瘤、膀胱癌、前列腺癌、子宫内膜癌等[7]。近年来,研究发现雄激素与学习记忆能力和认知功能有关[8]。AD患者血清睾酮水平明显下降,经睾酮替代治疗后认知功能获得不同程度的改善[9]。睾酮缺乏可导致海马神经元疏松紊乱、变性肿胀,凋亡数目增加,结构形态受损,神经元大量丢失;雄激素补充治疗后能减轻神经元丢失,并改善病理损伤[8]。
表观遗传学是指在DNA核酸序列不发生改变的情况下,从染色质水平研究生物体如何对基因的表达实现调控[10]。其内容包括DNA甲基化、组蛋白修饰、RNA干扰等。DNA甲基化是指DNA在甲基转移酶的作用下,生成甲基嘌呤或嘧啶。对真核生物而言,甲基化位点只发生在5’-CpG-3’二核苷酸上,从而形成5-甲基胞嘧啶。CpG二核苷酸主要存在于CpG岛。CpG岛甲基化后一方面可直接干扰转录因子与DNA的调控区域结合;另一方面则可与甲基结合蛋白相结合,占据转录因子在DNA上的结合位点,影响基因的转录和表达。这样基因就可能通过对CpG位点,特别是CpG岛的甲基化状态的调控而实现对基因转录和蛋白质表达水平的调控。而CpG岛主要集中在基因的启动子及第一外显子区域[11]。
AR属于配体依赖的转录因子超家族,人类AR由917个氨基酸组成,整个分子可分为3个功能区:具有转录活性的N端区(NTD),与靶基因上雄激素反应元件特异结合的DNA结合域(DBD) 以及C末端的配体结合域(LBD)。AR基因位于Xq11-12,总长度大于90 kb,包括8个外显子和7个内含子。起始部第一外显子编码受体N端区,第二、三外显子编码DBD,其余5个外显子编码LBD[12]。
AR通过与雄激素结合形成复合物,再与核中特定DNA序列结合,调节靶基因的表达并发挥其生理作用。Kinoshita等[13]认为AR启动子区存在一个CpG甲基化的热点,它是基因沉默的标志。Sasaki等[14]在研究AR基因CpG岛甲基化时发现,AR表达缺失的子宫内膜癌组织占79%(70/89),AR基因发生甲基化的子宫内膜癌组织占72%(64 /89),用去甲基化试剂5’-AzaDC处理子宫内膜癌细胞株,使AR基因在所有细胞中重新表达,因此,推测AR基因失活的机制可能是通过AR基因CpG岛的甲基化来实现的。
HCY是一种含硫氨基酸,HCY与5-甲基四氢叶酸共同合成蛋氨酸,继而转化成S-腺普甲硫氨酸(S-adenosylmethionine, SAM),SAM是体内活性甲基供体,直接参与DNA甲基化反应,将其甲基基团供给细胞中80多个生物甲基化反应,对细胞分裂、增殖和组织生长具有极其重要的作用[15]。高HCY是AD、轻度认知功能损害和血管性痴呆的独立危险因素,目前普遍认为HCY的致老年痴呆作用与表观遗传学改变相关[16, 17]。
在本研究中发现VCI患者AR基因启动子区高甲基化与VCI发病相关;高HCY水平与AR基因启动子区高甲基化相关。HCY会导致体内甲基供应增加,基因组总甲基化水平和特定基因的甲基化水平应该是升高的。Huang等[18]发现HCY可导致雌激素受体基因高甲基化。推测可能存在HCY水平升高引起AR基因启动子区高甲基化导致AR基因沉默,引起mRNA转录水平下降,从而引起AR表达水平下降,可能间接通过促进脑血管疾病的发生而促进VCI的发展,也可能直接引起认知功能的变化。总之HCY对DNA甲基化水平的影响是极其复杂的,在不同位点是不同的,有待于深入研究。还需要对VCI的表观遗传学发病机制进一步研究,本研究可能为其提供了一个新方向,同时AR启动子CpG岛的异常甲基化有可能成为VCI的参考标记物,为临床诊断检测VCI提供了一个新的分子生物学上的标记。
| [1] | 孟楠, 吕佩源. 几种模拟临床发病原因血管性认知功能障碍动物模型的研究进展. 国际神经病学神经外科学杂志, 2012, 39(2): 180–184. |
| [2] | 蒋艳艳, 聂志余, 李云霞. 血管性认知功能障碍的影像学研究进展. 国际神经病学神经外科学杂志, 2014, 41(1): 73–77. |
| [3] | Lin GF, Ma QW, Zhang DS. Polymorphism of a-estrogen receptor and aryl hydrocarbon receptor genes in dementia patients in Shanghai suburbs. Acta Pharmacol Sin, 2003, 24(7): 651–656. |
| [4] | 孙洪英, 和姬苓, 张利荣, 等.脑梗死患者雄激素受体启动子CpG岛甲基化及其mRNA表达的研究.第七届国际脑血管病高峰论坛论文集.Interventional Neurology, World Stroke Organization (WSO), 2011, 2. |
| [5] | Hainsworth AH, Yeo NE, Weekman EM, et al. Homocysteine, hyperhomocysteinemia and vascular contributions to cognitive impairment and dementia (VCID). Biochim Biophys Acta, 2016, 1862(5): 1008–1017. DOI:10.1016/j.bbadis.2015.11.015 |
| [6] | 骆迪, 毕齐. 血管性认知功能障碍研究进展. 中国全科医学, 2011, 35: 4003–4006. |
| [7] | Yan L, Yang X, Davidson NE. Role of DNA methylation and histoneacetylation in steroid receptor express ion in b reast cancer. JM ammary Gland Biol Neoplasia, 2001, 6(2): 183–192. DOI:10.1023/A:1011308707512 |
| [8] | Nead KT, Gaskin G, Chester C, et al. Androgen Deprivation Therapy and Future Alzheimer's Disease Risk. J Clin Oncol, 2016, 34(6): 566–571. DOI:10.1200/JCO.2015.63.6266 |
| [9] | Nead KT, Gaskin G, Chester C, et al. Association Between Androgen Deprivation Therapy and Risk of Dementia. JAMA Oncol, 2016, 13. |
| [10] | Broholm C, Olsson AH, Perfilyev A, et al. Human adipogenesis is associated with genome-wide DNA methylation and gene expression changes. Epigenomics, 2016. |
| [11] | Wedd L, Maleszka R. DNA Methylation and Gene Regulation in Honeybees:From Genome-Wide Analyses to Obligatory Epialleles. Adv Exp Med Biol, 2016, 945: 193–211. DOI:10.1007/978-3-319-43624-1 |
| [12] | 王刚, 刘利, 陈杰, 等. 白血病细胞雄激素受体基因启动子甲基化状态的研究. 第三军医大学学报, 2007, 10: 932–934. |
| [13] | Kinoshita H, Shi Y, Sandefur C, et al. Methylation of the and rogenreceptorm in im alpromoter silences transcription in humanp rostate cancer. Cancer Res, 2000, 60(13): 3623–3630. |
| [14] | Sasaki M, OhB R, Dharia A, et al. Inactivation of the human and rogenreceptor gene is associated with CpG hypermethylation in uterineendometrial cancer. Mo lC arcinog, 2000, 29(2): 59–66. |
| [15] | Nourani Khojasteh H, Amiri A. Congenital lens dislocation and fatal cerebral vein thrombosis in a patient with homocysteinemia:a lesson for urgent screening of pediatric population. Arch Iran Med, 2013, 16(5): 306–307. |
| [16] | Halil M, Cemal Kizilarslanoglu M, Emin Kuyumcu M, et al. Cognitive aspects of frailty:mechanisms behind the link between frailty and cognitive impairment. J Nutr Health Aging, 2015, 19(3): 276–283. DOI:10.1007/s12603-014-0535-z |
| [17] | 刘培茹. 高同型半胱胺酸血症与帕金森病认知功能的相关性研究. 国际神经病学神经外科学杂志, 2016, 43(1): 30–33. |
| [18] | Huan UYS, Zhi YF, Wang SR. Hypcrmcthylanon of estrogen receptor-alpha gene in atheromatosis patients and its correlation with homocystcin. Pathophysiology, 2009, 16: 259–265. DOI:10.1016/j.pathophys.2009.02.010 |
 2016, Vol. 43
2016, Vol. 43




