扩展功能
文章信息
- 秦娜, 张彦, 王圆圆, 韩丰立, 邓艳春
- QIN Na, ZHANG Yan, WANG Yuan-Yuan, HAN Feng-Li, DENG Yan-Chun
- 托吡酯对纠正癫痫神经递质异常的可行性研究
- A feasibility study of topiramate in correcting neurotransmitter abnormalities in epilepsy
- 国际神经病学神经外科学杂志, 2016, 43(6): 502-506
- Journal of International Neurology and Neurosurgery, 2016, 43(6): 502-506
-
文章历史
收稿日期: 2016-09-07
修回日期: 2016-12-12
2. 陕西省第四人民医院神经内科, 陕西省西安市 710043
癫痫是一种发病机制极为复杂的疾病,造成癫痫患者发病的原因是由于兴奋性神经递质与抑制性神经递质的平衡被打破,导致神经元异常,反复过度出现同步放电。谷氨酸(glutamate, Glu) 与γ-氨基丁酸(gamma aminobutyric acid, GABA) 是兴奋与抑制大脑皮质最重要的神经递质,在两者的共同作用下对脑部神经元的平衡进行维持,当两种神经递质出现平衡紊乱,则发生癫痫。国外学者研究指出[1],白介素-6(interleukin-6, IL-6) 与白介素-1β (interleukin-1β, IL-1β) 会造成大鼠出现癫痫行为发作,随后提升大鼠的Glu水平,降低其GABA水平,会刺激大鼠神经元兴奋并出现癫痫症状。托吡酯是临床上治疗抗癫痫的新型药物,具有多重作用机制[2]。本研究在国内外学者研究结果的基础上对SD大鼠进行了托吡酯治疗,进一步研究托吡酯对大鼠神经递质异常情况的改善以及安全性,现将结果作如下报道。
1 材料与方法 1.1 实验材料 1.1.1 实验动物选取4周健康大鼠100只作为本次研究对象,大鼠体质量80~120 g,由第四军医大学实验室提供。按照随机分配将大鼠分为空白对照组(生理盐水注射处理)、戊四氮组(戊四氮诱导) 与观察组(戊四氮诱导+托吡酯治疗),每组20只。
1.1.2 实验药品与设备Glu和戊四氮由美国Sigma公司提供;托吡酯片(国药准字H20020555) 由西安杨森制药有限公司提供;注射用苯巴比妥钠(国药准字H31020532) 由上海新亚药业有限公司提供;磺基水杨酸(分析纯AR) 由南京化学试剂有限公司提供;GABA由西安通泽生物科技有限公司提供。TGD-22MC台式高速大容量冷冻离心机;JY96-ⅡN超声波细胞粉碎机;L-8800高速氨基酸分析仪;JH3101电子精密天平。
1.2 实验方法 1.2.1 药物预处理将戊四氮粉剂按照实验要求进行稀释,戊四氮1 mg+生理盐水0.1 ml稀释,并按照35 mg/kg进行大鼠腹腔注射。托吡酯片按照实验研究进行稀释,托吡酯1 mg+生理盐水0.1 ml稀释,并按照36 mg/kg对大鼠进行灌胃。
1.2.2 模型建设按照Diehl等[3]提出的动物模型建立方式进行处理,于每日早上8点对大鼠进行体质量测量,并根据其体重进行药物剂量给予。空白对照组给予生理盐水腹腔注射,戊四氮组给予戊四氮4 mg/kg进行腹腔注射,诱发大鼠痫性行为,观察组给予戊四氮+托吡酯片,首先给予托吡酯36 mg/kg对大鼠进行灌胃,经过30 min的预处理观察,再对大鼠进行戊四氮4 mg/kg腹腔注射。此后戊四氮腹腔注射改为4天一次,以维持点燃效应,防止研究对象海马内的神经递质水平受到癫痫发作减少的影响,保证实验结果的准确性。三组大鼠操作结束后观察2 h,对其行为学表现进行记录后,断头取脑进行Glu与GABA分析。
1.2.3 组织制备与氨基酸测定各组大鼠在末次点燃测试后的1 h节点处,对大鼠进行戊巴比妥钠麻醉,并对其进行升主动脉灌流,迅速注入NS 150 ml,随后将4%的多聚甲醛磷酸缓冲液400 ml冲洗,立即取脑,对一侧的皮质与海马进行剥离后称重,随后放置在100 mg/L的磺基水杨酸中进行20 min离心,离心结束后取上清液测定。对另一侧脑组织进行6 h固定,并置入20%的蔗糖溶液中保存一夜[4]。于第2日在-20℃的冷箱中进行恒温切片。将大脑颞、背侧海马、顶叶皮质中最大切面的切片进行留取。
1.2.4 免疫组织化学法将切片采用浓度0.3%的双氧水-甲醛进行20 min的预处理,随后将其放置在3%的牛血清蛋白中进行1 h的孵育,随后分别加入兔抗Glu血清(孵育48 h)、生物素化羊抗兔IgG (孵育1 h)。每个步骤区间采用磷酸缓冲盐溶液进行充分的漂洗,并加入硫酸镍铵显色液进行10 min的显色,充分漂洗→贴片→晒干后,进行常规脱水→透明→封片。
1.2.5 观测指标在对大鼠进行造模治疗期间,于每天给药后观察动物行为变化1 h,记录大鼠的潜伏期、癫痫发作的持续时间以及强度。按照Diehl等[3]提出的动物惊厥评估标准进行评定:0级(大鼠无任何行为发作);1级(大鼠出现头部抽搐或是节律性点头);2级(大鼠出现阵挛性咀嚼);3级(大鼠出现头部抽搐同时合并前侧肢体阵挛性抽搐);4级(大鼠出现上身直立状);5级(大鼠站立不稳,频发跌倒);6级(大鼠出现强制性惊厥)。
1.3 统计学处理与图像分析采用HMIAS-2000高清晰度彩色病理图文系统对图像进行分析。统计学处理采用SPSS 19.0统计学软件分析,计量资料采取方差检验及正态分布检验,以均数±标准差(x±s) 表示,资料的组间比较采用t检验,组间比较采用两两比较的q检验。统计结果以P < 0.05表示差异有统计学意义。
2 结果 2.1 三组大鼠行为学表现比较对照组大鼠在实验期间无癫痫发作。戊四氮组大鼠在注射药物2 min后出现前侧肢体阵挛性抽搐,持续时间2~3 min,反复发作35~45 min,属于3级发作。观察组在注射药物后并未出现癫痫症状。戊四氮组相比对照组与观察组癫痫发生率差异有统计学意义(P < 0.05)。
2.2 三组大鼠免疫组化情况比较空白对照组大鼠海马脑组织氨基酸神经递质,可见正常阳性表达细胞,染色较浅,位置不固定。戊四氮组大鼠海马脑组织,可见氨基酸神经递质着色明显增多,颜色加深。观察组大鼠海马脑组织,可见阳性细胞数显著减少。见图 1。
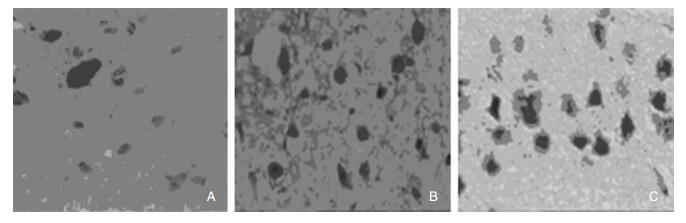
|
| 图 1 各组大鼠免疫组化染色情况。 注:A为空白对照组;B为戊四氮组;C为观察组。 |
空白对照组与观察组大鼠在海马区、大脑皮质神经递质(GABA和Glu) 含量上比较,差异无统计学意义(P > 0.05)。戊四氮组大鼠在以上指标上与空白对照组和观察组相比较,差异有统计学意义(P < 0.01)。见表 1。
| 分组 | 例数 | 大脑皮质 | 海马区 | ||
| GABA | Glu | GABA | Glu | ||
| 空白对照组 | 20 | 5.90±1.52 | 9.30±5.65 | 2.48±1.15 | 6.41±1.38 |
| 戊四氮组 | 20 | 2.66±1.99ab | 19.66±4.25ab | 0.85±0.38ab | 15.10±3.90ab |
| 观察组 | 20 | 5.01±1.15c | 14.50±1.66c | 2.52±1.12c | 6.45±1.29c |
| 注:a和b为戊四氮组与其他两组相比较,P < 0.01;c为观察组与空白对照组相比较,P > 0.05。 | |||||
空白对照组与观察组大鼠在大脑皮质、CA3区及海马区齿状回的Glu免疫阳性神经元平均光密度上比较,差异无统计学意义(P > 0.05)。戊四氮组大鼠在以上各指标上与空白对照组和观察组相比均明显降低,差异有统计学意义(P < 0.01)。见表 2。
| 组别 | 例数 | 大脑皮质 | CA3区 | 海马区齿状回 |
| 空白对照组 | 20 | 0.14±0.04 | 0.16±0.04 | 0.16±0.04 |
| 戊四氮组 | 20 | 0.29±0.05ab | 0.31±0.05ab | 0.29±0.05ab |
| 观察组 | 20 | 0.15±0.03c | 0.17±0.03c | 0.17±0.04c |
| 注:a和b为戊四氮组与其他两组相比较,P < 0.01;c为观察组与空白对照组相比较,P > 0.05。 | ||||
空白对照组与观察组大鼠在大脑皮质、CA3区及海马区齿状回的GABA免疫阳性神经元数量上比较,差异无统计学意义(P > 0.05)。戊四氮组大鼠在以上各指标上与空白对照组和观察组相比均明显增高,差异有统计学意义(P < 0.01)。见表 3。
| 组别 | 例数 | 大脑皮质 | CA3区 | 海马区齿状回 |
| 空白对照组 | 20 | 32.2±4.0 | 29.8±3.7 | 29.1±3.8 |
| 戊四氮组 | 20 | 12.7±4.6ab | 13.5±3.9ab | 11.1±4.2ab |
| 观察组 | 20 | 31.9±4.2c | 30.1±3.5c | 28.7±4.0c |
| 注:a和b为戊四氮组与其他两组相比较,P < 0.01;c为观察组与空白对照组相比较,P > 0.05。 | ||||
戊四氮是一种常见的致痫药物,且戊四氮的致痫机制与大脑CABA中的受体有明显关系[5]。戊四氮通过对CABA受体进行抑制造成细胞内Cl-内流减少,膜内电位增高,神经元兴奋性随之增强[6]。而在本研究中,对大鼠进行托吡酯联合戊四氮处理后,发现大鼠海马内的GABA阳性神经元含量显著提高,且增高主要在分子细胞层内,通过对海马细胞构筑的特征进行分析发现,分子细胞层内存在一些抑制神经元,其作用是为了阻止其兴奋性对海马的投射神经元造成冲动。
托吡酯是目前临床上用于抗癫痫的一种新型药物,具有广谱抗癫痫作用,特别是针对难治性癫痫,不仅能单独使用,同时还能作为添加药物辅助使用。托吡酯的抗癫痫机制分为很多种类,其中包括对GABA及GABA受体进行影响,托吡酯在GABA受体上可以提高其活性[7]。在对戊四氮诱导癫痫的大鼠进行托吡酯处理后,大鼠并未出现任何痫性症状,从症状上可看出,托吡酯能防止癫痫的发生。而在采取免疫组织化学法对大鼠的神经递质变化进行记录时,发现GABA在神经元分子层内的阳性变化,推测有可能在实验中升高的海马CA3区GABA神经递质属于抑制性中间神经元[8]。在对大鼠的Glu免疫反应阳性神经元平均光密度值得测定中发现,在对大鼠进行托吡酯处理后,大鼠的海马锥体细胞层、颞叶区、大脑皮质顶叶、多形细胞层以及齿状回颗粒细胞层的Glu免疫反应明显降低,而GABA免疫反应在以上各部位明显增强,进一步说明了托吡酯能稳定大鼠海马内的GABA与Glu的神经元功能平衡,防止癫痫的发生。
Glu作为兴奋性氨基酸神经递质,当其在体内过度释放,则会造成大脑持续处于兴奋状态,且神经毒性会随之增强[9]。而GABA是神经中枢中主要的抑制性氨基酸神经递质,可以有效的保护中枢神经,同时降低大脑的兴奋性。Glu与GABA作为大脑各个脑区的兴奋性神经递质与抑制性神经递质,可以调节脑神经元的兴奋与抑制,让其保持在平衡的状态,协调大脑功能。有关研究指出[10],Glu与GABA对人体的代谢有着重要的作用,同时两者之间可进行循环转化,癫痫患者的发病与Glu及GABA发生代谢紊乱有密切的关系。大鼠在痫性症状发作时,其脑内的GABA会出现不同程度的减少,而大部分引发大鼠惊厥的药物都表现出脑内GABA被阻断[11],这进一步说明了GABA的减少与癫痫的发生有密切的关系。对癫痫大鼠的病灶进行Glu含量测定,结果发现其Glu明显增加,同时脑脊液中的Glu也显著上升,后对空白对照组大鼠脑室进行Glu注射,结果发现大鼠出现惊厥现象。注射外源性兴奋性氨基酸受体激动剂红藻氨酸也会引起不同种属动物出现痫性表现[12]。本研究结果发现,戊四氮对大鼠进行癫痫诱导后,大鼠海马Glu的含量出现升高。相关研究发现[9],对大鼠的杏仁核进行快速点燃模型,大鼠的颞叶皮质、海马区的Glu明显增高,GABA随之减少;采用红藻氨酸对大鼠进行癫痫诱导发现,大鼠颞叶皮质、海马区的GABA明显减少。本研究结果与上述研究一致,而在使用托吡酯对大鼠注射后,大鼠海马区、大脑皮质神经递质与空白对照组的大鼠含量比较无显著差异,说明托吡酯对大鼠的癫痫症状具有及时纠正的作用。
托吡酯无论是用于成年人治疗或是用于儿童治疗都是较好的选择。在对患者的认知功能损伤以及不良反应记录中发现,可通过对剂量的逐渐增加来降低人体对药物的不耐受[13]。目前对于托吡酯是否真的影响癫痫患者认知功能并未完全证实,但如何最大程度的减轻药物对患者认知功能的损伤,是临床工作者持续努力的方向。本研究证实了托吡酯对癫痫出现的神经递质异常具有明显的纠正作用,其通过改善大脑GABA与Glu的调节平衡,减少反复同步放电对大脑造成的损伤。
| [1] | 李光霁, 顾浩, 郭维嘉, 等. 基于药性组合模式的托吡酯新功能发现及其作用机制研究. 中国中药杂志, 2014, 39(13): 2396. |
| [2] | 余璐, 何娜, 刘晓蓉, 等. 热性惊厥相关癫痫患者抗癫痫药物治疗疗效及与电压依赖性钠通道α1亚基基因突变的关系. 中华神经科杂志, 2014, 47(8): 36–39. |
| [3] | Diehl RG, Smialowski A, Gotwo T. Development and persistence of Kindled seizures after repeated injections of peutylenetetrazol in rats and guinea pigs. Epilepsia, 1984, 25(4): 506–510. DOI:10.1111/epi.1984.25.issue-4 |
| [4] | Park KM, Kim SH, Nho SK, et al. A randomized open-label observational study to compare the efficacy and tolerability between topiramate and valproate in juvenile myoclonic epilepsy. J Clin Neurosci, 2013, 20(8): 1079–1082. DOI:10.1016/j.jocn.2012.10.020 |
| [5] | Pasini A, Pitzianti M, Baratta A, et al. Timing and clinical characteristics of topiramate-induced psychosis in a patient with epilepsy and tuberous sclerosis. Clin Neuropharmacol, 2014, 37(1): 38–39. |
| [6] | Clark AM, Kriel RL, Leppik IE, et al. Intravenous topiramate:Safety and pharmacokinetics following a single dose in patients with epilepsy or migraines taking oral topiramate. Epilepsia, 2013, 54(6): 1106–1111. DOI:10.1111/epi.12165 |
| [7] | 霍士光, 袁宝强, 孔艳冉, 等. 细胞外信号调节激酶信号通路对癫痫大鼠海马内HIF-1α表达的调控作用. 中华神经医学杂志, 2013, 12(9): 885–890. |
| [8] | 姜广宇, 董航, 廉晓宇, 等. 托吡酯对慢性癫痫大鼠海马区脑组织c-fos、c-jun表达的影响. 中国老年学杂志, 2015, 34(15): 4189–4190. |
| [9] | Castilla-Puentes R, Ford L, Manera L, et al. Topiramate monotherapy use in women with and without epilepsy:Pregnancy and neonatal outcomes. Epilepsy Res, 2014, 108(4): 717–724. DOI:10.1016/j.eplepsyres.2014.01.021 |
| [10] | 黄从刚, 卞红强, 罗正利, 等. 左乙拉西坦和托吡酯治疗癫痫疗效和安全性的系统评价. 中华神经医学杂志, 2014, 13(5): 499–503. |
| [11] | Witt JA, Elger CE, Helmstaedter C. Impaired verbal fluency under topiramate--evidence for synergistic negative effects of epilepsy, topiramate, and polytherapy. Eur J Neurol, 2013, 20(1): 130–137. DOI:10.1111/j.1468-1331.2012.03814.x |
| [12] | 孔庆霞, 梁汝庆, 高建英, 等. 抗痫促智药物对认知功能障碍致痫大鼠海马细胞外信号调节激酶2及神经细胞黏附分子1表达的影响. 中华行为医学与脑科学杂志, 2013, 22(8): 696–699. |
| [13] | Sonmez FM, Zaman D, Aksoy A, et al. The effects of topiramate and valproate therapy on insulin, c-peptide, leptin, neuropeptide Y, adiponectin, visfatin, and resistin levels in children with epilepsy. Seizure, 2013, 22(10): 856–858. DOI:10.1016/j.seizure.2013.07.007 |
 2016, Vol. 43
2016, Vol. 43



