扩展功能
文章信息
- 陶然, 杨晓苏, 魏杰, 张长应
- TAO Ran, YANG Xiao-Su, WEI Jie, ZHANG Chang-Ying
- 小电导钙激活型钾通道SK3在大鼠偏头痛模型中脑干的表达变化
- Change in the expression of small conductance calcium-activated potassium channel SK3 in the brain stem in a rat model of migraine
- 国际神经病学神经外科学杂志, 2016, 43(6): 497-501
- Journal of International Neurology and Neurosurgery, 2016, 43(6): 497-501
-
文章历史
收稿日期: 2016-09-19
修回日期: 2016-11-12
2. 广西壮族自治区人民医院神经内科干部病区, 广西壮族自治区南宁市 530021
2. The Cadre Ward in Department of Neurology, The People's Hospital of Guangxi Zhuang Autonomous Region, Nanning 530021, China
偏头痛是神经系统常见疾病,流行病学调查显示中国偏头痛的患病率为9.3%[1],女性明显高于男性[2]。目前其发病机制仍未十分明了,脑干可能是潜在的偏头痛发生器,头痛的始动可能源于脑干核团的异常兴奋[3]。离子通道易感基因在家族偏瘫型偏头痛中的确定,提示偏头痛可能与离子通道异常有关[4]。有研究认为编码小电导钙激活型钾通道SK3基因的三核苷酸重复序列CAG多态性和一般性偏头痛有关[5]。SK3在脑干中表达丰富,但该通道是如何参与偏头痛的发生发展过程,目前罕见报道。本研究拟采用硝酸甘油致大鼠偏头痛模型,RT-PCR和Western法检测脑干SK3 mRNA及其蛋白表达,并与氟桂利嗪干预组进行对比研究,以初步探讨小电导钙激活型钾通道SK3与大鼠偏头痛的关系,为深入研究偏头痛的发病机制,寻找新治疗靶点提供实验依据。
1 材料与方法 1.1 材料硝酸甘油溶液(北京益民药物有限公司);氟桂利嗪胶囊(西安杨森制药有限公司);M-MLV逆转录酶(美国Promega公司);蛋白提取试剂盒(SBS Geneteeh公司);BAC蛋白浓度测定试剂盒(上海碧云天公司);兔Anti-KCa2.3(SK3)(以色列Alomone Lab);辣根酶标记山羊抗兔IgG (PIERCE公司)。
1.2 方法 1.2.1 实验动物分组及处理40只成年雌性SD大鼠随机分为3组:对照组(n=8)、模型组(n=16) 和干预组(n=16),后两组再随机分为发作期组和间歇期组,每组8只。
对照组大鼠背部皮下注射2 ml生理盐水,每周1次,共5周,于第2次造模后每天灌服生理盐水1次,共2 ml。依Tassorelli Cristina法[6],模型组大鼠背部皮下注射硝酸甘油溶液2 ml (10 mg/kg),每周1次,共5周,于第2次造模后每天灌服生理盐水1次,共2 ml。药物干预组造模同模型组,于第2次造模后每天灌服1次氟桂利嗪2 ml (0.5 mg/kg)[7]。
1.2.2 行为学评价模型制备后记录每组大鼠耳红开始及结束的时间,以30 min为时间间隔,设定6个时间段(0~30、31~60、61~90、91~120、121~150和151~180 min),各时间点挠头和爬笼的次数。
1.2.3 取材对照组及所有发作期组于第5次造模后3 h断头处死迅速取脑干组织,所有间歇期组第5次造模后第4天断头处死迅速取脑干组织,置-80℃冰箱保存待测。按大鼠脑立体定向解剖图谱取包括中脑、桥脑、延髓在内的脑干组织。
1.2.4 RT-PCR检测SK3 mRNA的表达脑干组织在液氮中研磨成粉状后取100 mg。① Trizol法提取总RNA,用去RNA酶水20 μl溶解。② 逆转录反应合成cDNA第一链:总反应体系20 μl,反应条件为70℃5 min,42℃60 min,70℃10 min。③ PCR同管扩增:总反应体系25 μl,扩增条件为94℃预变性5 min;94℃变性40 s;64℃退火40 s;72℃延伸40 s,72℃终末延伸7 min;31个循环。SK3引物:上游:5’-CCATGTTCTTGCGCCTATACCT-3’,下游:5’-GCAGCGTTCTTGATCCGTTT-3’,扩增片段为487 bp。内参照β-acting引物:上游:5’-GAGACCTTCAACACCCCAGCC-3’,下游:5’-TCGGGGCA TCGGAACCGCTCA-3’,扩增片段为422 bp。④ PCR产物检测:1.5%琼脂糖凝胶(加溴化乙锭) 电泳后测定PCR产物条带吸光度(A) 值。
1.2.5 Western法检测SK3蛋白的表达脑干组织在液氮中研磨成粉状后取100 mg加入蛋白裂解液RIPA 1 ml,冰浴裂解30 min,4℃,12000 g离心15 min,收集上清液,考马斯亮蓝法测定总蛋白浓度;样品蛋白经SDS-聚丙烯酰胺凝胶电泳分离后,电转移到NC膜上,转印膜在5%脱脂奶粉封闭液封闭过夜。NC加入一抗(1 :200,β-actin 1 :300) 溶液,4℃过夜。TPBS震洗后按1 :2000加入二抗溶液,37℃,摇床孵育1 h。加入化学发光试剂反应5 min,应用Syngene Bio Imaging检测系统观察并照相。
1.3 统计学处理用SPSS 22.0统计软件包处理数据。符合正态分布的数据用t检验进行两两比较,数值用平均值±标准差(x±s) 表示,不符合正态分布数据采用非参数秩和检验,数值用M (P25, P75) 表示;重复测量资料方差分析检验各组大鼠行为学表现是否有差异;Mann-whitney U检验分析两组间SK3 mRNA和蛋白的表达差异是否具有统计学意义。P < 0.05为差异具有统计学意义。
2 结果 2.1 大鼠行为学变化模型组大鼠用硝酸甘油造模后5~30 min,均出现双耳发红、前肢频繁搔头、爬笼次数增多、烦躁不安等现象,此现象持续1~3 h不等,继而出现蜷卧、活动减少。以上现象为造模成功,成功率为100%,期间无一死亡。干预组造模后也出现上述典型表现,但耳红挠头持续时间较模型组缩短,不同时间段挠头及爬笼次数均减少,与模型组比较差异有统计学意义(P < 0.05)。对照组无上述表现。见表 1、表 2、表 3。
| 组别 | 例数 | 耳红开始时间 | 耳红结束时间 |
| 模型组 | 16 | 3.50±0.93 | 183.00±17.48 |
| 干预组 | 16 | 4.37±1.51* | 138.50±11.81* |
| 注:*为与模型组比较,P < 0.05。 | |||
| 组别 | 例数 | 0~30 | 31~60 | 61~90 | 91~120 | 121~150 | 151~180 |
| 对照组 | 8 | 1.88±1.25 | 1.25±1.04 | 1.00±0.75 | 0.75±0.71 | 0.63±0.74 | 0.63±0.73 |
| 模型组 | 16 | 26.38±5.10* | 44.75±9.38* | 45.75±9.11* | 20.50±6.21* | 24.88±6.72* | 13.37±4.27* |
| 干预组 | 16 | 24.65±5.37* | 38.88±7.14* & | 19.88±3.60* & | 10.88±3.18* & | 7.25±2.66* & | 3.87±1.13* & |
| 注:*为与对照组比较,P < 0.05; & 为与模型组比较,P < 0.05。 | |||||||
| 组别 | 例数 | 0~30 | 31~60 | 61~90 | 91~120 | 121~150 | 151~180 |
| 对照组 | 8 | 9.75±2.87 | 6.75±2.12 | 5.88±2.30 | 3.88±1.64 | 3.50±1.51 | 2.38±1.60 |
| 模型组 | 16 | 17.50±3.59* | 14.13±2.85* | 13.50±2.45* | 11.50±2.45* | 12.50±2.45* | 9.88±3.23* |
| 干预组 | 16 | 10.88±3.368& | 9.88±1.55* & | 9.13±3.44* & | 7.88±1.89* & | 6.88±1.64* & | 5.13±1.46* & |
| 注:*为与对照组比较,P < 0.05; & 为与模型组比较,P < 0.05。 | |||||||
与对照组比较,模型组及干预组无论发作期组还是间歇期组SK3 mRNA表达均下降,差异有统计学意义(P < 0.05)。如表 4所示,进一步两两比较,各发作期组较相应的间歇期组SK3 mRNA下降(模型组U=-3.000,P=0.001;干预组U=-3.046,P=0.001),差异有统计学意义;与模型发作期组比较,干预发作期组(U=-1.158,P=0.279) SK3 mRNA表达无明显差异;与模型间歇期组比较,干预间歇期组(U=-0.156,P=0.161) SK3 mRNA表达无明显差异。
| 组别 | M (P25, P75) | U | P |
| 对照组 | 0.916(0.899, 0.931) | ||
| 模型发作期组 | 0.830(0.824, 0.848) | -3.363 | 0.000 |
| 模型间歇期组 | 0.860(0.852, 0.880) | -3.048 | 0.001 |
| 干预发作期组 | 0.825(0.806, 0.832) | -3.361 | 0.000 |
| 干预间歇期组 | 0.850(0.840, 0.868) | -3.151 | 0.001 |
各组SK3 mRNA电泳如图 1所示。
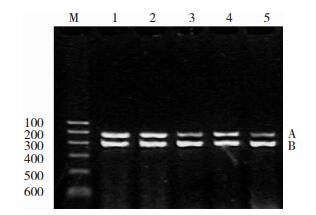
|
| 图 1 各组小电导钙激活型钾通道SK3 mRNA表达的电泳图。 注:A:SK3 mRNA;B:β-actin mRNA;M:Marker;1:对照组;2:模型发作期组;3:模型间歇期组;4:干预发作期组;5:干预间歇期组。 |
与对照组比较,模型组、干预组无论发作期组还是间歇期组SK3蛋白表达均下降,差异有统计学意义(P < 0.05)。如表 5所示,进一步两两比较,各发作期组较相应的间歇期组SK3蛋白下降(模型组U=-2.941,P=0.002;干预组U=-2.938,P=0.002),差异有统计学意义;而与模型发作期组比较,干预发作期组(U=-1.050,P=0.328) SK3蛋白表达无明显差异;与模型间歇期组比较,干预间歇期组(U=-0.947,P=0.382) SK3蛋白表达无明显差异。
| 组别 | M (P25, P75) | U | P |
| 对照组 | 0.974(0.950, 0.987) | ||
| 模型发作期组 | 0.915(0.907, 0.929) | -3.361 | 0.000 |
| 模型间歇期组 | 0.942(0.929, 0.949) | -3.046 | 0.001 |
| 干预发作期组 | 0.922(0.914, 0.935) | -3.364 | 0.000 |
| 干预间歇期组 | 0.948(0.932, 0.957) | -2.890 | 0.002 |
各组SK3蛋白电泳如图 2所示:
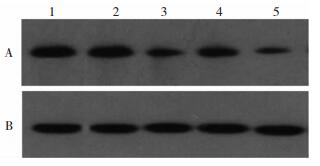
|
| 图 2 各组小电导钙激活型钾通道SK3蛋白表达的电泳图。 注:A:小电导钙激活型钾通道SK3蛋白;B:β-actin;1:对照组;2:模型发作期组;3:模型间歇期组;4:干预发作期组;5:干预间歇期组 |
1995年Tassorelli等建立了硝酸甘油偏头大鼠模型,该模型具有经济、操作简单、较好的重复性、造模成功率高的特点。该动物模型行为学表现与人类偏头痛有一定相似性,较好地复制了偏头痛三叉神经血管学说机制。
SK3是小电导钙激活型钾通道(small conductance calcium-activated potassium channels, SK) 家族中的一员,该家族又分为:SK1、SK2和SK3,三者的结构和功能相近。有研究认为编码SK3基因的多态性和偏头痛有关,可能会增加偏头痛发生的易感性[8, 9]。SK3在中脑导水管周围灰质、三叉神经脊束核、中缝核、黑质致密部、蓝斑等部位表达丰富,尤其是在脑干多巴胺能神经元高表达[10]。多巴胺能神经元分泌的神经递质主要包括5-羟色胺(5-HT)、多巴胺(DA) 和去甲肾上腺素,这些神经递质均被认为和偏头痛的病理生理有关。SK3通过控制多巴胺能神经元发放动作电位的频率和持续时间调节多巴胺递质的释放,并改变神经元放电模式,与神经元兴奋性及其传导密切相关[11]。研究表明,偏头痛是在基因易感性的背景下神经元过度兴奋的结果[12]。脑干的兴奋激活在偏头痛的疼痛传导途径中处于核心位置[13],尤其是中脑导水管周围灰质、蓝斑、中缝大核的激活与偏头痛的始动及上行、下行疼痛调节通路密切相关[3],而这些重要部位正是SK3密集区域。使用选择性的SK3受体阻滞剂能增强麻醉大鼠神经元对伤害刺激疼痛反应的敏感性[14]。我们选择大鼠偏头痛模型脑干为研究部位,结果发现模型组、药物干预组无论是发作期还是间歇期的SK3 mRNA及其蛋白表达水平均较对照组降低,而发作期组更低,虽然间歇期组有所升高,但仍未达对照组水平。我们推测脑干SK3的表达下调,可能引起了多巴胺、5-HT等递质的释放异常,同时导致细胞兴奋性增高,表现为激活状态或者是易激活的状态,刺激阈值降低,当刺激来临后即启动一次新的偏头痛发作。
氟桂利嗪是偏头痛治疗指南推荐的经典药物,其可能通过阻滞钙及钠离子通道,降低皮质及外周伤害感受器兴奋性、降低5-HT的释放及抑制神经血管炎症反应等途径发挥作用[15]。在本试验中,我们选用氟桂利嗪进行药物干预旨在研究该非选择性的钠钾离子通道阻滞剂是否也能通过SK3离子通道发挥作用。实验结果发现氟桂利嗪干预组和模型组比较,药物干预后动物的行为学有明显改善,说明药物的治疗是切实有效的,但SK3的表达水平无明显变化,提示该药对偏头痛的干预可能不是通过影响SK3的表达水平起作用的,而是否影响离子通道的功能状态还需进一步研究。
| [1] | 李舜伟, 李焰生, 刘若卓, 等. 中国偏头痛诊断治疗指南. 中国疼痛医学杂志, 2011, 17(2): 65–83. |
| [2] | 李婴婴, 陈春富. 偏头痛的性别差异. 国际神经病学神经外科学杂志, 2016, 43(1): 83–87. |
| [3] | Tajti J1, Szok D, Párdutz á, et al. Where does a migraine attack originate?. J Neural Transm (Vienna), 2012, 119(5): 557–568. DOI:10.1007/s00702-012-0788-9 |
| [4] | Dahlem MA, Schumacher J, Hübel N. Linking a genetic defect in migraine to spreading depression in a computational model. Peer J, 2014, 2: e379. DOI:10.7717/peerj.379 |
| [5] | Mössner R1, Weichselbaum A, Marziniak M, et al. A highly polymorphic poly-glutamine stretch in the potassiume channel KCNN3 in migraine. Headache, 2005, 45: 132–136. DOI:10.1111/hed.2005.45.issue-2 |
| [6] | Tassorelli C, Creco R, Wang D, et al. Nitroglycerin induces hyperalgesia in rats-a time-course study. Eur J Pharmacol, 2003, 464(2-3): 159–162. DOI:10.1016/S0014-2999(03)01421-3 |
| [7] | 王成云, 金善泉, 刘东, 等. 氟桂利嗪对大鼠偏头痛模型三叉神经节内核苷酸结合寡聚化结构域样受体3的影响. 中华老年心脑血管病杂志, 2016, 18(3): 305–308. |
| [8] | Curtain R, Sundholm J, Lea R, et al. Association analysis of a highly polymorphic CAG repeat in the human potassium channel gene KCNN3 and migraine susceptibility. BMC Med Genet, 2005, 6: 32. |
| [9] | Cox HC1, Lea RA, Bellis C, et al. Variants in the human potassium channel gene (KCNN3) are associated with migraine in a high risk genetic isolate. J Headache Pain, 2011, 12: 603–608. DOI:10.1007/s10194-011-0392-7 |
| [10] | Sailer CA, Kaufmann WA, Marksteiner J, et al. Comparative immunohistochemical distribution of three small-conductance Ca2+-activated potassium channel subunits, SK1, SK2, and SK3 in mouse brain. Mol Cell Neurosci, 2004, 26: 458–469. DOI:10.1016/j.mcn.2004.03.002 |
| [11] | Deignan J1, Luján R, Bond C, et al. SK2 and SK3 expressssion differentially affect firing frequency and precision in dopamine neurons. Neurosci, 2012, 217: 267–276. |
| [12] | Ferrari MD, Klever RR, Terwindt GM, et al. Migraine pathophysiology:lessons from mouse models and human genetics. Lancet Neurol, 2015, 14(1): 65–80. DOI:10.1016/S1474-4422(14)70220-0 |
| [13] | Akerman S, Holland PR, Goadsby PJ. Diencephalic and brainstem mechanisms in migraine. Nat Rev Neurosci, 2011, 12(10): 570–584. DOI:10.1038/nrn3057 |
| [14] | Hipólito L, Fakira AK, Cabañero D, et al. In vivo activation of theSKchannel in the spinal cord reduces the NMDA receptor antagonist dose needed to produce antinociception in an inflammatory pain model. Pain, 2015, 156(5): 849–858. DOI:10.1097/j.pain.0000000000000124 |
| [15] | Ye Q, Wang Q, Yan LY, et al. Flunarizine inhibits sensory neuron excitability by blocking voltage-gated Na+ and Ca2+ currents in trigeminal ganglion neurons. Chin Med J (Engl), 2011, 124(17): 2649–2655. |
 2016, Vol. 43
2016, Vol. 43




